无花果内源酵母的筛选及鉴定
邓星星,江 英*,卢志强,王 璐,陈国刚,王陈强
(石河子大学食品学院,新疆 石河子 832000)
无花果(Ficus caricaLinn)是一种开花植物,隶属于桑科榕属,富含黄酮、多糖、超氧化物歧化酶(superoxide dismutase,SOD)等具有防治心血管疾病和老年性痴呆症的生理活性物质及具有抗癌功效的呋喃香豆素内酯等物质[1-3]。研究表明,无花果不仅具有抗氧化、抗病毒、抗菌的作用,还具有降血糖、降低血胆固醇、抗癌等作用[4-5]。
无花果采后极易软化、褐变、腐败,常温条件下只能保存1~2 d,很难长途运销[6]。无花果以鲜食和无花果干果为主,较少用于深加工,这就使得无花果产业模式单一,其发展在一定程度上受到制约。而无花果酒作为无花果的深加工产品能很好的解决这一问题。无花果酒在充分利用无花果资源的同时有着自己独特的保健功能,更适合现代生活[7]。无花果酒的酿造现在市场上多为果酒的酿酒酵母,专用的无花果酿酒酵母很少。果酒的酿酒酵母虽然经过长期的筛选与改良,发酵性能较好,但是可能不太适用无花果酒的发酵,会使酒中甲醇和杂醇油的含量偏高,缺乏无花果特有的风味[8-9]。
新疆是我国无花果主产区之一,其中阿图什地区的无花果享有盛名,被誉为“无花果之乡”,目前已经获得无花果原产地域保护[10]。为了寻找优良的无花果酿酒酵母,筛选无花果自身的内源酵母,本实验选择新疆阿图什的大无花果干为原料,研究了菌株的筛选,菌株的生长特性,菌株的发酵特性以及菌株在酒精和二氧化硫胁迫下,生长特性的变化,最后对菌株进行内转录间隔区(internal transcribed spacer,ITS)序列分析。为无花果内源酵母酿造果酒提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料及试剂
新疆阿图什大无花果果干:购于干果市场;白砂糖(食用级):购于市场;酵母粉、蛋白胨、琼脂粉:北京奥博星生物技术有限责任公司;葡萄糖、氢氧化钠、无水乙醇、甘油:天津市致远化工有限公司;盐酸:北京化工厂;亚硫酸:北京世纪拓鑫精细化工有限公司;偏重亚硫酸钾:国药集团化学试剂有限公司:甲醇(色谱纯)、异戊醇(色谱纯)、异丁醇(色谱纯):天津市光复精细化工研究所;果胶酶:法国LALLEMAND集团;PCR 试剂及DNA Maker:宝生物工程有限公司产品;Goldview DNA 染料:北京赛百盛基因技术有限公司;PCR 引物:上海美吉生物医药科技有限公司。
1.1.2 培养基
无花果发酵培养基(20°Bx):无花果干按料液比1∶9(g∶mL)进行打浆,加入0.03%的果胶酶,45 ℃酶解2 h,然后加入白砂糖,调节可溶性固形物含量为20%,121 ℃灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:酵母粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,121 ℃灭菌20 min。根据发酵和培养要求,调整糖度和pH值。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母粉10 g/L,葡萄糖20 g/L,蛋白胨20 g/L,琼脂粉20 g/L,121 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ-2D 双人单面洁净工作台:苏州苏洁净化设备有限公司;ZXSD-1160 全自动新型生化培养箱:上海智城分析仪器制造有限公司;722可见分光光度计:上海精密科技有限公司;BSA224S电子天平:北京赛多利斯天平有限公司;WYT-32型手持折光仪:福建泉州光学仪器厂;LDZX-40Ⅱ型立式自动电热压力蒸汽灭菌器:上海申安医疗器械厂;XSP-4C双目生物显微镜:上海绘统光学仪器厂;BL-206-Ⅱ型高速冷冻离心机:上海安亭科技仪器厂;PowerPac Basic电泳仪、JS680C凝胶成像仪、PTC-0220 PCR仪:美国Bio-Rad公司;MultiNA核酸定量仪:日本岛津仪器有限公司。
1.3 试验方法
1.3.1 无花果内源酵母的初步筛选和富集培养
选取无花果干100 g,放入预先准备好的烧杯中,向烧杯中倒入体积分数为75%的酒精,使整个果实淹没在酒精中2 min,用灭过菌的滤纸片擦干,然后用无菌水冲洗3遍,无菌滤纸吸干;再用3%次氯酸钠浸泡2 min,无菌滤纸吸干后,无菌水冲洗4遍。将未使用的无菌水接种作为空白对照,以验证水的灭菌效果同时避免引入其他杂菌。无花果表面消毒后取最后一次冲洗的无菌水作为对照,以验证表面消毒效果[11-13]。然后,加入300 mL无菌水打浆,将浆液装入500 mL的无菌三角瓶中,并添加偏重亚硫酸钾20 mg于浆液中,用8层干燥的纱布包扎瓶口,于生化培养箱中静置培养,温度为30 ℃,至浆液内产生气泡并能闻到酒香味后停止培养。
在无菌条件下,对发酵液进行不同浓度的梯度稀释,记录并编号,选取适宜的稀释梯度,将其涂布于YPD平板培养基上,并将不同浓度设计3个平行,于30 ℃静置培养48 h,通过菌落形态及镜检观察,初步确定酵母菌。经过划线分离纯化,挑起单菌落与YEPD试管培养基中进行富集培养。将富集后的酵母菌接入料液比为1∶9(g∶mL)的无花果浆液,通过白砂糖调节可溶性固形物含量为20%,静置发酵培养7 d。依据国家标准GB/T 15038—2006《葡萄酒、果酒通用分析方法》和GB/T 5009.48—2003《蒸馏酒与配制酒卫生标准的分析方法》,分别测定酒精度、甲醇和杂醇油含量。通过菌落形态及发酵特性对比完成初步筛选。
1.3.2 菌株发酵生长特性对比
pH对酵母菌生长的影响:将初步筛选的酵母菌分别接入pH值为4.0、4.5、5.0、5.5、6.0、6.5的YEPD培养基(8°Bx)中,接种量为1×105CFU/mL,温度为30 ℃,静置培养12 h,测定OD600nm[14],考察pH对酵母菌生长的影响。
温度对酵母菌生长的影响:将初步筛选的酵母菌接入适宜pH的YEPD(8 °Bx)中,接种量为1×105CFU/mL,分别在26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、36 ℃静置培养12 h,测定OD600nm,考察温度对酵母菌生长的影响。
接种量对酵母菌的生长的影响:将初步筛选的酵母菌接入适宜pH,适宜温度的YEPD培养基(8°Bx)中,接种量分别为0.5×105CFU/mL,1.0×105CFU/mL和2.0×105CFU/mL,静置培养12 h,测定OD600nm,考察接种量对酵母菌生长的影响。
1.3.3 生长曲线的绘制
将初步筛选的酵母菌接入适宜pH的YEPD培养基(8°Bx)中,接种量为1×105CFU/mL,温度分别为对应的适宜温度和26 ℃,静置培养24 h,每隔2 h取样测定OD600nm,绘制酵母菌的生长曲线。
1.3.4 酵母菌生长耐受性试验
(1)酵母菌对乙醇及二氧化硫的耐受性测试
采用杜氏管发酵法测定酵母菌对乙醇及二氧化硫的耐受性。通过无菌过滤方式分别加入无水乙醇及偏重亚硫酸钾,使得YEPD培养基(8°Bx)的乙醇体积分数分别为0、5%、8%、11%、14%、17%,二氧化硫的含量分别为0、60 mg/L、120 mg/L、180 mg/L、240 mg/L、300 mg/L,接入酵母菌,接种量为1×105CFU/mL,pH值为5.0,温度为30 ℃,静置培养72 h,观察杜氏小管中的产生气泡的情况。
(2)发酵过程中总糖和酒精度的变化
将筛选的菌株接种到YEPD发酵培养基上,调整糖度使得可溶性固形物含量为20%,接种量为1×105CFU/mL,pH值为5.0,温度为30 ℃,静置培养,每天测定糖度,并取样测定酒精度和总糖含量,至糖度到达8%,转移至15 ℃以下,低温陈酿15 d。
(3)分子生物学鉴定(ITS序列分析)
将胶模具培养至对数生长期,离心收集酵母菌。使用脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取目的酵母菌的基因组DNA。经1%琼脂糖凝胶中电泳检测并确认提取成功后,进行ITS rDNA 基因片段的聚合酶链反应(polymerase chain reaction,PCR)扩增[9]。所用通用引物为ITS1(5′TCCGTAGGTGAAC-CTGCGC3′)和ITS4(5′TCCTCCGCTTATTGATAT-GC3′)。PCR 反应条件是:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,体系运行4个循环,最后72 ℃延伸10 min。PCR 产物用1%琼脂糖凝胶中电泳检测,取胶体于UV1 成像系统拍照,测序。将PCR 产物ITS 测序结果输入美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站的核酸数据库比对系统,利用Blast 程序进行核酸序列比对分析。用MEGA 5.0 软件构建系统发育树,进行亲缘关系和系统发育分析。
2 结果与分析
2.1 无花果内源酵母的初步筛选
通过对发酵液的稀释涂布、分离纯化,得到3株生长度比较高的菌株,菌落表面光滑,颜色均一,为乳白色。分离获得的菌株呈球形,卵圆形或梭形,均符合酵母菌的菌落特征,初步确定为酵母菌,经显微镜观察如图1所示。然后对这3株酵母菌富集培养,并对富集培养后的菌落形态特征和发酵特性进行研究,结果如表1所示。

图1 3株分离菌株的菌体形态Fig.1 Cell morphology of three isolated yeast strains
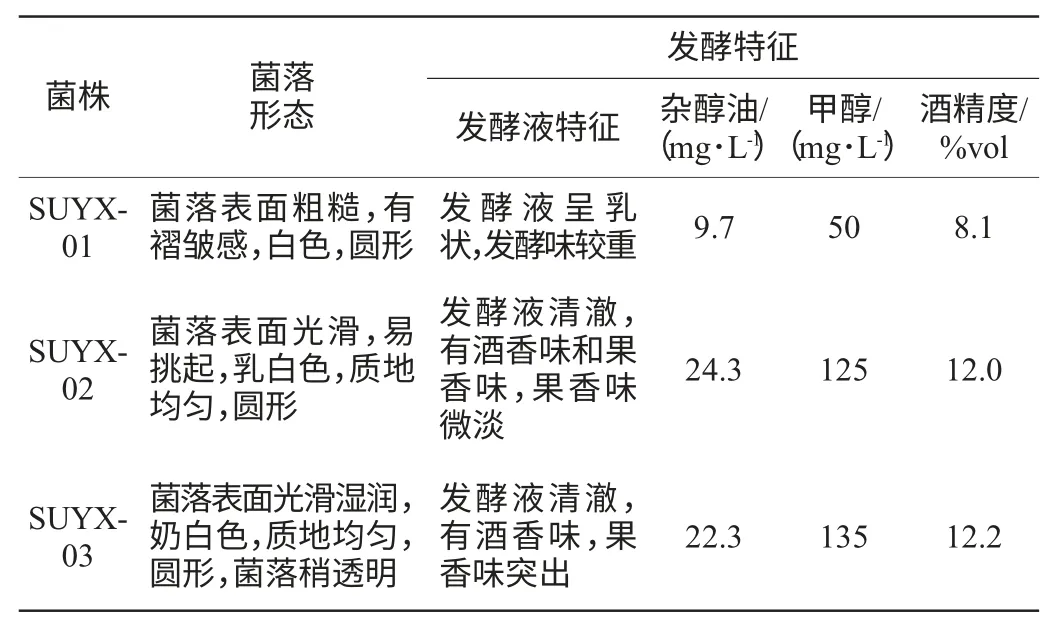
表1 无花果内源酵母的菌落形态和发酵特性Table 1 Colony characteristics and fermentation properties of endogenous yeast from fig fruit
SUYX-02和SUYX-03经纯化后,在YPD平板培养基上生长48 h的菌落生长状况见图2。由表1、图2可知,虽然酵母菌SUYX-01的发酵液中甲醇和杂醇油的含量都很低,但是发酵液浑浊,发酵味较重,酒精度明显偏低,不是优良的发酵菌株。SUYX-02和SUYX-03的发酵液酒精度较高,而且有果香味,杂醇油含量虽然有点高,但在国家标准范围内,甲醇含量符合国家标准。而且对于成品酒杂醇油的含量可以进行工艺优化来降低。比较而言,SUYX-02和SUYX-03菌株适合无花果酒发酵,因此对其生长特性和发酵特性进行深入研究。
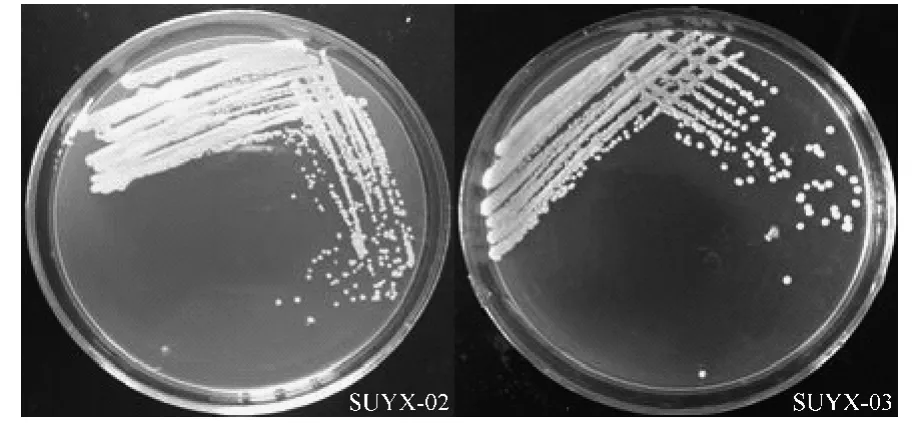
图2 酵母菌SUYX-02和SUYX-03生长48 h特征Fig.2 The character of strains SUYX-02 and SUYX-03 on YPD medium at 48 h
2.2 酵母菌SUXY-02和SUYX-03生长特性对比
2.2.1 pH对酵母菌生长的影响

图3 pH对酵母菌生长的影响Fig.3 Effects of p H on yeast growth
由图3可知,SUYX-02在pH较低和较高时,生长量都较低,在pH为5.0左右时取得较大的生长量时OD600nm为0.59;SUYX-03生长量在pH 4.0~5.5时逐渐增大,在pH为5.5时达到最大值OD600nm为0.61。酵母菌不同,最适合酵母菌生长的pH也有所差异。在本实验条件下,酵母菌SUYX-02适宜pH值为5.0,SUYX-03的适宜pH值为5.5。
2.2.2 温度对酵母菌生长的影响
由图4可知,酵母菌SUYX-02随着温度的增加,生长量逐渐增大,在32 ℃取得最大值时OD600nm为0.68,随后生长量逐渐下降。酵母菌SUYX-03在30 ℃之前生长量随温度也是逐渐增加,并在30 ℃取得最大生长量时OD600nm为0.72,且最大生长量比SUYX-02的最大生长量大,30 ℃之后,随温度增加酵母菌SUYX-03的生长量迅速下降。在本实验条件下SUYX-02的最适温度为32 ℃,SUYX-03的最适温度为30 ℃。

图4 温度对酵母菌生长的影响Fig.4 Effects of temperature on yeast growth
2.2.3 接种量对酵母菌生长的影响

图5 接种量对酵母菌的生长影响Fig.5 Effects of inoculum on yeast growth
由图5可知,酵母菌SUYX-02和SUYX-03在自身适宜的温度和pH生长条件下,随着接种量的增加生长量也随之增加。在接种量为0.5×105CFU/mL、1.0×105CFU/mL时,生长量虽都有增加但酵母菌SUYX-03始终比SUYX-02的生长量大,接种量为2.0×105CFU/mL时酵母菌SUYX-02超过SUYX-03的生长量,说明酵母菌SUYX-02生长迅速。接种量过低酵母菌种发酵生长较慢,影响发酵进度;接种量过高酵母菌种发酵生长较快,难以控制发酵进度[9]。对于工业生产,发酵接种量的选择要依据具体的生产实际情况而定。对于本实验,为了使得两株酵母菌的生长量差异较小,选择1.0×105CFU/mL接种量来进行发酵试验。
2.3 酵母菌生长曲线的测定
两株酵母菌的生长曲线见图6。酵母菌的生长曲线很好的显示了酵母菌在生长周期内的生长规律,了解酵母菌的生长周期,掌握其最佳生长阶段,对于酵母类产品的更好地生产就显得至关重要[15]。通过对两株酵母菌的最佳发酵条件下进行生长曲线的测定,能对这两株菌的生长规律有着更深的了解。

图6 酵母菌的生长曲线Fig.6 Growth curve of yeast
由图6可知,对于酵母菌SUYX-03,其对数生长期为4~14 h,此时期酵母菌生长迅速酵母繁殖速度最旺盛,并且出芽率最高,14~24 h为平稳期,在此期菌体产量与营养物质的消耗间呈现出有规律的比例关系,>24 h后进入衰亡期,在此期间由于酵母菌SUYX-02生长迅速,代谢旺盛,二氧化碳迅速生成,在发酵液中产生气泡,对OD值的测量产生影响;对于酵母菌SUYX-02,其对数生长期为4~14 h,稳定期为14~28 h,>28 h之后进入衰亡期。酵母菌SUYX-03对数期和稳定期有一定的持续时间,使得该酵母菌在生产应用中有利于生产取菌及收集代谢产物。
2.4 酵母菌生长耐受性试验结果
2.4.1 乙醇耐受性
两株酵母菌乙醇耐受性结果见表2。由表2可知,当乙醇体积分数为11%时,杜氏小管内有大量的气泡产生;当乙醇体积分数为14%时,杜氏小管内有极少的气泡产生,说明酵母菌SUYX-02的最高乙醇耐受性为11%。当乙醇体积分数为14%时,杜氏小管内有大量的气泡产生;当乙醇体积分数为17%时,杜氏小管内有极少的气泡产生,说明酵母菌SUYX-03的最高乙醇耐受性为14%。酵母菌SUYX-02的乙醇耐受性偏低,而酵母菌SUYX-03的乙醇耐受性较好,适合一般酒精度的果酒发酵。

表2 酵母菌乙醇耐受性Table 2 Ethanol tolerance of yeast strains
2.4.2 二氧化硫耐受性
两株酵母菌二氧化硫耐受性结果见表3。由表3可知,当二氧化硫添加量为240 mg/L,杜氏小管内有较多的气泡产生;当二氧化硫添加量为300 mg/L,杜氏小管内有较少的气泡产生,因此酵母菌SUYX-02的最高二氧化硫耐受性为240 mg/L。当二氧化硫添加量为300 mg/L,杜氏小管内有较多的气泡产生;当二氧化硫添加量为360 mg/L,杜氏小管内有较少的气泡产生,因此酵母菌SUYX-03的最高二氧化硫耐受性为300 mg/L。酵母菌SUYX-03的二氧化硫耐受性较好,符合果酒生产要求。

表3 酵母菌二氧化硫耐受性Table 3 SO2tolerance of yeast
2.5 发酵过程中总糖和酒精度的变化结果分析
通过筛选得到的酵母菌运用到实际中发酵得到果酒,发酵性能的测定是判定酵母菌是否优良的重要依据,是判定酵母菌发酵性能的重要指标。将酵母菌SUYX-03接入无花果发酵培养基(20°Bx),温度为30 ℃,模拟实际发酵过程,对该菌株的发酵性能进行研究,结果见图7。

图7 酵母菌SUYX-03发酵过程中总糖及酒精度的变化Fig.7 Total sugar and alcohol content change in the fermentation broth of strain SUYX-03
由图7可知,在发酵周期内,随时间的增加酒精度随之增加,在第6天时达到最大的酒精度10.9%vol,同时发酵液中的总糖随之减少最终达至4 g/L左右。在15 ℃此条件下陈酿15 d,糖度降低为2.5 g/L,酒精度为10.5%vol,发酵比较彻底,符合果酒发酵标准,酵母菌SUYX-03可以作为酿酒酵母菌株。
2.6 分子生物学鉴定结果分析
将酵母菌株SUYX-02、SUYX-03进行ITS序列扩增,扩增结果见图8。由图8可知,在退火温度55 ℃条件下,两酵母扩增片段长度750~100 bp,特异性目的条带清晰且无杂带。将获得酵母菌SUYX-03的ITS 序列,进行BLAST同源比对,结果酵母菌SUYX-03与酵母菌同源性最高,同源性为97%。基于酵母菌ITS序列的相似性而构建系统发育树见图9。由图9可知根据同源性比较该菌酿酒酵母的亲缘关系最近。结合形态学结果与发酵特性,菌株SUYX-02、SUYX-03鉴定为酿酒酵母(Saccharomyces cerevisiae)。

图8 酵母菌ITS序列扩增产物琼脂糖凝胶电泳图Fig.8 Agarose gel electrophoretogram of yeast ITS sequences amplifying product

图9 SUYX-03菌株的ITS rDNA 的系统发育进化树Fig.9 ITS rDNA phylogenetic tree of strain SUYX-03
3 结论
从口感甘甜、营养丰富的新疆大无花果中经过筛选得到一株优良的酵母菌株SUYX-03,该酵母菌的适宜生长温度为30 ℃,适宜pH值为5.5,最大酒精耐受性为14%vol,最高二氧化硫耐受性为300 mg/L。从生长曲线上看出其对数生长期为4~14 h,对数期和稳定期时间合适,使得该酵母菌在生产应用中更利于生产取菌及收集代谢产物。在有害物质的生成方面,甲醇和杂醇油生成较少,符合果酒国家生产标准。
通过ITS序列分析,鉴定出菌株SUYX-03属于酵母属(Saccharomyce)中的酿酒酵母(Saccharomyces cerevisiae)。由发酵试验得出该酵母菌是适合无花果果酒制作的优良的酿酒酵母。
[1]朱定和,钟瑞敏,刘建南.无花果酒酿造工艺的研究[J].食品科技,2003(7):88-90.
[2]王 琳,岳田利.发酵型无花果酒酿造工艺研究[J].中国酿造,2005,24(10):59-62.
[3]余希成,卢 俊,曹为民.水溶性无花果多糖的微波提取技术[J].食品研究与开发,2009,30(9):19-23.
[4]王志国,何 德,金 洪,等.无花果抗癌作用的研究进展[J].现代生物医学进展,2010,10(11):2183-2186.
[5]JEONG M R,CHA J D,LEE Y E.Antibacterial activity of Korean fig(Ficus caricaL.)against food poisoning bacteria[J].Korean J Soc Food Cookery Sci,2005,21(5):84-93.
[6]姬长新,马 骏,关文强,等.无花果贮藏保鲜技术[J].保鲜与加工,2007,7(6):53.
[7]张宝善,陈锦屏,杨 莉,等.甲醇和杂醇油在红枣发酵酒中的变化及其控制研究[J].西北农林科技大学学报:自然科学版,2004,32(4):24-28.
[8]董亚晨,戴忆宁,蔡 瑾,等.无花果内源酵母的筛选、鉴定及发酵性能测试[J].中国食品学报,2014,14(8):240-247.
[9]董用鑫,李 玲,杨文宇,等.气相色谱法测定石榴葡萄酒中的甲醇和杂醇油[J].中国酿造,2013,32(3):142-145.
[10]马 骏,孙宝亚,关文强,等.阿图什无花果贮藏保鲜试验初报[J].保鲜与加工,2009,12(2):48-50.
[11]王志勇,刘秀娟.植物内生菌分离方法的研究现状[J].贵州农业科学,2014,42(1):152-155.
[12]常 燕,曹 军,王兆慧,等.夹竹桃内生菌杀虫活性研究[J].安徽农业科学,2011(10):202-203.
[13]李振东,陈秀蓉,李 鹏.紫花针茅内生细菌的分离与鉴定[J].草原与草坪,2011(1):8-12.
[14]左 勇,刘利平,鞠 帅,等.无花果果酒酵母的筛选及发酵性能研究[J].现代食品科技,2013,29(6):1293-1296.
[15]王秋菊,许 丽,崔一喆,等.酵母菌生长曲线的测定及不同生长时间麦芽汁糖度的变化[J].兽药与饲料添加剂,2006,2(1):8-9.

