酸枣果肉多糖的提取优化及抗氧化活性研究
张 璐
(山西省医药与生命科学研究院,山西 太原 030006)
酸枣(Ziziphus jujubaMill.)属鼠李科枣属植物,主要多分布于中国北方,其种仁入药[1]。酸枣果肉营养丰富,含有大量的脂肪、蛋白质、维生素及多种矿质元素,具有较高的生物活性和食疗价值,已经开发的产品有酸枣汁、酸枣酒、酸枣果酱、酸枣糕等。有研究报道酸枣果肉有增强小鼠的肌力、记忆力、食欲等作用[2-4]。近年来对多糖的保健作用引起人们的广泛的关注,发现很多植物多糖、食用菌多糖均具有多种生物活性[5-6],但对酸枣果肉多糖的提取工艺及抗氧化作用报道的较少。因此,本研究以酸枣果肉为研究对象,采用热水浸提法提取酸枣果肉多糖,正交试验法考察料液比、提取温度和提取时间3个因素对多糖提取率的影响。通过体外抗氧化评价体系研究酸枣果肉多糖对羟基自由基、超氧阴离子自由基和DPPH自由基清除活性,为酸枣的综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酸枣:采自山西省运城市降县山区。
1.1.2 试剂
石油醚(分析纯)、乙醇(分析纯):天津欧博凯化工有限公司;氯仿(分析纯):上海润捷化学试剂有限公司;正丁醇(分析纯):上海埃彼化学试剂有限公司,2,2-二苯代苦味肼(2,2-diphenyl-1-picrylhydrzyl,DPPH):美国Sigma公司。
1.2 仪器与设备
SCS-290电子天平:瑞士PRECISA;电热恒温鼓风干燥箱:上海博迅实业有限公司;SHB-Ⅲ循环水式真空泵:郑州长城科工贸有限公司;RE-52A型旋转蒸发仪:上海亚荣生化仪器设备有限公司;UV757CRT紫外可见分光光度计:上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 酸枣果肉预处理[7]
取新鲜酸枣去除果核,果肉在105 ℃条件下干燥至质量恒定,粉碎,过60目筛,按料液比1∶10(g∶mL),用沸程60~90 ℃的石油醚80 ℃回流脱脂2次,每次2 h,收集酸枣果肉滤渣,干燥,备用。
1.3.2 提取方法
取预处理过的酸枣果肉渣,按一定料液比设定不同的温度浸提、过滤、合并滤液、浓缩,加入4倍体积分数为95%的乙醇,4 ℃醇沉多糖24 h,离心,收集多糖沉淀物。再将多糖溶解于适量的蒸馏水中,按Sevage试剂(氯仿∶正丁醇=5∶1,V/V)与多糖溶液1∶4(V/V)混匀,采用Sevage法去除蛋白3次,分液漏斗去除有机层,浓缩多糖水溶液醇沉多糖,真空干燥,得到酸枣果肉多糖[8]。
1.3.3 多糖含量测定
采用蒽酮-硫酸法对酸枣果肉多糖进行测定[9]。多糖提取率计算公式如下:

1.3.4 单因素试验
分别准确称取5.0 g酸枣果肉渣,固定提取温度90 ℃,提取时间2 h,提取次数2次,在料液比1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL),提取温度60 ℃、70 ℃、80 ℃、90 ℃、100 ℃,提取时间0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,提取次数1次、2次、3次条件下,考察料液比、提取温度、提取时间和提取次数对酸枣果肉多糖提取率的影响。
1.3.5 正交优化试验
在单因素试验的基础上,采用L9(34)设计正交试验综合考察料液比(A)、提取温度(B)、提取时间(C)对试验结果的影响,因素与水平见表1,每组做3次重复试验。在选取的最佳条件下,进行3次验证试验,计算酸枣果肉多糖的提取率。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization
1.3.6 酸枣果肉多糖体外抗氧化活性测定
(1)清除羟基自由基能力测定
采用H2O2/Fe2+氧化法测定酸枣果肉多糖清除羟基自由基的能力[10-12]。准确量取2 mL质量浓度为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL的酸枣果肉多糖水溶液,依次加入6 mmol/L的FeSO4溶液1.0 mL,混匀,6 mmol/L的H2O2溶液1.0 mL,混匀,静置10 min,加入6 mmol/L 的水杨酸0.5 mL,混匀,静置30 min,于波长510 nm处测定吸光度值(Ai)。以VC为阳性对照,空白组以双蒸水代替多糖溶液,测定吸光度值(A0);对照组以蒸馏水代替水杨酸的多糖溶液测定吸光度值(Ac)。羟基自由基清除率计算公式如下:

(2)清除超氧阴离子自由基
采用邻苯三酚自氧化法[13],测定酸枣果肉多糖对(O2-·)的清除能力[14-15]。分别精确量取1 mL质量浓度为10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL、80 μg/mL的酸枣果肉多糖水溶液,各加入4.5 mL的50 mmol/L Tris-HCl缓冲液(pH 8.2)和3.2 mL去离子水,25℃水浴中保温30 min,再加入25℃水浴中预热的6 mmol/L邻苯三酚(用10 mmol/L盐酸配制)0.3 mL,用分光光度计在波长320 nm处每30 s测定溶液的吸光度值(ΔAi)。以VC为阳性对照,对照组用等体积的去离子水代替样品溶液,测定吸光度值(ΔA0),每个样品测3个重复,取平均值。超氧阴离子清除率计算公式如下:

(3)清除2,2-二苯代苦味肼(DPPH)自由基[16-18]
取1 mL浓度为1.0×10-4mol/L 的DPPH溶液,用体积分数为75%乙醇定容至10 mL,以体积分数为75%乙醇为空白对照,用分光光度计于波长517 nm 处测定吸光度值(A0)。分别精确量取1mL质量浓度为10μg/mL、20μg/mL、30μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL、80 μg/mL的酸枣果肉多糖水溶液,各加入1 mL 浓度为1.0×10-4mol/L 的DPPH 溶液,用体积分数为75%乙醇溶剂定容至10 mL,以体积分数为75%乙醇为空白对照,用分光光度计于波长517 nm处测定吸光度值(Ai);再分别量取0.5mL质量浓度为10μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL、80 μg/mL酸枣果肉多糖水溶液,用体积分数为75%乙醇溶剂定容至10 mL,以VC为阳性对照,以体积分数为75%乙醇为空白对照,用分光光度计于波长517 nm 处测定吸光度值(Ac)。DPPH自由基清除率计算公式如下:

2 结果与分析
2.1 葡萄糖标准曲线

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
由图1 可知,以吸光度值(y)为纵坐标,葡萄糖标准品质量浓度(x)为横坐标,绘制葡萄糖标准曲线,回归方程为:y=0.007 4x+0.038 5,相关系数R2=0.999 1,表明线性关系良好。
2.2 单因素试验结果
2.2.1 料液比对试验结果的影响

图2 料液比对试验的结果影响Fig.2 Effect of liquid-solid ratio on extraction rate of polysaccharides
由图2可知,随着料液比的增大,酸枣果肉多糖的提取率逐渐增大,料液比为1∶20(g∶mL)以后提取率逐渐稳定,因此选定1∶15(g∶mL)、1∶20(g∶mL)和1∶25(g∶mL)为正交试验中料液比的3个水平。
2.2.2 提取温度对试验结果的影响
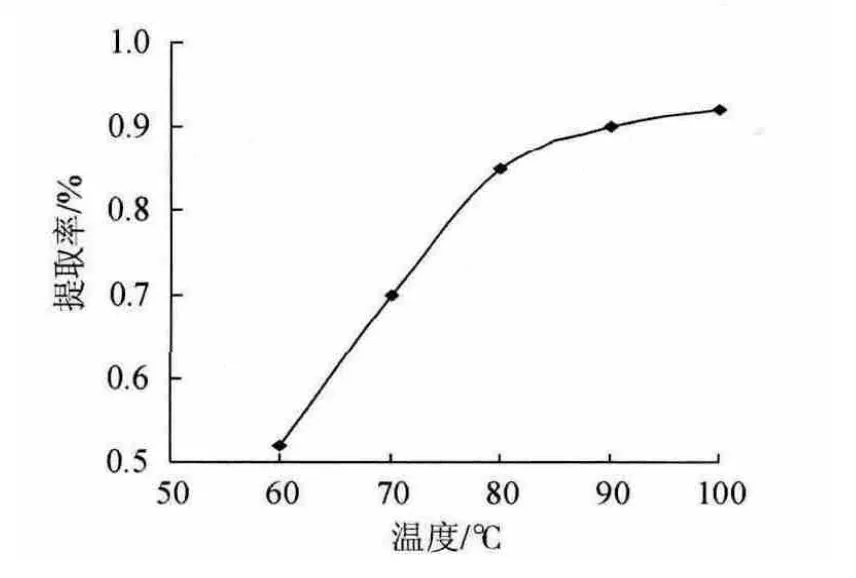
图3 提取温度对多糖提取率的影响Fig.3 Effect of extraction temperature on extraction rate of polysaccharides
由图3可知,随着提取温度的升高,酸枣果肉多糖的提取率逐渐增大,提取温度提高到80 ℃以后酸枣果肉多糖的提取率逐渐稳定,因此选定80 ℃、90 ℃和100 ℃为正交试验中提取温度的3个水平。
2.2.3 提取时间对试验结果的影响
由图4可知,随着提取时间的延长酸枣果肉多糖的提取率逐渐增大,提取时间延长到2.0 h以后酸枣果肉多糖的提取率逐渐稳定,因此选定1.5 h、2.0 h和2.5 h为正交试验中提取时间的3个水平。

图4 提取时间对试验结果的影响Fig.4 Effect of extraction time on extraction rate of polysaccharides
2.2.4 提取次数对试验结果的影响
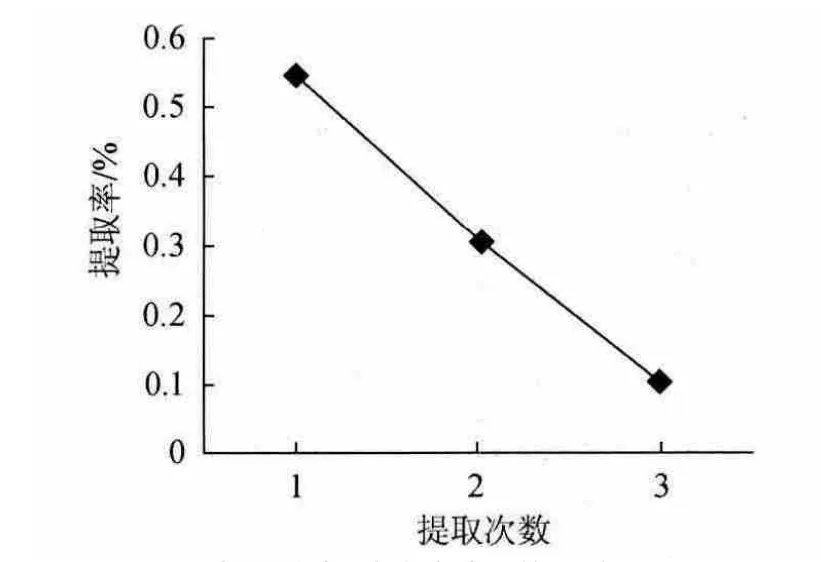
图5 提取次数对试验结果的影响Fig.5 Effect of extraction times on extraction rate of polysaccharides
由图5可知,第1次提取的酸枣果肉多糖得率最高,随着提取次数的增多酸枣果肉多糖得率有所提高,但增幅不大,考虑提取成本费用,故提取2次为宜。
2.3 酸枣果肉提取条件优化正交试验结果
在单因素试验的基础上,以多糖提取率为考察指标,采用L9(34)设计正交试验综合考察料液比(A)、提取温度(B)、提取时间(C)的影响,结果与分析见表2,方差分析见表3。

表2 提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for the extraction conditions optimization

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2可知,影响酸枣果肉多糖提取得率的因素主次关系为:提取温度对酸枣果肉多糖提取率影响最大,其次为料液比,提取时间对试验结果的影响相对较小,其最佳提取条件为A2B3C2,即料液比1∶20(g∶mL),提取温度100 ℃,提取时间2.0 h,提取2次。在此条件下进行验证试验(n=3),多糖提取率为(0.951±0.028)%。
由表3方差分析可知,提取温度对试验结果影响显著(P<0.05),料液比和提取时间对试验结果影响不显著(P>0.05)。
2.4 体外抗氧化活性测定结果
2.4.1 酸枣果肉多糖清除羟基自由基的结果

图6 酸枣果肉多糖对羟基自由基的清除率Fig.6 Scavenging rate of polysaccharides on hydroxyl radical
羟基自由基是活性氧中活性最强的一种自由基,其可以与细胞内的一切有机化合物反应,通过破坏脂肪、蛋白质和核酸代谢来损伤细胞的结构与功能,导致机体病变。因此对羟基自由基清除率是抗氧化作用的一个重要指标。由图6可知,酸枣果肉多糖质量浓度从0.2 mg/mL增大至1.0 mg/mL,对羟基自由基的清除能力也在增加。酸枣果肉多糖质量浓度达到1.0mg/mL时,清除率达最大值48.35%。多糖质量浓度从0.2 mg/mL增大至0.6 mg/mL,对·OH的清除率显著增加;当多糖质量浓度>0.6 mg/mL,随质量浓度的增加,清除率增加减缓,但清除率均小于VC。因此,酸枣果肉多糖对羟自由基具有一定的清除效果。
2.4.2 酸枣果肉多糖清除超氧阴离子自由基结果
超氧阴离子自由基具有一定的毒性,还可以通过反应生成其他氧自由基,从而损伤机体引起疾病。由图7可知,酸枣果肉多糖质量浓度从10 μg/mL增大至80 μg/mL,对超氧阴离子自由基的清除能力也明显增加。在酸枣果肉多糖质量浓度80 μg/mL时,对超氧阴离子自由基清除率达最大值43.77%,但清除率均小于VC。酸枣果肉多糖对超氧阴离子自由基也具有一定的清除效果。

图7 酸枣果肉多糖对超氧阴离子自由基的清除率Fig.7 Scavenging rate of wild jujube polysaccharides on superoxide anion radical
2.4.3 酸枣果肉多糖清除DPPH自由基的结果

图8 酸枣果肉多糖对DPPH自由基的清除率Fig.8 Scavenging rate of wild jujube polysaccharides on DPPH radical
DPPH 是一种稳定的氮中心自由基,可以捕获或清除其他的自由基,而被广泛用于测定生试样的抗氧化能力。由图8 可知,酸枣果肉多糖质量浓度从10 μg/mL增大至80 μg/mL,对DPPH自由基的清除能力也明显增加。在酸枣果肉多糖质量浓度80 μg/mL时,对DPPH自由基的清除率达最大值52.76%,但清除率均小于VC。酸枣果肉多糖对超氧阴离子自由基也具有一定的清除效果。
3 结论
在单因素试验的基础上进行正交试验,优化出酸枣果肉多糖的最佳提取条件为:料液比1∶20(g∶mL),提取温度100 ℃下,提取时间2.0 h,提取2次。在此条件下多糖提取率为(0.951±0.028)%。对酸枣果肉多糖的抗氧化活性的研究表明,酸枣果肉多糖对羟自由基、超氧阴离子自由基和DPPH自由基均有一定的清除作用,酸枣果肉多糖质量浓度为1.0 mg/mL时,对·OH的清除率为48.35%;在多糖质量浓度为80 μg/mL时,对O2-·的清除率为43.77%,对DPPH自由基的清除率为52.76%。酸枣果肉多糖具有一定的开发利用价值,本研究结果为酸枣的多功能产品开发利用提供理论依据。
[1]曲泽洲,王永蕙.中国果树志·枣卷[M].北京:中国林业出版社,1993.
[2]王向红,崔 同,刘孟军,等.不同品种枣的营养成分分析[J].营养学报,2002,24(2):206-208.
[3]郎 杰.酸枣多糖的提取及对免疫功能影响的初探[J].食品研究与开发,2013,34(4):35-36.
[4]郎杏彩,李明湘,贾秉义,等.酸枣仁肉多糖增强小鼠免疫功能和抗放射形损伤的实验研究[J].中国中药杂志,1991,16(6):366-368.
[5]MASUDA Y,ITO K KONISHI M,NANBA H,et al.A polysaccharide extracted fromGrifola frondosaenhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cancer[J].Cancer Immunol Immun,2010,59(10):1531-1541.
[6]马红樱,张 德,胡春香,等.植物活性多糖的研究进展[J].西北师范大学学报:自然科学版,2004,40(4):112-117.
[7]陈建斌,李冲伟.响应面法优化紫苏多糖的水提工艺[J].食品研究与开发,2014,35(9):27-31.
[8]陈国梁,张金文,陈宗礼,等.红枣多糖提取分离工艺的优化[J].食品科学,2006,27(3):149-152.
[9]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994.
[10]刘 骏.结晶紫分光光度法测定Fenton 反应产生的羟自由基[J].武汉工业学院学报,2005,24(2):53-55.
[11]刘力恒,王立升,王天文,等.小叶榕叶总黄酮含量测定、鉴别及其对羟自由基清除作用的研究[J].时珍国医国,2008,19(5):1078-1080.
[12]何 钢,颜 军,郭晓强,等.生何首乌多糖的单糖组成及清除羟自由基的活性测定[J].西北师范大学学报:自然科学版,2013,49(4):70-75.
[13]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009,28(6):155-157.
[14]李正鹏,吴 萍,吴苏青.树舌胞内多糖抗氧化活性的研究[J].食品工业科技,2010,31(6):108-110.
[15]李志洲,刘军海.甜杏仁有效成分分析及多糖的体外抗氧化性研究[J].氨基酸和生物资源,2008,30(4):34-36.
[16]韦献雅,殷丽琴,钟 成,等.DPPH 法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-332.
[17]程 超,李 伟.几种植物水溶性多糖的体外抗氧化作用[J].食品工业科技,2006,27(9):63-65.
[18]聂少平,谢明勇,罗 珍.用清除有机自由基DPPH 法评价茶叶多糖的抗氧化活性[J].食品科学,2006,27(3):34-36.

