食管癌患者微创与开胸切除术的临床疗效比较
张志锋,洪祎纯,黄豪达,吴伟斌,曾贵青,蔡 南
(揭阳市人民医院心胸外科,广东 揭阳 522000)
食管癌患者微创与开胸切除术的临床疗效比较
张志锋,洪祎纯,黄豪达,吴伟斌,曾贵青,蔡 南
(揭阳市人民医院心胸外科,广东 揭阳 522000)
目的 探讨微创食管癌切除术与开胸食管癌切除术对患者术后恢复、肺功能以及并发症的影响。方法选取2009年2月至2014年10月间在本院接受手术治疗的80例食管癌患者作为研究对象,随机将其分为观察组和对照组各40例,观察组接受微创手术治疗,对照组接受开胸手术治疗,比较两组患者的术后恢复、肺功能以及并发症的差异。结果观察组患者的术后肛门排气时间、总住院时间短于对照组,术后第1天胸腔引流量少于对照组,差异均有统计学意义(P<0.05);观察组患者的术后一秒用力呼气容积(FEV1)、第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)、呼气峰流量(PEF)水平高于对照组,差异均有统计学意义(P<0.05);观察组患者的术后肺部感染、吻合口瘘、乳糜胸、喉返神经损伤、胃排空延迟、切口液化的发生率分别为2.5%、0、0、2.5%、5.0%,均低于对照组的17.5%、7.5%、12.5%、12.5%、15.0%,差异均有统计学意义(P<0.05)。结论微创食管癌切除术有利于患者的术后早期恢复,在减少食管癌患者的术后肺损伤及一系列并发症发生方面具有优势。
食管癌;微创手术;肺功能;术后恢复
食管癌为临床最多见的消化系统恶性肿瘤性疾病之一,对于不伴有远处转移的患者可选择根治性手术进行治疗。不同手术方式的选择对患者的最终治疗结局影响较大,目前治疗食管癌主要有胸腹腔镜微创手术及传统开放手术两类。开放手术操作过程相对简单,但是手术切口巨大、需要切断肋骨,患者术后疼痛且可产生一系列机体内环境变化[1]。微创手术对手术者及器械均提出了更高的要求,但是其手术创伤小、无需切断肋骨保持了胸壁的完整性,患者术后疼痛较轻、其他相关脏器的损伤亦较小,可能存在部分优势[2]。本文主要分析微创与开胸食管癌切除术对患者术后恢复、肺功能以及并发症情况的影响,现报道如下:
1 资料与方法
1.1 一般资料 选择2009年2月至2014年10月期间在我院接受手术治疗的80例食管癌患者作为研究对象。入组患者按照随机数表法分为观察组和对照组各40例。观察组患者男性21例,女性19例,年龄50~73岁,平均(62.11±9.34)岁,采用腔镜微创治疗;对照组患者男性22例,女性18例,年龄51~72岁,平均(61.85±8.02)岁,采用开胸手术。两组患者的基线资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 手术方法
1.2.1 观察组 患者全麻诱导后置入双腔器官导管,进行健侧单肺通气以保证手术操作能够顺利实施。患者健侧卧位后选择腔镜观测孔(一般选择患者腋中线第7肋间,切口大小1.5 cm左右)、操作孔(腋后线第7肋间、肩胛下角线第8肋、腋前线第4肋,切口大小约为1.0 cm)。腔镜下探查肿瘤位置大小,打开纵膈胸膜,进行胸段食管分离,注意食管固有动脉、支气管动脉分支的结扎,喉返神经旁食管旁及隔上等位置的淋巴结清扫。切除病灶组织并清扫淋巴结组织,而后进行胸腔冲洗,复张患侧肺确保充分膨胀且无漏气。胸腔引流管由观测孔置入后逐层关闭胸腔,改变患者体位由垂直侧卧位至水平仰卧位,进行腹部及颈部手术。观测孔(脐部1.0 cm)、操作孔(双侧肋弓内侧1.0 cm),腹腔探查后进行网膜血管分离,避免误伤胃网膜血管,切断胃左血管及网膜左血管并进行淋巴清扫,彻底游离胃。切开暴露颈部浅肌群、左侧喉返神经及颈段食管,同时清扫对应淋巴结。切断食管并闭合食管远端,在剑突下做一3.0~5.0 cm正中切口,由腹腔切口拉出食管,最后清扫贲门旁淋巴结。根据测量孔至颈段食管距离完成管状胃成形,注意避免胃上提过程中出现扭转导致胸胃梗阻。将食管与管状胃进行吻合,间断缝合纵膈胸膜并固定于纵膈食管床[3]。以上操作完毕后留置胃肠减压管、十二指肠营养管,逐层关闭切口。
1.2.2 对照组 由第6肋间打开胸腔,切口大小约25 cm(胸腔具体操作同观察组)。胸腔操作完毕后患者改平卧位,做腹部正中切口(剑突至脐做15 cm切口),操作结束后于胸骨上做5 cm切口并与颈部吻合。对照组具体操作流程与观察组一致。
1.3 观察指标
1.3.1 术后恢复情况 两组患者采用不同手术方式后,记录肛门排气时间、胸腔引流量(术后第1天)和总住院时间。
1.3.2 肺功能 术前及术后1周记录两组患者肺功能,包括第1秒用力呼气量(FEV1)、第1秒用力呼气容积占用力肺活量百分比(FEV1/FVC)、呼气中峰流量(PEF)。
1.3.3 术后并发症 接受不同手术方法治疗后对患者进行为期两周的随访,记录肺部感染、吻合口瘘、乳糜胸、喉返神经损伤、胃排空延迟、切口液化等发生情况。
1.4 统计学方法 应用SPSS20.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验、计数资料采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 术后恢复情况 观察组患者的术后肛门排气时间和总住院时间均短于对照组,术后第1天胸腔引流量少于对照组,差异均具有统计学意义(P<0.05),见表1。
表1 两组患者的术后恢复情况(±s)

表1 两组患者的术后恢复情况(±s)
观察组(n=40)对照组(n=40) t值P值1.38±0.27 2.17±0.56 5.375<0.05 127.29±11.32 195.37±20.84 7.264<0.05 11.93±3.04 15.17±4.23 5.883<0.05
2.2 肺功能 术前组间肺功能各项指标比较差异均无统计学意义(P>0.05),但观察组患者的术后肺功能指标值均高于对照组,差异均具有统计学意义(P<0.05),见表2。
表2 两组患者术前及术后1周的肺功能比较(±s)
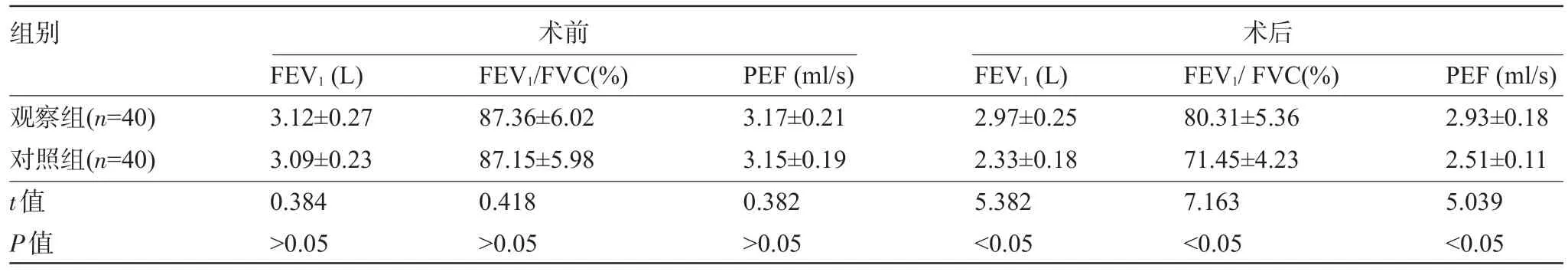
表2 两组患者术前及术后1周的肺功能比较(±s)
组别术前术后观察组(n=40)对照组(n=40) t值P值FEV1(L) 3.12±0.27 3.09±0.23 0.384>0.05 FEV1/FVC(%) 87.36±6.02 87.15±5.98 0.418>0.05 PEF(ml/s) 3.17±0.21 3.15±0.19 0.382>0.05 FEV1(L) 2.97±0.25 2.33±0.18 5.382<0.05 FEV1/FVC(%) 80.31±5.36 71.45±4.23 7.163<0.05 PEF(ml/s) 2.93±0.18 2.51±0.11 5.039<0.05
2.3 术后并发症 观察组患者的术后并发症发生率均低于对照组,差异均具有统计学意义(P<0.05),见表3。

表3 两组患者术后并发症比较[例(%)]
3 讨论
手术切除是目前治疗食管癌的首选方式[4],具体手术方式包括传统的开胸手术和新近发展起来的微创手术。开胸手术的操作相对简便,但是可对患者造成巨大的创伤,同时术中需要切断肋骨、肋间肌肉,对胸壁完整性造成毁灭性破坏,严重者术后甚至造成胸腔脏器压迫损伤。开放手术不可避免地会影响患者的术后恢复过程,这也成为其目前临床应用的瓶颈。食管癌微创手术的优势如下:(1)腔镜放大解剖结构、提高视野清晰度及手术安全性;(2)清晰辨认食管周围的血管、神经等精细结构,避免术中损伤;(3)不撑断肋骨、不切断胸壁肌肉,保持胸壁完整性,减轻患者的术后疼痛[5-6]。胸腹腔镜联合手术在减少手术创伤方面的优势显而易见,此术式也受到越来越多的临床学者的关注。开胸食管癌切除术与胸腹腔镜联合微创手术均有应用优势,在具体临床实践中该选择何种术式仍值得商榷[7]。
食管癌手术范围较广、手术损伤巨大,加上食管癌患者术前大多处于营养不良状态、自身免疫能力降低,手术创伤可以带给患者全身机能巨大的打击,部分患者术后持续处于机体功能损耗状态难以恢复,延长术后恢复时间的同时可严重降低手术治疗的效果[8]。为了比较开胸手术和微创手术的临床价值,我们首先分析了两组患者的术后恢复情况,结果显示:微创术后观察组患者的肛门排气时间、总住院时间短于对照组,术后第1天胸腔引流量少。微创手术的手术创伤小、对患者的自身免疫功能抑制程度较低,术后患者较易恢复正常的免疫功能,故胃肠道及膀胱功能也可早期恢复,早期恢复正常进食有助于提升患者的术后营养,进一步促进术后康复并缩短住院时间[9]。胸腔引流量的多少直接取决于术中的血管损伤及组织缝合程度,微创手术在腔镜放大视野下操作,降低了血管损伤概率,同时腔镜下缝合相对细致紧密,减少了术后吻合口瘘的几率,直接降低术后胸腔引流量。以上术后恢复情况均提示微创手术可以促进食管癌患者的术后恢复,对于更好实现治疗效果具有促进作用[10]。
食管癌手术在胸腔内操作具有肺组织损伤的风险,上述研究对比两种手术方式后患者的肺功能,结果显示:两组患者的术后肺功能均呈降低趋势,但观察组患者的肺功能指标优于对照组。刘亚州等[11]研究认为,开放手术中切断胸壁肌肉及肋骨,胸骨撑开器的牵拉可以造成胸壁血管、神经损伤,也是术后患者长期剧烈胸痛的直接原因。开放手术视野能见度及紧密度有限,术中牵拉翻动肺组织的操作较多,可引起一系列肺损伤(肺间质及呼吸膜的水肿、肺表面物质减少),患者术后阻塞型呼吸障碍常见,最终导致开放手术患者的术后肺通气及交换功能受损、肺功能指标值变化。微创手术相对创伤较小、不必撑开肋骨、术中视野清晰压迫肺部较少,对于肺功能的综合损伤轻于对照组,这是微创手术的一大优势。
术后并发症是外科手术后重点关注的项目之一,严重并发症的发生可以直接影响手术治疗效果甚至导致患者术后早期死亡。蒋清柏等[12]研究显示,腔镜手术患者的术后并发症发生率及死亡率低于开胸组。Maas等[13]认为食管癌腔镜手术与开胸手术的患者心血管并发症发生率无差异。本次研究的术后并发症对比结果显示:微创组患者的术后并发症发生率低于开胸组(P<0.05)。腔镜术中病灶切除准确,避免对正常胸壁组织的损伤,间接保护了肺通气功能;在腔镜视野下微小结构放大数倍,增加术中操作的准确度,避免误伤喉返神经等重要血管神经;开胸手术切除范围及淋巴结清扫范围均较大,胸导管损伤几率相对增高,故对照组中出现乳糜胸;另外在切口吻合方面胸腔镜下缝针更为细致可以有效防止吻合口瘘发生[14]。以上结果提示微创食管癌切除术在减少患者术后并发症方面具有传统开放手术不可比拟的优势。
综上所述,微创食管癌切除术更有利于患者的术后恢复,有助于减少术后肺功能损伤及喉返神经损伤、胃排空延迟等并发症发生,值得在日后临床实践中推广应用。
[1]Haase O,Raue W,Neuss H,et al.Influence of postoperative fluid management on pulmonary function after esophagectomy[J].Acta Chir Belg,2013,113(6):415-422.
[2]杨金云,张晓雨,平 洪.胸腔镜食管癌切除术与开胸手术疗效比较[J].中华实用诊断与治疗杂志,2012,26(2):168-170.
[3]Iwahashi M,Nakamori M,Nakamura M,et al.Clinical benefits of thoracoscopic esophagectomy in the prone position for esophageal cancer[J].Surg Today,2014,44(9):1708-1715.
[4]Benedix F,Dalicho SF,Stübs P,et al.Evidence base for minimally invasive esophagectomy for esophageal cancer[J].Chirurg,2014, 85(8):668-674.
[5]Xie MR,Liu CQ,Guo MF,et al.Short-term outcomes of minimally invasive Ivor-Lewis esophagectomy for esophageal cancer[J].Ann Thorac Surg,2014,97(5):1721-1727.
[6]Ben-David K,Behrns K,Hochwald S,et al.Esophageal perforation management using a multidisciplinary minimally invasive treatment algorithm[J].JAm Coll Surg,2014,218(4):768-774.
[7]王 睿,杜 铭,陈焕文.微创食管癌切除术与开胸食管癌切除术术后C反应蛋白及TNF-α,IL-6反应的对比研究[J].第三军医大学学报,2012,34(3):268-270.
[8]Macke RA,Luketich JD,Nason KS,et al.Minimally invasive enucleation of a large,extensively calcified esophageal leiomyoma[J]. J Thorac Cardiovasc Surg,2014,147(4):e52-e54.
[9]Ariyoshi Y,Fujiwara H,Shiozaki A,et al.Minimally invasive surgery for cancer arising in a reconstructed gastric tube after esophagectomy based on evaluation of blood and lymphatic flow by indocyanine green fluorescence imaging[J].Gan To Kagaku Ryoho, 2013,40(12):2170-2172.
[10]Warner S,Chang YH,Paripati H,et al.Outcomes of minimally invasive esophagectomy in esophageal cancer after neoadjuvant chemoradiotherapy[J].Ann Thorac Surg,2014,97(2):439-445.
[11]刘亚州,董家寿,易 军,等.食管癌术前辅助化疗联合手术治疗的临床价值[J].海南医学,2014,25(17):2590-2591.
[12]蒋清柏,袁天柱,李 伟,等.经左胸微创小切口治疗高龄胸中下段食管癌67例临床分析[J].海南医学,2013,24(5):710-711.
[13]Maas KW,Biere SS,van Hoogstraten IM,et al.Immunological changes after minimally invasive or conventional esophageal resection forcancer:a randomized trial[J].World J Surg,2014,38(1): 131-137.
[14]Dolan JP,Kaur T,Diggs BS,et al.Impact of comorbidity on outcomes and overall survival after open and minimally invasiveesophagectomy for locally advanced esophageal cancer[J].Surg Endosc, 2013,27(11):4094-4103.
R735.1
B
1003—6350(2015)15—2288—03
10.3969/j.issn.1003-6350.2015.15.0824
2015-01-22)
广东省科技计划项目(编号:2010A030100148)
张志锋。E-mail:1099389760@qq.com

