肱骨连接器重建肱骨干转移癌切除后骨缺损的研究
徐美涛 张帅 王嘉嘉 王序全
四肢长骨中,肱骨是恶性肿瘤骨转移的好发部位,仅次于股骨,临床主要表现为患肢疼痛及功能障碍。转移灶骨溶解导致的病理性骨折为其最严重的临床并发症,不仅上肢致残而且加速转移癌的病程进展,严重威胁到患者终末期生存质量、缩短患者生存时间[1]。对肱骨转移癌的治疗模式,目前也从截肢或保守治疗转变为姑息性手术治疗为主。本研究回顾 2011 年 5 月至 2014 年 1 月,我科采取定制型肱骨连接器重建肱骨干转移癌切除后骨缺损的疗效,旨在就其临床应用的可行性进行相关探讨。
资料与方法
一、一般资料
本组共 6 例,其中男 4 例、女 2 例;年龄 50~63 岁,平均 ( 57.5±4.8 ) 岁。随访 6~32 个月,平均 16.5 个月。肱骨干中段转移灶左侧 2 例、右侧4 例。初诊时患肢疼痛 ( visual analogue scale,VAS )评分 3~7 ( 5.0±1.4 ) 分。术前常规摄患侧肱骨X 线、CT 及上臂 MRI、肺 CT、全身骨扫描 ( ECT )等。术前 CT 引导下经皮穿刺活检,临床、影像学结合病理诊断确诊并排查原发灶,其中肺癌伴肱骨转移 4 例、肝癌 1 例、甲状腺癌 1 例。所有肱骨转移灶溶骨破坏及周围软组织侵犯等影像学特点明显,1 例合并病理性骨折。患肢转移病灶均为肱骨干单发病灶。临床表现为单存患肢疼痛 1 例、疼痛合并活动障碍 4 例、病理性骨折 1 例 (表1)。
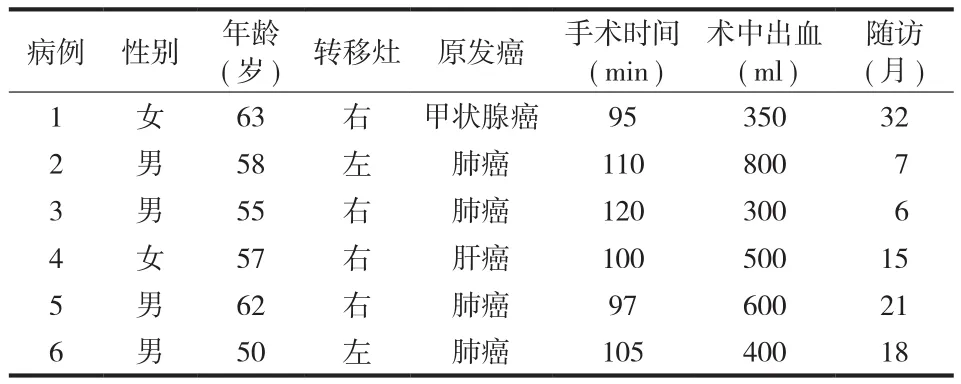
表1 6 例的一般资料Tab.1 Genreal data of the 6 patients
二、手术方法
依据肱骨 X 线片、CT 及上臂 MRI 确定转移癌累及范围,切除边界按照 Enneking 切除标准,广泛切除 3 例,截骨平面距离转移癌边缘 3~5 cm,边缘切除 2 例,囊内切除 1 例。
均选择肱骨前侧入路 ( 胸大肌-三角肌间沟 ),近端于胸大肌止点外侧纵向劈开深筋膜,三角肌及头静脉牵向外侧,屈曲肘关节,远端于中线将肱肌劈开,沿肿物周围正常组织切除分离。若重要神经、血管受肿瘤侵犯包裹,则分离保护。依据术前假体制订范围,行肱骨近端及远端截骨,切除瘤段及周围软组织转移灶。瘤段离体后无菌蒸馏水浸泡冲洗约 15 min 后干燥髓腔,肱骨近端及远端依次扩髓,避免损伤肱骨关节面,搅拌骨水泥并填塞均匀后分别安装连接器近端及远端,迅速复位并拧入连接器体部螺钉固定,紧压待骨水泥完全凝固。术区常规留置引流。本组均采用定制型国产假体 ( LDK,力达康,北京 )。
三、术后处理
术后 3 个月、半年、1 年,此后每半年至少一次复诊患侧肱骨 X 线。常规行头孢一 / 二代类抗生素预防感染至术后 2~3 天,引流管于术后 72 h 内或引流量 50 ml 以内时拔除。术后患肢吊带悬吊制动4 周。非甾体抗炎药镇痛治疗。术后半年内,每个月注射唑来磷酸钠一次,4 mg / 次。
术前及术后 3 个月评估患肢 VAS 疼痛评分[1]。按肌肉骨骼肿瘤学会评分 ( musculoskeletal tumor society system,MSTS ) 评价术后 3 个月时患肢功能情况[2]。
四、统计学分析
采用 SPSS 13.0 进行统计学分析。术前及术后3 个月,患肢 VAS 疼痛评分行配对t检验。P<0.05为差异有统计学意义。
结 果
本组手术时间 95~120 ( 平均 104.5 ) min,术中出血 300~800 ( 平均 491.7 ) ml,具体术中出血量及手术时间情况详见表 1。6 例均获随访,随访 6~32 ( 平均 16.5 ) 个月。本组 6 例中,除 1 例术后周围软组织内复发转移灶、1 例连接器近端柄部出现无菌性松动并翻修外,均未发生桡神经及肱动脉损伤、上肢不等长、感染、假体周围骨折等并发症及安全性问题。
术后 3 个月患肢 VAS 评分平均 ( 1.7±1.5 ) 分较术前平均 ( 5.0±1.4 ) 分显著改善,差异有统计学意义 (P=0.001 )。术后 3 个月患肢 MSTS 评分平均( 24.8±2.1 ) ( 22~28 ) 分。
典型病例:患者,男,58 岁,右肺癌伴左肱骨干转移癌 (图 1) 。术前左上肢疼痛 VAS 评分 7 分。2012 年 8 月 15 日行“左肱骨干转移癌瘤段广泛切除、肱骨连接器重建术”,术后 2 个月因患肢提拉重物导致假体松动,于 2012 年 11 月 23 日行连接器翻修术。术后 3 个月左上肢疼痛 VAS 评分 4 分、MSTS 评分 22 分。
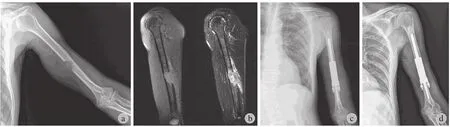

图1 典型病例,男,58 岁 a:初诊肱骨X 线片;b:左上臂 MRI ( T1 及压脂像 );c:重建术后;d:假体松动;e:翻修假体;f:翻修术后Fig.1 A 58-year-old male patient a: The X-ray of the hurmerus at the first visit; b: The coronal T1W1 and STIR T1 weighted image of the left hurmerus; c: After the reconstruction.d: Prosthetic loosening; e: Revision surgery;f: After revision surgery
讨 论
一、肱骨转移癌临床特点
临床几乎超过半数的癌症患者可能并发骨骼系统转移,且多数骨转移癌患者生活质量差、恶病质、预期生存时间短,易导致患者出现巨大的心理创伤或精神负担、治疗态度消积,使得癌症病程的进展和终末期死亡事件发生加速[3]。肱骨转移癌一般早期无明显临床表现,晚期出现上臂局部持续性疼痛渐加重、患肢活动障碍、伴病理性骨折,少数患者临床首发症状以转移灶骨痛或病理性骨折而就诊[4]。
二、肱骨转移癌姑息治疗
骨转移癌姑息治疗的目的是缓解和处理癌症患者疾患,达到缓解癌性疼痛、恢复患肢功能、改善晚期生活质量、预防或延缓病理性骨折等相关事件。常用的治疗方法包括放疗、化疗、“三阶梯”镇痛治疗、神经阻滞或毁损、双磷酸盐治疗、外科手术治疗等方法,但无论非手术治疗或手术治疗各有其优缺点。因肱骨转移癌导致的疼痛、活动受限或病理性骨折将严重影响患肢肩、肘部关节功能,对患者日常生活带来极大不便,并且作为非负重骨的转移癌,肱骨的功能重建预后相对好于脊柱及股骨等负重骨的转移癌,因此姑息性外科手术治疗肱骨转移癌较其它保守治疗方式存有明显优势。Kristy、Manabe 等认为,患者一般情况良好、能耐受手术、原发癌稳定无进展、预期生存期≥半年、病理性骨折明显影响患者生活质量者均可考虑外科手术治疗[5-6]。手术应选择创伤较小、操作简便、近期疗效显著的术式,以缓解转移灶疼痛、预防或处理患肢病理性骨折、恢复患肢功能[7]。
三、传统外科重建方式
肱骨转移癌经典的重建方法包括瘤段灭活回植、钢板螺钉内固定或髓内钉内固定结合骨水泥填塞腔隙性骨缺损、肿瘤假体重建等。有学者建议采用瘤段切除灭活回植或同种异体骨重建术式治疗肱骨转移癌[8]。但瘤段切除灭活回植术所需手术时间长、手术创伤大,回植“死骨”后体内生物性骨重建、骨愈合所需时间较长,加之术后化放疗等对骨愈合重建抑制,重建时间往往会超过骨转移癌患者术后预期生存时间,使得术后早期患肢功能恢复有限[9-10]。因此,笔者认为瘤段灭活的生物性骨重建术式应主要用于原发恶性骨肿瘤保肢治疗,而非骨转移癌的姑息治疗,并且同种异体骨来源有限始终为其难以克服的诟病。杨毅等[11]对 59 例肱骨转移灶于肱骨干部位的 27 例采用钢板、髓内针固定,骨水泥填塞腔隙性骨缺损区域,术后 1 例钢板折断、2 例复发,术后 8~12 周患肢 MSTS 75.1%,优于 32 例肿瘤关节假体重建的 MSTS 71%,对钢板内固定重建须要求瘤段切除后近远端皮质骨完整,骨水泥填塞骨缺损利于协助内固定及瘤骨强度,髓内钉可利用其长节段固定优点达到术后固定牢靠的效果[10]。
四、肱骨连接器重建术式
1. 假体设计:本研究采用的假体主要依据术前 X 线测量、并综合肱骨 CT 及上臂 MRI 确定转移癌累长度及范围。肱骨连接器相关解剖数据包括假体柄的长度、柄部近端及远端直径、连接器体部的长度及直径等,材料为钴铬钼合金。假体柄部的长度至少 5~6 cm,充分的骨床容纳假体柄对该骨水泥型假体能否稳定固定至关重要。假体的柄部插入近端及远端髓腔通过假体-骨水泥-骨界面耦合固定,体部设计为半圆柱状,并通过数枚螺钉锚定为整体,体部末端设计螺纹,钢板采用套环式设计耦合连接器体部,经钢板多枚单皮质螺钉牢靠固定于骨皮质。目前文献中对灭活回植、钢板螺钉内固定或髓内钉内固定后残留的腔隙性缺损,均通过灌注骨水泥的方式消灭“死腔”,并依靠骨水泥增强内固定的稳定性。本研究采用连接器体部的半圆柱形设计,不仅能起到骨应力传导的作用,还能依靠金属假体自身填塞骨缺损腔隙而不依耐骨水泥,减少了骨水泥磨损形成的异物颗粒、骨溶解吸收等并发症。假体柄部的半柱形设计利于充填瘤段切除后的腔隙性缺损。该型假体应用于肱骨干转移癌切除后缺损的重建术式,目前尚未见国内外相关文献报道。
2. 适应证:连接器的原理为耦合切除肱骨干部转移癌后的残端,为上肢的机械活动提供稳定和连续的轴线。对于肱骨、股骨等转移癌是否行增块骨骼的固定以治疗病理性骨折或预防即将发生的病理性骨折,目前尚存争论,且文献也较少报道。Mirels等[12]认为当病理性骨折风险评分≥9 分,应进行预防性内固定。也有学者对 Mirels 评分基础进行修订,在合并部分特殊因素,如原发灶来源、接受激素治疗、接受放射治疗、须借助上肢扶拐行走等,将预防性内固定的病理性骨折的风险评分下调为8 分[13]。Hasham 等[14]认为采用预防性的长节段固定利大于弊,通过长节段的髓内固定使得转移癌远期并发症或术后再手术风险大大降低,并且相关手术并发症较少。
3. 临床疗效比较:杨毅等[11]报道,肿瘤假体置换术后较内固定重建肱骨转移癌切除后缺损患肢功能情况,其术后 8~12 周肿瘤假体置换组 MSTS 为71% 小于内固定组的 75.1%;程冬冬等[8]采用瘤段灭活回植重建肱骨转移癌骨缺损,术后 MSTS 评分平均 ( 20.16±4.38 ) 分。本组术后 3 个月患肢 MSTS评分平均 ( 24.83±2.14 ) 分,优于上述文献报道。连接器较之传统的重建方式具有以下潜在优势:( 1 ) 关节稳定性。本研究所纳入肱骨转移癌病例均以肱骨干单一转移灶,未合并关节端破坏,因此瘤段切除后连接器重建对肩、肘关节影响更小;( 2 )假体类型。单存骨干连接器较长柄的肩、肘关节假体更轻便且容易安装,对狭小的肱骨髓腔,连接器柄部扩髓程度、骨水泥固定的用量和远期固定效果理论上应优于带长节段假体柄的肿瘤型肩、肘人工关节;( 3 ) 创伤控制。本研究所设计的连接器假体在切除瘤段及周围软组织转移癌病灶后不需要进一步的肌肉剥离、扩髓范围小、髓内出血少、使用的骨水泥量小且连接器柄部可直接经截骨端插入髓腔并完成假体的组装,较传统重建方式均明显简化了手术步骤、缩短了手术时间;更小的创伤,骨水泥固定得即时、稳定,有利于连接器重建后患肢的早期功能锻炼和生活质量的恢复。
本组纳入的样本较文献所报道的病例少、肱骨干转移癌范围小等,可能对临床结果存有一定的影响。本组 1 例术后 5 个月上臂假体周围软组织内复发转移灶,再次手术切除包块后行病理诊断证实,随访假体周肱骨骨质条件好,假体-骨水泥-骨界面稳固,患肢功能满意。其复发原因考虑为术中保护桡神经及肱动脉导致周围软组织内转移灶清理未彻底。无论连接器或肿瘤型肩、肘关节置换、假体松动等中远期并发症几率均低且术后早期,均能达到或接近日常生活需要,恢复上肢及手部功能[15]。结合骨转移癌患者晚期存活时间普遍较短的临床特点,本研究将连接器假体的早期并发症作为临床观察重点。本组 1 例术后 2 个月因患肢提重物时发生近端柄部假体松动而再行翻修术,临床随访翻修后假体固定效果佳,未再出现近端假体松动等情况 (图 1)。
总之,本研究通过对肱骨连接器重建肱骨干转移癌手术切除后骨缺损的临床应用研究,获得了满意的临床疗效,不仅减轻了患者病痛、改善了患者的生存质量,也为肱骨干转移癌的姑息性外科治疗提供了新的重建术式。虽然尚无相关文献报道,但其临床可行性明确。本研究纳入样本较少、假体设计的优化也须进一步生物力学研究,连接器同传统肱骨干转移癌外科重建术式的疗效差异,还须相关临床随机、对照、前瞻研究证实。
[1] McGrath PJ, Unruh AM, Finley AG. Pain assessment in children. Pain-Clinical Updates, 1995, 3(2):23-25.
[2] Enneking WF, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma. Clin Orthop Relat Res, 1980, (153):106-120.
[3] Weber KL. Evaluation of the adult patient (aged >40 years)with a destructive bone lesion. J Am Acad Orthop Surg, 2010,18(3):169-179.
[4] Tsuya A, Fukuoka M. Bone metastases in lung cancer. Clin Calcium, 2008, 18(4):455-459.
[5] Weber KL, Randall RL, Grossman S, et al. Management of lower-extremity bone metastasis. J Bone Joint Surg, 2006,88(Suppl 4):11-19.
[6] Manabe J, Kawaguchi N, Matsumoto S, et al. Surgical treatment of bone metastasis: indications and outcomes. Int J Clin Oncol, 2005, 10(2):103-111.
[7] Utzschneider S, Wicherek E, Wever P, et al. Surgical treatment of bone metastases in patients with lung cancer. Inter Orthop,2011, 35(5):731-736.
[8] 程冬冬, 杨庆诚, 胡涂, 等. 肺癌四肢骨转移20例手术治疗的回顾性分析. 中华临床医师杂志, 2013, 7(18):8165-8168.
[9] Davidson AW. En-bloc resection, extracorporeal irradiation,and re-implantation in limb salvage for bony malignancies.J Bone Joint Surg Br, 2005, 87(6):851-857.
[10] Sabo D. Influence of extracorporeal irradiation on the reintegration of autologous grafts of bone and joint STUDY IN A CANINE MODEL. J Bone Joint Surg Br, 2000, 82(2):276-282.
[11] 杨毅, 杨荣利, 郭卫. 59例肱骨转移癌手术治疗的回顾性分析. 北京大学学报(医学版), 2011, 5(43):681-685.
[12] Mirels H. Metastatic disease in long bones. A proposed scoring system for diagnosing impending pathologic fractures. Clin Orthop Relat Res, 1989, 12(249):256-264.
[13] 宓士军, 高景春, 韩立民, 等. 外科手术联合骨水泥灌注治疗溶骨性转移癌. 中国骨肿瘤骨病, 2009, 8(5):303-306.
[14] Hasham M, Timothy AD. Prophylactic stabilization for bone metastases, myeloma, or lymphoma: do we need to protect the entire bone? Clin Orthop Relat Res, 2013, 471(3):706-714.
[15] Wafa H, Reddy K, Grimer R, et al. Does total humeral endoprosthetic replacement provide reliable reconstruction with preservation of a useful extremity? Clin Orthop Relat Res,2015, 473(3)917-925.

