四肢骨肉瘤患者大剂量氨蝶呤化疗 63 例报告
朱兵 吴苏稼 王臻 于秀淳 孙平
骨肉瘤是常见骨来源高度恶性肿瘤,以产生骨样基质为病理特征。目前治疗多采用化疗和手术为主体的综合治疗。新辅助化疗已经成为提高骨肉瘤生存率的有效途径。在化疗方案中,大剂量甲氨蝶呤 ( high dose methotrexate,HD-MTX ) 的应用是提高疗效的主要药物之一,适度提高给药剂量可以有效提高 5 年生存率[1]。高剂量给药存在高风险,对于临床应用的效果及安全性问题也存在争议[2-3]。目前 HD-MTX 广泛应用中还存在着许多不规范问题,该药物也是导致化疗致死的主要原因之一。面对高并发症的发生率及致死风险,在国内应用中多采用减量化疗或改变方案放弃使用,普遍没有达到方案设计中应有的血药浓度。这导致一方面抗肿瘤效果存在异议;另一方面,在足量应用中对可能出现的严重并发症处理不及时和认识不足,导致严重后果,甚至有些骨肿瘤治疗中心因条件所限和认识不足放弃了使用。2009 年 2 月至 2010 年 12 月收集国内 5 家肿瘤中心针对骨肉瘤联合开展的随机、对照、多中心化疗结果,旨在分析重组人血管内皮素在骨肉瘤化疗中的作用及使用的安全性[4];现报告如下。
资料与方法
一、病例选择
纳入标准:所有入选患者诊断均经穿刺或切开活检证实;至少有 1 个双径可测量病灶,X 线片、CT 或 MRI 测量病灶>20 mm;身体状况尚好,ECOG 评分 0~2 分;年龄至少 10 岁,性别不限;既往使用化疗药物受试者,至少经过 4 周的清除期;符合化疗的指征和基本要求;预计生存期≥3 个月;既往对生物制剂无过敏反应;自愿参加,能配合试验观察,签署知情同意书。
排除标准:经确认其它部位出现转移病灶的患者;妊娠及哺乳期妇女;有严重心脏疾病患者;有不易控制的精神、神经疾患或精神障碍、依从性差的患者;同时参与其它临床试验患者;研究者认为有不宜参加本试验的其它情况。
退出标准:患者疾病恶化,须要立即给予其它治疗的患者;出现严重毒性或不能耐受治疗者;推迟 2 周以上的治疗者;患者本人要求退出试验或研究者认为从医学上的须要退出本研究者。
剔除标准:不符合入组标准者;不遵守试验要求、明显违反本方案、或中途改用其它药物治疗者;因不良反应而出组的病例不可评价疗效,但其不良反应将列入统计;主要观察指标缺少,资料明显不全者。
本研究应用的 HD-MTX 病例均选自该研究的入选病例。在手术前后的贯序化疗中,该药均为首次用药,与其它化疗药物及实验对象重组人血管内皮抑制素 ( 国药准字 S20050088,山东麦得津生物制药有限公司 ) 间隔至少 2 周,可以不考虑其它药物的影响。
二、一般资料
收集 2009 年 2 月至 2010 年 12 月国内五所医院( 南京军区总医院、第四军医大学、济南军区总医院、北京军区总医院、辽宁省肿瘤医院 ) 的 63 例骨肉瘤患者 ( 分为实验组 32 例、对照组 31 例 ),两组剔除和脱落患者 9 例 ( 实验组 3 例,对照组 6 例 ),有效病例 54 例,其中实验组 29 例,对照组 25 例。实验组男 18 例,女 11 例,年龄 9~35 ( 平均 16.5 )岁;肿瘤部位股骨远端 17 例,胫骨上端 7 例,肱骨近端 5 例。对照组男 18 例,女 7 例;年龄 11~43 岁 ( 平均 18.7 ) 岁;肿瘤部位股骨远端 16 例,胫骨上端 7 例,肱骨近端 3 例。
三、治疗方案
甲氨蝶呤 ( methotrexate,MTX ) ( 甲氨蝶呤注射液,进药准字 H20090208,辉瑞制药有限公司 ) 在治疗组与对照组给药剂计量与方式均相同。根据实验方案,术前化疗由 HD-MTX、顺铂、阿霉素和异环磷酰胺组成并贯序给药,第 1 次给药均为HD-MTX,各中心均按照实验设计剂量给药,并根据自身情况及患者情况适当调整:第 1 天接受给药前的水化并碱 ( 碳酸氢钠 ) 化,1.0 / 次,3 / 日,开始碱化血液,并开始记录出入量;第 2 天给药,按计划给药剂量为 8 g / m2,在 6 h 内用完,给药 8 h 后肌注 15 mg 四氢叶酸钙解救,每 6 h 一次,连续 72 h,并在给药后 24~72 h 监测血药浓度至<1 mmol / L,对于明显异常值连续监测至正常。
其它药物包括顺铂 120 mg / m2,静脉滴注,第15 天给药;阿霉素 60 mg / m2,静脉滴注,第 15、16 天给药;异环磷酰胺 1.0~1.5 g / m2,静脉滴注,第 29~33 天连续给药。此外,实验组加用重组人血管内皮抑制素,15 mg / 天,静点,第 1~14 天及第29~42 天给药。对照组不用重组人血管内皮素。
以上 4 种药贯序给药组成 1 个周期,术前化疗1 个周期。术前化疗后 2 周行肿瘤切除手术,术后2 周重复术前化疗方案 3 个周期贯序给药。
手术方法:对于病变侵袭范围大,不适宜保肢的患者行截肢术。对于有保肢条件的患肢根据 X 线片、CT、MRI 等影像学资料确定截骨平面,截除瘤段后采用肿瘤型人工关节重建或相应的生物重建。所有切除标本送病理学检查。
四、随访方法
所有入组患者均为住院患者,因此未进行出院后的连续随访。分析给药 2 周内患者的情况。
五、安全性评估价指标
血液及生化资料等所有的毒性评估根据 ( the national cancer institute common terminology criteria for adverse event,CTCAE ) v4.0 评分系统评价肝、肾、血液学及黏膜毒性等[5]。若同一毒性反应在本治疗过程中反复出现,则记录最严重的 1 次。由主管医生评估不良事件与验证药物之间的关系。
六、统计学方法
应用 SPSS 13.0 统计软件处理结果,给药剂量资料采用±s的形式。
结 果
本研究共 60 例接受了 HD-MTX 治疗,共给药 186 个周期,各中心总 HD-MTX 给药平均剂量为 7.45 g / m2。在 186 个给药周期中,均常规进行了血药浓度的监测,血药浓度给药后 24 h>20 μm占 27.9%,48 h 后占 1%。随访时间 3.6~39.3 ( 平均21.3±12 ) 个月。两组总无进展生存率为 37.0% ( 20 /54 ),总生存率为 66.7% ( 36 / 54 ) (表1)。
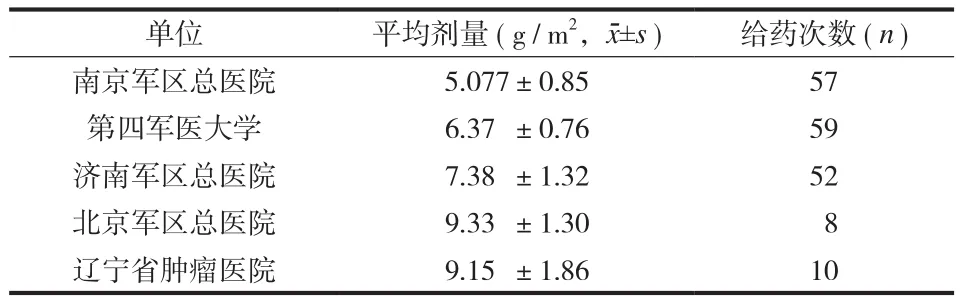
表1 各中心 HD-MTX 平均给药剂量及次数Tab.1 The average dose and number of HD-MTX in all the 5 hospitals
谷丙转氨酶最大值 2133 mmol / L,>800 mmol / L共发生 4 例次 ( CTCAE 4 度 ),200~800 mmol / L( CTCAE 3 度 ) 发生 15 例次,占 10%;在 HD-MTX给药剂量>8.0 g 的 37 个周期中,谷丙转氨酶异常发生率为 72%,均发生时间在给药后 2 周内。肌酐最大值 190 mmol / L ( CTCAE 2 度 ),肾功能异常4 例次 ( CTCAE 2 度 ),这 4 例次 HD-TX 的给药剂量均<8.0 / m2,发生时间在给药后 1 周内。在 186个周期中,严重肝损害发生率为 4.8% ( 9 / 186 ),严重肾功能损害发生率为 2.2% ( 4 / 186 )。死亡1 例,除死亡病例外无不可逆肝肾损害发生。
最早出现的不良反应为皮肤过敏反应,均在给药后 1~24 h 出现,表现为皮肤潮红,红斑丘疹等,在有记录的病例中发生率为 18.8% ( 6 / 32 )。这 6 例中,出现口腔炎、黏膜溃疡及腹胀、腹泻 4 例,程度达到 CTCAE 3~4 度,出现 IV 度骨髓抑制 5 例。而其余 28 例中 I~II 度骨髓抑制发生率为 45%,IV 度骨髓抑制发生率 12%,口腔炎发生率为13.5%,发生在给药后 5~7 天,经对症治疗后 1 周左右缓解。出现过敏反应后的肝肾损害和骨髓抑制并发症的发生率及程度,较没有过敏反应的病例无差别。呕吐、腹胀、腹泻等不同程度胃肠道反应发生率>90%,程度在 CTCAE 1~4 度,持续时间<1 周,均在止吐、对症等药物控制下可耐受。
典型病例:患者,男,16 岁。HD-MTX 给药后死亡。体表面积 1.74,HD-MTX 给药总剂量为12 g,6.897 g / m2,为初始化疗用药。给药异常后化验结果显示血药浓度 24 h>100 μm。给药后 3 天出现高热、严重肺部感染,给药后第 5 天出现呼吸困难及严重骨髓抑制,全血细胞分析结果示:白细胞为 0.1×109/ L,血小板为 21×109/ L ( CTCAE 4 度 );总胆红素为 97.8 μmmol / L ( CTCAE 3 度 );肾功能不全,肌酐高达 190 mmol / L ( 2 度 ),血尿素氮16.0 mmol / L ( CTCAE 2 度 )。给药后第 6 天死于肺部感染致呼吸衰竭,高热并伴 IV 度骨髓抑制及肝肾损害。
讨 论
本临床研究为国内首个开放的多中心骨肉瘤化疗研究,主要观察在 MTX、顺铂、阿霉素和异环磷酰胺四药联合化疗的同时随机增加重组人血管内皮抑制素,观察在骨肉瘤化疗中是否具有辅助效果。2010 年 Rossi 等[6]报告了重组人血管内皮抑制素潜在的治疗效果,但是在本项研究结果并未发现其针对骨肉瘤的效果,也可能考虑是样本数量较小的原因[4]。回顾实验设计,虽然存在许多不足,但仍然体现了近年来化疗的最新状态。就 HD-MTX 而言,为化疗的首次用药,没有其它化疗药物的影响,为其在应用状态的研究提供了良好的基础。总结其应用情况,有利于发现使用中的问题,从而进一步加深对 HD-MTX 使用安全性的认识。各中心之间由于用药习惯、条件及患者等多方面因素影响,给药剂量存在差异,但是多中心的平均药量为 7.45 g / m2,基本与试验设计药量接近,从而能够反映出给药的现状及可能存在的风险。给药后均对血药浓度的变化进行了血清学检测,较为标准的水化及碱化,肝肾功能的监测,及时的叶酸解救等步骤,对给药后患者临床表现及相关不良反应也作了观察。
由于地域、条件及不同给药常规等的影响,HD-MTX 的临床应用存在很大差异,国内文献报告的大剂量很多都未达到国外文献报道的标准,使国内、外使用的效果不能在同一水准上进行疗效评价[7-11]。小剂量导致的耐药与大剂量的毒副反应影响了临床应用与疗效[8-9]。这也是国内外很多作者对 HD-MTX 疗效存在质疑的原因之一[2-3,12]。本研究中也存在剂量上的较大差异,范围在 5.077~9.33 g / m2,加之样本量较小,没有达到文献报道12.0 g / m2普遍的水平[4],本研究的患者无进展生存率不足 40%,是否与 HD-MTX 的剂量不足有关?尚需大样本的研究验证。
回顾 HD-MTX 对骨肉瘤的治疗,自 1972 年起,Jaffe,Rosen 和 Frei 等就先后开始了临床应用,大量的文献报告证实了,HD-MTX 可明显改善骨肉瘤患者预后。但是其有效性和高并发症的发生率始终存在争议[1-3,13-14]。有研究报道,含有异环磷酰胺的化疗方案会增加发生血液毒性的风险;但以大剂量 MTX 为主的不含异环磷酰胺的方案,在其疗效相近的前提下,安全性更高[2]。有报道,在 HD-MTX给药的 1553 个周期中延迟排泄发生率为 8% 左右,且均发生在肾功能不全的患者中[2]。因此,肾脏功能应该是早期监护的主要脏器。HD-MTX 有导致严重肺损害的可能性[15]。本组 1 例死亡病例同样出现了 IV 度肝功能损害及 II 度肾功能损害,在排泄障碍的肝肾功能不全基础上发生不可逆的肺损害和骨髓抑制为主要死因。当 HD-MTX 剂量>10.0 g / m2时,会影响肾肌酐清除率,增加肾脏损害风险[8-9,14]。本组当 MTX 剂量>8.0 g / m2时,肝功能异常数值明显增加,但肾功能影响与剂量关系并不明显。本组剂量与肾功能损害的发生没有直接关系,可能与水化、碱化不足、药物过敏反应、重要脏器损害的发生及 MTX 排泄延迟导致产生大量羟化 MTX 造成肝损害等有关[16]。可能由于统计数量不足,化验结果存在空缺和不连贯,因此并没有因过敏反应而至肝肾损害和骨髓抑制加重的现象。但文献报道过敏反应的发生与脏器损害及骨髓抑制的严重状况有关,因而最早出现的过敏反应的发现及即时处理是避免随后出现严重不良反应的重要环节。建议给药后如出现皮肤的过敏反应,应强化血药浓度变化的监测,并增加叶酸解救的单次用量和时间,以预防严重并发症的发生[9,16]。
由于该药物的高毒性反应的出现存在着不确定性,每次化疗患者的身体状态及个体化的差异明显,反复用药易于出现过敏反应,导致代谢障碍。因此,加深对药物作用规范化的认识,才有可能提高使用的安全性。研究表明,HD-MTX 给药剂量及给药时间,对峰值血药浓度都有影响,合理的血药浓度对于疗效至关重要。强调血药浓度应该达到至少 1000 μm,才能获得较好的临床效果。但是>1500 μm 的血药浓度用药风险会大幅度增加而影响预后。过高的血药浓度和给药剂量并不能提高疗效,反而因为血液毒性和肝肾毒性的增加对预后产生不利的影响[3]。另一方面,药物浓度的高低与抗肿瘤效果也直接相关[13],即使是 40 岁以上的成年人,对于药物的代谢能力虽不比儿童,但是遵循用药原则仍然可以获得良好的安全性[14,16]。
所谓的规范化用药应包括以下问题:( 1 ) 给药前一天水化及碱化,建议水化量应该在 4.5 L / m2,水化时间不少于用药后 24 h,充分水化有利于药物自肾脏直接迅速排泄,降低饱和浓度,减少排泄过程对肾小管的损害[12];同时 MTX 在体内停留时间缩短,有利于减少在肝脏中的代谢量,减少其代谢产物 7-OH-MTX 产生量,因为肝脏损害的发生与7-OH-MTX 的浓度高低直接相关[16]。另外,碱化标准应达到尿中 pH 值至少为 8。MTX 在肾脏中的排泄与尿中 pH 值高低有关,当 pH 为 5~7 时,饱和度为 48 g / L;当 pH>8 时,饱和度增加到 400 g / L,排出能力提高近 10 倍[3,7]。若代谢产物 7-OH-MTX难溶解从肾脏排出,则易导致肾脏小管堵塞和毒性,充分的碱化是加速排泄,提高给药剂量的安全保障之一。( 2 ) 文献推荐给药时间及浓度持续静点在 4~6 h,给药量在 8~12 g / m2,多数情况下应达到 12 g / m2,以使达到足够血药浓度和适度的曲线下面积 ( AUC ),即作用时间[3,13]。为提高安全性,很多作者进行了大量的药代动力学研究及给药方式的研究[7-8,11,13],均支持上述方式。( 3 ) 用药后的临床观察。观察内容应包括消化道反应,恶性、呕吐、腹胀、腹泻等;皮肤过敏表现包括皮肤潮红、皮疹等;随后几日的口腔炎及神经毒性表现,呼吸功能,尿量等[7-11]。观察这些表现的程度可以间接地反应对药物的耐受性及毒性反应程度。( 4 ) 血药浓度监测及叶酸解救。血药浓度监测是保肢安全用药及了解用药浓度是否达到有效剂量的重要依据,建议至少检查给药后 0 h 及 24 h 的血药浓度,前者反应了最高浓度值,后者代表了排泄的速度及体内残留量,如果给药后 24 h 仍在>100 μm,应继续连续监测至<1 μm,以了解 AUC 变化及大小。延迟代谢会使 AUC 明显增高,毒性反应有增加可能,须提高叶酸解救的量及时间[9-10,13]。充分足量地解救可以明显减少消化道溃疡的发生及减轻溃疡严重程度,也有利于重要脏器的保护。公认的叶酸解救量为 9~15 mg,1 / 6 h,共 10~12 次,当出现药物体内排泄延迟及过敏反应等异常表现时可增加用量至 60 mg,延长用药至 1 周左右。( 5 ) 早期的肝肾功能监测。肝肾功能的监测应该在给药后 24 h 内进行,以便及早发现谷丙转氨酶和胆红素及肾功能中肌酐的变化情况,对于有肾脏功能不全、高龄或高危的患者应在给药前后监测血、尿中的 β 微球蛋白[9],与肌酐相比能够更加准确的反应出肾脏排泄功能状态。( 6 ) 有效地进行常规的抗过敏治疗及观察。给药前可使用盐酸异丙嗪、甲泼尼龙、葡萄糖酸钙等预防过敏反应。给药中至给药后均应不间断的观察皮肤有无潮红、丘疹等过敏表现。
根据各中心登记结果显示,本研究中生化结果的检测普遍延迟,最长时间达给药后 7 天,没有在给药后 24 h 内的结果,没有反映出 HD-MTX 给药后早期的肝肾功能变化情况,此可能与试验设计以重组人血管内皮抑制素为中心的方案有关。忽略了对 HD-MTX 给药后的早期监测,潜在的增加了用药风险。
虽然,本研究中 HD-MTX 的应用存在如剂量偏低、血生化监测不及时及血药浓度监测不充分等问题,还出现 1 例给药后至肺损害感染和多脏器衰竭的死亡病例,但仍较好地反映出了 HD-MTX 应用现状。通过对应用结果的回顾发现问题与不足,总结文献内容进行安全性分析,为今后的合理应用提供了有利的数据支持,也为提高临床应用的安全性提供了依据。
[1] Delepine N, Delepine G, Cornille H, et al. Dose escalation with pharmacokinetics monitoring in methotrexate chemotherapy of osteosarcoma. Anticancer Res, 1995, 15(2):489-494.
[2] Ferrari S, Ruggieri P, Cefala G, et al. Neoadjuvant chemotherapy with methotrexate, cisplatin, and doxorubicin with or without ifosfamide in nonmetastatic osteosarcoma of the extremity: An Italian Sarcoma Group Trial ISG/OS-1, 2012,30(17):2112-2118.
[3] Kristine RC, Liu TB, Carlos RG, et al. High-dose methotrexate pharmacokinetics and outcome of children and young adults with osteosarcoma. Cancer, 2004, 30(8):1724-1732.
[4] 施鑫, 徐明, 刘玉秀, 等. 一线化疗方案联合血管生成抑制剂治疗四肢成骨肉瘤随机、对照、多中心研究的初步报告. 中华骨科杂志, 2012, 32(11):1027-1031.
[5] Common terminology criteria for adverse events (CTCAE).V4.0, http://www.meddramsso.com.[2014-12-28]
[6] Rossi B, Schinzari G, Maccauro G, et al. Neoadjuvant multidrug chemotherapy including High-Dose Methotrexate modifies VEGF expression in Osteosarcoma: an immunohistochemicalanalysis. BMC Musculoskeletal Disorders, 2010, 11:34:1-10.
[7] 张翠欣, 丁国瑾, 刘红卫, 等. 甲氨蝶呤血药浓度动态监测在骨肉瘤治疗中的应用. 临床合理用药, 2009, 11(2):21-22.
[8] 张清, 牛晓辉. 骨肉瘤化疗临床意义和方案实施. 山东医药,2011, 51(40):48-50.
[9] 张威, 何绥平. 大剂量甲氨蝶呤治疗骨肉瘤的毒副反应及防治. 药物不良反应杂志, 2003, 5(4):238-240.
[10] 马胜鑫, 何绥平. 甲氨蝶呤-甲酰四氢叶酸钙治疗骨肉瘤的不良反应及处置. 药物不良反应杂志, 2001, 3(2):107.
[11] 李林, 唐志立, 郭翠华. 大剂量甲氨蝶呤治疗骨肉瘤的药学监护. 中国医院药学杂志, 2009, 29(9):760-761.
[12] Daw NC, Neel MD, Rao BN, et al. Frontline Treatment of Localized Osteosarcoma Without Methotrexate.Results of the St. Jude Children’s Research Hospital OS99 Trial. Cancer,2011, 117(12):2770-2778.
[13] Comandone A, Passera R, Boglione A, et al. High dose methotrexate in adult patients with osteosarcoma: Clinical and pharmacokinetic results. Acta Oncologica, 2005, (44):406-411.
[14] Fukuhara K, Ikawa K, Morikawa, et al. Population pharmacokinetics of high-dose methotrexate in Japanese adult patients with malignancies: a concurrent analysis of the serum and urine concentration data. J Clin Pharma Therapeutics,2008, (33):677-684.
[15] Arakawa H, Yamasaki M, Kurihara Y, et al. Methotrexateinduced pulmonary injury: serial CT findings. J Thorac Imaging, 2003, 18(4):231-236.
[16] Holmboe L, Anderson AM, Morkrid L, et al. High dose methotrexate chemotherapy: pharmacokinetics, folate and toxicity in osteosarcoma patients. Br J Clin Pharmaco, 2012,73(1):106-114.

