17β 雌二醇对丙泊酚诱导原代培养皮层神经元凋亡的影响
李建立,尹德云,王蕴欣,庞鑫鑫,吴红海,侯艳宁
0 引 言
最近动物研究表明,在中枢神经系统的快速发育期连续大剂量应用丙泊酚可引起发育期动物大脑广泛脑区神经细胞的大量凋亡,甚至影响动物远期的学习记忆功能[1-2]。另外大量体外实验研究表明丙泊酚可诱导原代培养神经元的凋亡[3-4]。目前针对丙泊酚的发育期神经毒性已引起了众多学者的广泛关注,因此寻找安全有效的措施防治丙泊酚的发育期神经毒性变得尤为迫切。研究表明17β 雌二醇作为一种内源性神经甾体,参与调节神经系统的发育,影响神经系统的功能,具有神经营养和神经保护作用,近年来17β 雌二醇的神经保护作用已成为国内外研究的热点[5]。本研究观察17β 雌二醇对丙泊酚诱导原代培养皮层神经元凋亡的影响以及机制,以期为临床应用17β 雌二醇预防丙泊酚发育期神经毒性提供实验基础。
1 材料与方法
1.1 材料 丙泊酚(Diprivan,意大利AstraZeneca公司,批号:KW814),20%脂肪乳购自广州百特公司,DMEM 培养液、胎牛血清、Neurobasal 培养液、B27 促生长剂购自美国Gibco 公司,17β 雌二醇、DMSO、MTT 购自美国Sigma 公司,罗丹明染料和胰蛋白酶购自北京索来宝公司,Annexin V-FITC/PI双染试剂盒购自浙江联科生物科技公司。
1.2 方法
1.2.1 皮层神经元原代培养 取新生24 h 内的SD幼鼠大脑额叶皮层组织,用冷PBS 洗剂,剪碎,移入0.125%胰蛋白酶中置于37 ℃水浴锅内充分消化15 min,用含10%胎牛血清的DMEM 培养基终止消化,吸弃上清,然后把细胞转移到含10%胎牛血清的DMEM 培养基中用巴氏滴管轻轻吹打细胞制成细胞悬液。然后经100 目钢丝筛过滤,计数后按1×109/L 的密度接种于经多聚赖氨酸处理的培养板中,放于5%CO2培养箱37 ℃恒温培养24 h 后,全量换Neurobasal+B27 培养基,以后每隔2 天半量换液1 次。体外培养7 d 的神经元用于实验。
1.2.2 实验分组 随机分为对照组(给予相同体积的20%脂肪乳剂),丙泊酚组(500 μmol/L 丙泊酚),丙泊酚+17β 雌二醇组(500 μmol/L 丙泊酚,0.1 μmol/L 17β 雌二醇)。
1.2.3 光镜显微镜下观察不同药物处理后皮层神经元的形态变化 将细胞接种于6 孔板体外培养至7 d,按上述分组方法分别加入不同的药物处理12 h,在光镜显微镜下观察不同药物处理后皮层神经元的形态变化。
1.2.4 MTT 法检测神经元存活率 将细胞接种于96 孔板体外培养至7 d,按上述分组方法分别加入不同的药物处理12 h,移去培养液,每孔加入10 μL MTT 液,37 ℃孵育4 h,加入200 μL DMSO,轻轻振荡溶解甲臜结晶,在多功能酶标仪上测定570 nm 的吸光度值。以对照组平均吸收值为100%,以各处理组吸收值与对照组的比值计算细胞存活率。
1.2.5 流式细胞仪检测神经元凋亡 将细胞接种于6 孔板体外培养至7 d,按上述分组方法分别加入不同的药物处理12 h,移去培养液,PBS 洗剂细胞3次,加入0.125%胰酶,消化的同时镜下观察,当细胞突起回缩,胞体变圆时立即加入含血清的培养基终止消化。然后轻轻吹打混匀用PBS 重悬细胞并计数使每管细胞数目不少于1×106/mL 然后转移到离心管中,1000 r/min 离心5 min(离心半径6 cm),去除上清,收集细胞。PBS 洗剂细胞2 次,1000 r/min 离心5 min(离心半径6 cm),去除上清,暗室中加入195 μL Annexin V-FITC 结合液轻轻重悬细胞然后加入10 μL PI 染色液,轻轻混匀,上机检测各处理组神经元的凋亡率。
1.2.6 罗丹明染色检测皮层神经元线粒体膜电位罗丹明123 可被线粒体吸收,线粒体通透性增加导致膜电位变化,罗丹明123 可被线粒体释放,导致细胞内罗丹明123 荧光强度改变。将细胞接种于6 孔板体外培养至7 d,按上述分组方法分别加入不同的药物处理12 h,PBS 洗剂3 次,加入0.1 μg/mL 的罗丹明123 染液37 ℃孵育30 min。PBS 洗剂3 次后荧光显微镜下观察拍片,用Image 软件分析平均荧光强度并进行统计学分析。
1.3 统计学分析 采用SPSS 13.0 统计软件进行数据分析,数据均用均数±标准差()表示,采用单因素方差分析进行数据分析,组间两两比较采用SNK 法。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 不同处理对神经元形态的影响 原代培养7 d的皮层神经元经不同药物处理12 h 后光镜下观察,对照组神经元胞体丰满,突起较长,相互之间形成复杂的神经网络。与对照组比较,丙泊酚组神经元胞体立体感消失,颜色变暗,细胞轮廓不清,神经元轴突断裂,部分神经元出现死亡。与丙泊酚组比较,丙泊酚+17β 雌二醇组神经元形态变化明显改善。见图1。

图1 不同处理对皮层神经元形态的影响(×200)Figure 1 Morphology of the primarily cultured cortical neurons in the vehicle control(a),propofol(b),and propofol+17β-estradiol(c)groups(×200)
2.2 17β 雌二醇对丙泊酚诱导皮层神经元损伤的影响 丙泊酚组神经元存活率[(52.3±5.2)%]较对照组[(99.9±3.6)%]、丙泊酚+17β 雌二醇组[(90.1±7.2)%]均显著下降(P <0.01)。见图2。
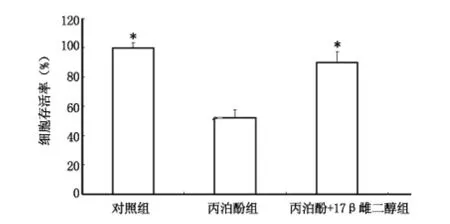
图2 不同处理对皮层神经元存活率的影响Figure 2 Survival rate of the primarily cultured cortical neurons in the vehicle control,propofol,and propofol +17β-estradiol groups
2.3 17β 雌二醇对丙泊酚诱导皮层神经元凋亡的影响 丙泊酚组神经元凋亡率[(43.4±4.6)%]较对照组[(3.1±0.2)%]、丙泊酚+17β 雌二醇组[(22.3±3.2)%]均显著增高(P <0.01)。见图3。
2.4 不同处理对皮层神经元线粒体膜电位的影响丙泊酚组神经元线粒体膜电位[(59.1±5.3)%]较对照组[(99.6±5.8)%]、丙泊酚+17β 雌二醇组[(89.2±7.1)%]显著下降(P <0.01)。见图4。
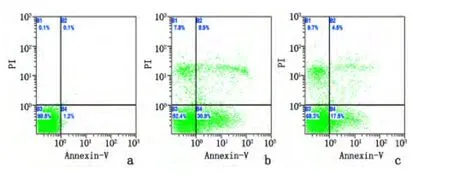
图3 流式细胞仪检测各组皮层神经元凋亡情况Figure 3 Apoptosis rate of the primarily cultured cortical neurons in the vehicle control (a),propofol(b),and propofol +17β-estradiol(c)groups
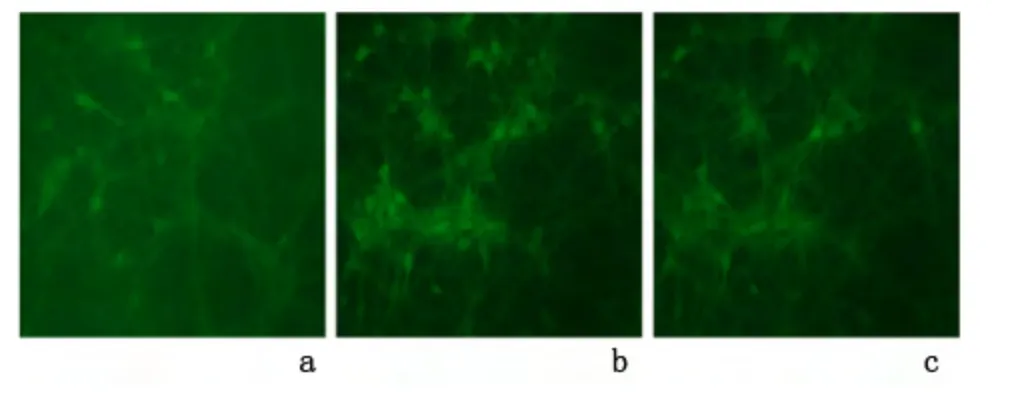
图4 不同处理对皮层神经元线粒体膜电位的影响(×200)Figure 4 Mitochondrial membrane potential of the primarily cultured cortical neurons in the vehicle control(a),propofol(b),and propofol+17β-estradiol(c)groups(×200)
3 讨 论
本研究通过观察17β 雌二醇对丙泊酚诱导原代培养皮层神经元凋亡的影响,发现17β 雌二醇改善了丙泊酚引起的神经元形态学变化,同时抑制了神经元的凋亡,提高了神经元的存活率,其机制可能是通过抑制丙泊酚引起的线粒体膜电位的下降作用实现的。
近年来研究表明丙泊酚对发育期大鼠大脑产生神经毒性,引起广泛脑区神经细胞的凋亡增加,并影响大鼠成年后的学习记忆功能[1-2]。因此丙泊酚的临床应用,尤其是在婴幼儿麻醉中的应用,引起了学者的广泛关注[6]。针对麻醉药引起的发育期大脑损伤,美国国立卫生研究院、食品药品监督管理局以及国际麻醉研究学会要求研究者不仅要研究其发生机制,而且要寻找有效的措施来防治麻醉药所引起发育期神经损伤。以往研究发现右美托咪定、乙酰左旋肉碱、锂剂等可对丙泊酚引起的发育期神经损伤产生保护作用[7-9]。
17β 雌二醇作为一种内源性神经甾体,有研究表明17β 雌二醇具有促进神经元存活以及功能维护的作用[10]。目前学者对17β 雌二醇的神经保护作用进行了一些研究,如对Aβ 神经毒性、缺血缺氧性损伤、氧化应激等产生神经保护作用[11-12]。另外有研究表明17β 雌二醇可通过激活众多促生存信号对γ 氨基丁酸A 型受体(Gamma amino acid type A receptor,GABAR)激动剂苯巴比妥以及N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)拮抗剂MK801 和氯胺酮引起的发育期大鼠大脑损伤产生保护作用[13-14]。Lu 等[15]研究发现17β 雌二醇可通过激活PI3K-Akt 信号通路对麻醉药异氟醚、一氧化氮、咪达唑仑的联合应用所引起的发育期大鼠大脑损伤产生保护作用。乙醇作为一类古老麻醉药,有研究发现17β 雌二醇可对乙醇引起的发育期大鼠大脑神经损伤产生保护作用并改善大鼠成年后的行为学异常[16]。然而17β 雌二醇是否对丙泊酚所诱导原代培养皮层神经元凋亡产生保护作用以及机制目前还不清楚,本研究对此进行了研究发现17β 雌二醇可对丙泊酚诱导的皮层神经元凋亡产生保护作用,保护线粒体膜电位可能是其发挥保护作用的机制之一。
目前研究表明丙泊酚诱导发育期大脑损伤与线粒体凋亡通路密切相关[17]。线粒体控制细胞凋亡的发生主要依赖于两方面:ATP 的持续产生以及线粒体膜电位的稳定,线粒体膜电位的维持是线粒体功能正常发挥的前提条件。当线粒体呼吸链受到抑制时,膜电位发生变化进而释放细胞色素C 以及其他凋亡诱导因子,引起一系列凋亡级联反应,最终诱导细胞凋亡。线粒体功能受抑主要表现为膜电位的下降,膜电位下降是细胞凋亡发生的早期事件,早于细胞核凋亡特征出现以前,线粒体膜电位一旦不能维持,凋亡发生就不可逆转[18]。有研究表明抑制线粒体膜电位的下降可阻止细胞凋亡的发生[19]。本研究结果显示丙泊酚导致原代培养皮层神经元凋亡与线粒体膜电位的下降有关。17β 雌二醇通过抑制丙泊酚引起的神经元线粒体膜电位下降对丙泊酚诱导的皮层神经元凋亡产生保护作用。
总之17β 雌二醇具有保护神经元免受丙泊酚损伤的作用,其机制是通过抑制丙泊酚引起的线粒体膜电位的下降作用实现的。本研究为围术期应用17β 雌二醇预防丙泊酚对婴幼儿大脑产生神经损伤提供了初步的实验依据。
[1] Huang J,Jing S,Chen X,et al.Propofol administration during early postnatal life suppresses hippocampal neurogenesis[J].Mol Neurobiol,2015,PMID:25577171.
[2] Karen T,Schlager GW,Bendix I,et al.Effect of propofol in the immature rat brain on short-and long-term neurodevelopmental outcome[J].PLoS One,2013,8(5):e64480.
[3] Zhong Y,Liang Y,Chen J,et al.Propofol inhibits proliferation and induces neuroapoptosis of hippocampal neurons in vitro via downregulation of NF-κB p65 and Bcl-2 and upregulation of caspase-3[J].Cell Biochem Funct,2014,32(8):720-729.
[4] Berns M,Seeberg L,Schmidt M,et al.High-dose propofol triggers short-term neuroprotection and long-term neurodegeneration in primary neuronal cultures from rat embryos[J].J Int Med Res,2009,37(3):680-688.
[5] Hirst JJ,Kelleher MA,Walker DW,et al.Neuroactive steroids in pregnancy:Key regulatory and protective roles in the foetal brain[J].Steroid Biochem Mol Biol,2014,139:144-153.
[6] 范国祥,张卉颖,耿明倩,等.持续输注右美托咪啶对丙泊酚复合瑞芬太尼静脉麻醉用药量的影响[J].医学研究生学报,2014,27(3):268-271.
[7] Li J,Xiong M,Nadavaluru PR,et al.Dexmedetomidine attenuates neurotoxicity induced by prenatal propofol exposure[J].J Neurosurg Anesthesiol,2015,PMID:25844953.
[8] Liu F,Rainosek SW,Sadovova N,et al.Protective effect of acetyl-L-carnitine on propofol-induced toxicity in embryonic neural stem cells[J].Neurotoxicology,2014,42:49-57.
[9] Straiko MM,Young C,Cattano D,et al.Lithium protects against anesthesia-induced developmental neuroapoptosis[J].Anesthesiology,2009,110(4):862-868.
[10] Fiocchetti M,Ascenzi P,Marino M.Neuroprotective effects of 17beta-estradiol rely on estrogen receptor membrane initiated signals[J].Front Physiol,2012,3:73.
[11] 段立晖,周国庆,夏树开,等.B 淀粉样蛋白诱导大鼠海马神经元Tau 蛋白异常磷酸化及雌激素的保护作用[J].医学研究生学报,2008,21(5):486-490.
[12] Melcangi RC,Panzica G,Garcia-Segura LM.Neuroactive steroids:focus on human brain[J].Neuroscience,2011,191:1-5.
[13] Asimiadou S,Bittigau P,Felderhoff-Mueser U,et al.Protection with estradiol in developmental models of apoptotic neurodegeneration[J].Ann Neurol,2005,58(2):266-276.
[14] Li J,Wang B,Wu H,et al.17β-estradiol attenuates ketamineinduced neuroapoptosis and persistent cognitive deficits in the developing brain[J].Brain Res,2014,1593:30-39.
[15] Lu LX,Yon JH,Carter LB,et al.General anesthesia activates BDNF-dependent neuroapoptosis in the developing rat brain[J].Apoptosis,2006,11(9):1603-1615.
[16] Ramezani A,Goudarzi I,Lashkarbolouki T,et al.Neuroprotective effects of the 17beta-estradiol against ethanol-induced neurotoxicity and oxidative stress in the developing male rat cerebellum:biochemical,histological and behavioral changes[J].Pharmacol Biochem Behav,2011,100(1):144-151.
[17] Zou W,Xiao H,Gu M,et al.Propofol induces rat embryonic neural stem cell apoptosis by activating both extrinsic and intrinsic pathways[J].Mol Med Rep,2013,7(4):1123-1128.
[18] 王晓东,陈美苑,曽 志,等.促血小板生成素对化学性缺氧诱导的PC12 细胞凋亡的影响[J].中国病理生理杂志,2015,31(3):409-414.
[19] Harada H,Grant S.Apoptosis regulators[J].Rev Clin Exp Hematol,2003,7(2):117-138.

