间充质干细胞培养上清输注对糖尿病大鼠治疗作用的机制研究
庞雅平,程愈,郝好杰,刘杰杰,申晶
·基础研究·
间充质干细胞培养上清输注对糖尿病大鼠治疗作用的机制研究
庞雅平,程愈,郝好杰,刘杰杰,申晶
目的 观察间充质干细胞(MSCs)培养上清输注对糖尿病大鼠高血糖紊乱的治疗效果,探讨MSCs分泌产物促进胰岛再生的作用机制。方法 SD大鼠腹腔单次注射大剂量链脲佐菌素(STZ,65mg/kg)建立糖尿病大鼠模型,将诱导成功的30只糖尿病大鼠随机分为MSCs培养上清治疗组(CM,n=15)、培养基治疗组(M,n=15),分别输注MSCs培养上清、培养基。另将15只正常大鼠作为对照组。连续治疗3d后每日测血糖,于治疗第7天测定血清胰岛素及C肽,并行腹腔糖耐量检查(IPGTT)。对动物胰腺组织标本行多重免疫荧光染色,观察MSCs上清治疗后胰岛β细胞再生情况,并进一步探究胰岛细胞再生的可能机制。结果 与M组比较,治疗早期(<7d)CM组糖尿病大鼠血糖降低,血清胰岛素及C肽含量明显增加(P<0.05)。IPGTT结果显示,CM组较M组糖尿病大鼠胰岛功能明显增强。胰腺组织多重免疫荧光染色提示,CM组糖尿病大鼠的胰岛内β细胞数量较M组明显增加(P<0.05),但仍少于对照组;β细胞增殖率较M组及对照组均显著提高(P<0.01)。结论 MSCs分泌产物通过促进胰岛β细胞增殖,促进胰腺再生,恢复胰岛功能,可用于早期糖尿病的控制与治疗。
间质干细胞;胰岛;再生;胰岛素分泌细胞
间充质干细胞(MSCs)是一类具有自我复制和多向分化潜能的成体干细胞,在多种疾病中参与受损组织的修复与再生,如心肌梗死[1]、急性肾损伤[2]、创伤[3]等。临床数据显示[4],MSCs输注能降低糖尿病患者的血糖水平,显著减少外源性胰岛素用量。此外,在糖尿病动物模型中,MSCs的系统输注可明显提高β细胞质量,升高体内胰岛素水平,有效改善高血糖状态[5-6]。尽管MSCs治疗为治愈糖尿病带来了希望,但关于细胞治疗的安全性尚存在很大争议,制约了干细胞治疗的推广应用。与此同时越来越多的学者发现,MSCs的分泌效应在其促进组织损伤再生修复的过程中发挥了重要作用[7-10]。本课题组前期研究发现,输注MSCs上清在一定程度上可起到类似干细胞本身输注的作用,达到促进糖尿病大鼠胰岛再生、改善高糖状态的效果,但与细胞本身输注治疗相比在疗效上仍存在很大差距,且其促β细胞再生的具体机制尚未明确[6]。本实验旨在对MSCs上清液进行浓缩以增强治疗效应,同时对MSCs分泌产物促进胰岛β细胞再生的机制进行初步研究。
1 材料与方法
1.1 实验动物、主要试剂及仪器 8周龄雄性SD大鼠(SPF级)50只,体重200~220g,购自解放军总医院医学实验动物中心(动物合格证号:11400700074794)。L-DMEM、FBS(Hyclone,美国);KO血清、荧光二抗(Invitrogen,美国);0.25%胰蛋白酶(Gibco,美国);Glucagon抗体(1/1500)、Insulin抗体(1/150)、Ki-67(1/30)、H33342核染料(1/2000)、STZ(Sigma,美国)。细胞培养孵箱(Heraeus Sepatech,德国);台式小型高速离心机(Eppendorf,德国);低温冰冻切片机(Leica,德国);激光共聚焦显微镜(Olympus,日本);血糖仪(强生,美国)。
1.2 方法
1.2.1 SD大鼠骨髓间充质干细胞(BM-MSCs)分离、培养及培养上清的获取 雄性,体重100g的正常SD大鼠麻醉后脱颈处死,用含胎牛血清的LDMEM培养基冲出股骨、胫骨的骨髓接种至培养皿,37℃、5% CO2进行原代培养。通过密度梯度离心法和贴壁培养法分离、扩增MSCs,待细胞达90%以上融合时使用胰蛋白酶消化传代。传至第3代时更换为KO血清培养基,孵育48h后取培养上清,4℃离心,10倍浓缩待用。
1.2.2 糖尿病模型的制备及分组 35只SD大鼠禁食12h后称重并经尾静脉采血测基础血糖,用柠檬酸缓冲液溶解链脲佐菌素(STZ),按照65mg/kg的剂量单次腹腔注射。第3天起每日9:00-10:00尾静脉采血测血糖,连续3d血糖值>28mmol/L的大鼠判定为造模成功。将30只成模大鼠随机分为MSCs培养上清治疗组(CM,n=15)、培养基输注组(M,n=15)。另将15只正常大鼠作为对照组。
1.2.3 MSCs培养上清输注及血清学指标测定 CM组的糖尿病大鼠经尾静脉缓慢注入MSCs培养上清浓缩液,2ml/d,连续3d,M组输注等量MSCs培养基。然后每日尾静脉采血测血糖,于治疗第7天尾静脉采血检测血清胰岛素及C肽水平,并进行腹腔糖耐量实验(IPGTT)检测:各组大鼠在空腹状态下经腹腔注射葡萄糖(2g/kg),分别于注射后30、60、90、120min检测血糖。
1.2.4 胰腺组织标本的制备、切片及免疫荧光染色各组大鼠分别于治疗后2、7、15、30d经戊巴比妥钠麻醉成功后迅速打开胸腔,PBS经主动脉快速灌流,再以4%多聚甲醛固定1.5~2.0h,取胰腺组织放入30%PB蔗糖溶液中脱水,至组织沉底后用包埋剂包埋保存于–80℃。取胰腺(中尾部)组织以5µm厚度连续切片,进行insulin/glucagon、insulin/Ki-67免疫荧光染色。激光共聚焦显微镜下观察并采集图像。
1.3 统计学处理 采用SPSS 18.0软件进行分析,所有数据以±s表示,多组间比较采用方差分析,进一步比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MSCs浓缩上清输注对STZ诱导的糖尿病大鼠高血糖的改善作用 CM组糖尿病大鼠在治疗早期(<7d)血糖水平明显降低,从30.64±1.99mmol/L降至20.98±1.46mmol/L。M组的糖尿病大鼠为持续高糖状态,血糖始终维持在30.28±0.75mmol/L,治疗前后差异无统计学意义。IPGTT结果显示,CM组糖尿病大鼠在治疗后7d受损胰腺的糖代谢能力明显改善,且血清胰岛素水平及C肽含量较M组明显增加。但在治疗晚期(>7d)大鼠随机血糖出现逐渐上升趋势,治疗后15d血糖升高至治疗前水平(图1)。
2.2 MSCs浓缩上清输注对胰岛内β细胞数量的影响 insulin/glucagon免疫荧光染色观察发现,STZ注射后大鼠胰腺内β细胞毁损达95%以上。在治疗早期(<7d),与M组相比,CM组大鼠受损胰岛中β细胞数量明显增多,以治疗后2d增加最为明显,增加约3~5倍,β细胞数于治疗后7d开始逐渐减少,至15d时与M组比较差异无统计学意义(图2)。
2.3 MSCs浓缩上清输注对胰岛β细胞增殖的影响 为明确糖尿病大鼠体内新生β细胞的来源,我们对胰岛细胞进行insulin/Ki-67免疫荧光染色,结果显示:在对照组和M组糖尿病大鼠胰岛内几乎观察不到Ki-67染色阳性的β细胞,提示成年大鼠胰岛内β细胞很少出现增殖,而CM组在治疗早期(<7d)胰岛β细胞中Ki-67阳性细胞比例(4.0%)与对照组、M组(分别为0.5%、0.14%)相比明显增加,治疗后2d后Ki-67阳性的细胞数量最多,但治疗晚期(>7d)Ki-67阳性细胞明显减少(图3)。

图1 MSCs培养上清输注对STZ诱导的糖尿病大鼠高血糖的改善作用Fig. 1 MSC supernatant infusion ameliorate the STZ-induced hyperglycemia in DM rats

图2 MSCs浓缩上清输注对胰岛内β细胞的数量的影响(Insulin/glucagon免疫荧光染色)Fig. 2 Effect of infusion of concentrated MSCs supernatant on the number of islet β cells (Insulin/glucagon immunofluorescent staining) Red represents insulin, green represents glucagon; (1)P<0.05, (2)P<0.01
3 讨 论
近年来随着研究深入,MSCs治疗糖尿病在临床试验和动物研究中均表现出令人兴奋的疗效,接受干细胞治疗的糖尿病个体血糖水平明显下降,糖耐量异常明显改善,外源胰岛素需要量显著减少。但细胞治疗的具体作用机制极为复杂,回顾文献,目前已知的机制有:①免疫调节和抗炎作用。MSCs具有特殊的免疫调节功能,通过分泌一系列细胞因子,作用于抗原呈递细胞、T细胞和自然杀伤细胞等免疫细胞产生免疫抑制[11]。MSCs还可分泌抗炎因子,参与免疫抑制,进而防止炎症和自身免疫病的发生[12]。②促进胰腺再生。MSCs治疗糖尿病的体内外实验提示,MSCs可活化内源性干、祖细胞向胰岛素生成细胞分化[13],促进非β细胞向β细胞重编程[14],促进胰岛β细胞增殖[15],以及抑制细胞凋亡[7],进而实现胰腺再生。而其中MSCs分泌的生长因子,如血管内皮生长因子(VEGF)[16]、胰岛素样生长因子-1(IGF-1)[17]、肝细胞生长因子(HGF)[18]等在促进胰岛内血管生成、保护β细胞存活、抗凋亡等多种机制中发挥重要作用。③改善胰岛素抵抗。最新研究发现,MSCs输注可有效改善2型糖尿病大鼠周围靶组织对胰岛素的敏感性[19]。而MSCs分泌的效应因子成纤维细胞生长因子-1(FGF-1)在改善胰岛素抵抗中发挥重要作用[20]。综上所述,虽然MSCs通过多种途径促进胰腺再生,但究其根本均与其分泌效应密切关联。
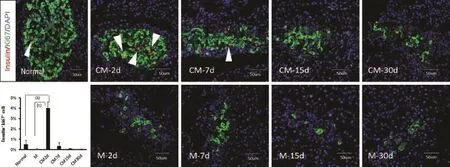
图3 MSCs培养上清输注对胰岛β细胞增殖的影响(Insulin/Ki-67免疫荧光染色)Fig. 3 Effect of infusion of MSCs supernatant on islet β cell proliferation (Insulin/Ki-67 immunofluorescent staining) Red represents Ki-67, green represents insulin; the arrows indicate the insulin+Ki-67+cells. (1)P<0.01, (2)P<0.01
我们的前期研究证实,对糖尿病大鼠进行直接MSCs上清输注在一定程度上确实可以促进糖尿病大鼠的胰岛再生,但对高血糖的改善并不明显,推测可能与上清液中有效活性分子的浓度太低,上清去细胞后缺乏持续的因子分泌有关。因此,本实验对MSCs上清进行适度浓缩结果显示,MSCs浓缩上清于治疗早期可明显降低糖尿病大鼠的血糖水平,并且给予糖负荷后可刺激胰岛素分泌,而对照组无明显变化,表明MSCs浓缩上清治疗使受损的胰岛功能得到恢复,尽管这一效应仅仅出现于治疗早期(<7d)。此外,单次大剂量STZ腹腔注射可导致胰腺β细胞重度毁损,体内β细胞严重不足,而治疗早期胰岛内β细胞数量较对照组明显增多,同时伴随β细胞的显著增殖,其增殖率达4%~8%,远远高于健康成年大鼠的β细胞增殖率(0.5%)[21]。由此推断MSCs分泌效应可能通过提高胰岛β细胞增殖率,从而实现胰岛再生,在治疗早期可有效改善高血糖状态。
遗憾的是,本研究发现上述疗效仅仅发生于治疗早期,随着时间的推移,糖尿病大鼠血糖逐渐升高至治疗前的高糖状态,且伴随β细胞数量的显著减少,β细胞增殖明显降低。可能原因为:①MSCs上清中效应因子含量有限,且存在一定的半衰期,仅能维持短期疗效,长期效果不显著;②新生β细胞无力抵抗高糖环境的刺激,致新生细胞凋亡[22];③持续的高糖环境抑制细胞增殖[23]。
总之,MSCs上清于治疗早期可促进受损胰岛再生,至少部分是通过促进β细胞增殖来实现的。如何提高MSCs上清的疗效,延长作用时间,以及对发挥主要疗效的细胞因子的鉴别均有待进一步研究。
[1]Tang Y, Gan X, Cheheltani R, et al. Targeted delivery of vascular endothelial growth factor improves stem cell therapy in a rat myocardial infarction model[J]. Nanomedicine, 2014, 10(8): 1711-1718.
[2]Humphreys BD, Bonventre JV. Mesenchymal stem cells in acute kidney injury[J]. Annu Rev Med, 2008, 59: 311-325.
[3]O'Loughlin A, Kulkarni M, Creane M, et al. Topical administration of allogeneic mesenchymal stromal cells seeded in a collagen scaffold augments wound healing and increases angiogenesis in the diabetic rabbit ulcer[J]. Diabetes, 2013, 62(7): 2588-2594.
[4]Jiang R, Han Z, Zhuo G, et al. Transplantation of placentaderived mesenchymal stem cells in type 2 diabetes: apilot study[J]. Front Med, 2011, 5(1): 94-100.
[5]Gao X, Song L, Shen K, et al. Transplantation of bone marrow derived cells promotes pancreatic islet repair in diabetic mice[J]. Biochem Biophys Res Commun, 2008, 371(1): 132-137.
[6]Cheng Y, Sheng J, Hao HJ, et al. Mechansim of bone marrowmesenchymal stem cells transplantation in promoting β-cell regeneration in diabetes rats[J]. Acad J Chin PLA Med Sch, 2013, 34(6): 610-613. [程愈, 申晶, 郝好杰, 等. 骨髓间充质干细胞移植促进糖尿病大鼠β细胞再生的机制[J]. 解放军医学院学报, 2013, 34(6): 610-613.]
[7]Ankrum J, Karp JM. Mesenchymal stem cell therapy: Two steps forward, one step back[J]. Trends Mol Med, 2010, 16(5): 203-209.
[8]Kono TM, Sims EK, Moss DR, et al. Human adipose-derived stromal/stem cells protect against STZ-inducedhyperglycemia: analysis of hASC-derived paracrine effectors[J]. Stem Cells, 2014, 32(7): 1831-1842.
[9]Hu S, Pang SG, Cui Y, et al. Osteogenic potential of bone marrow mesenchymal stem cells from streptozotocin-induced diabetic rats[J]. J Shandong Univ (Health Sci), 2013, 51(8): 7-12. [胡苏, 逄曙光, 崔莹, 等. 链脲佐菌素诱导糖尿病大鼠骨髓间充质干细胞成骨分化[J]. 山东大学学报(医学版), 2013, 51(8): 7-12.]
[10]Ren LL, Chen LJ, Qi H, et al. J Jilin Univ (Med Ed) 2013, 39(1): 19-24. [任莉莉, 陈丽娟, 齐晖, 等. 胎胰蛋白促进人脂肪来源的间充质干细胞向胰岛素及C-肽阳性细胞的分化及细胞鉴定[J]. 吉林大学学报(医学版), 2013, 39(1): 19-24.]
[11]Uccelli A, Pistoia V, Moretta L. Mesenchymal stem cells: a new strategy for immunosuppression[J]? Trends Immunol, 2007, 28(5): 219-226.
[12]Ben-Ami E, Berrih-Aknin S, Miller A. Mesenchymal stem cells as an immuneomodulatory therapeutic strategy forautoimmune diseases[J]. Autoimmun Rev, 2011, 10(7): 410-415.
[13]Si YL, Zhao YL, Hao HJ, et al. MSCs: Biological characteristics, clinical applications and their outstandingconcerns [J]. Ageing Res Rev, 2011, 10(1): 93-103.
[14]Thorel F, Népote V, Avril I, et al. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss[J]. Nature, 2010, 464(7292): 1149-1154.
[15]Hao H, Liu J, Shen J, et al. Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemia in experimental type 2 diabetes rats[J]. Biochem Biophys Res Commun, 2013, 436(3): 418-423.
[16]Milanesi A, Lee JW, Li Z, et al. β-Cell regeneration mediated by human bone marrow mesenchymal stem cells[J]. PLoS One, 2012, 7(8): e42177.
[17]Agudo J, Ayuso E, Jimenez V, et al. IGF-I mediates regeneration of endocrine pancreas by increasing beta cell replication through cell cycle protein modulation in mice[J]. Diabetologia, 2008, 51(10): 1862-1872.
[18]Mellado-Gil JM, Cobo-Vuilleumier N, Gauthier BR. Islet β-cell mass preservation and regeneration in diabetes mellitus: four factors with potential therapeutic interest[J]. J Transplant, 2012, 2012: 230870.
[19]Si Y, Zhao Y, Hao H, et al. Infusion of mesenchymal stem cells ameliorates hyperglycemia in type 2 diabeticrats: identification of a novel role in improving insulin sensitivity[J]. Diabetes, 2012, 61(6): 1616-1625.
[20]Suh JM, Jonker JW, Ahmadian M, et al. Endocrinization of FGF1 produces a neomorphic and potent insulin sensitizer[J]. Nature, 2014, 513(7518): 436-439.
[21]Dickson LM, Rhodes CJ. Pancreatic beta-cell growth and survival in the onset of type 2 diabetes: a role for protein kinase B in the Akt[J]? Am J Physiol Endocrinol Metab, 2004, 287(2): E192-E198.
[22]Vasu S, McClenaghan NH, McCluskey JT, et al. Cellular responses of novel human pancreatic β-cell line, 1.1B4 to hyperglycemia[J]. Islets, 2013, 5(4): 170-177.
[23]Levitt HE, Cyphert TJ, Pascoe JL, et al. Glucose stimulates human beta cell replication in vivo in islets transplanted in to NOD-severe combined immunodeficiency (SCID) mice[J]. Diabetologia, 2011, 54(3): 572-582.
Infusion of mesenchymal stem cells culture supernatant ameliorates hyperglycemia disorders in STZ-induced diabetes mellitus rats
PANG Ya-ping1, CHENG Yu2, HAO Hao-jie2, LIU Jie-jie2, SHEN Jing3*1Graduate School of Hebei North University, Zhangjiakou, Hebei 075000, China
2School of Life Science, General Hospital of Chinese PLA, Beijing 100039, China
3Department of Endocrinology, 309 Hospital of Chinese PLA, Beijing 100091, China
*
, E-mail: shenjingshenhua@126.com
This work was supported by the National Natural Science Foundation of China (81200615)
ObjectiveTo evaluate the therapeutic effect of systemic infusion of MSC culture supernatant in STZ-induced diabetic rats, and explore the mechanism of effect of MSC secretion on promoting regeneration of the islet tissues.MethodsThe diabetic animal model was reproduced in 35 SD rats by intraperitoneal injection of a single large dose of streptozotocin (STZ, 65mg/ kg). The 30 successfully induced diabetic rats were randomly divided into MSC culture supernatant infusion group (CM, n=15) and medium infusion group (M, n=15), and in addition, 15 normal rats were used as control. Animals were intravenously transfused with MSC supernatant (CM group) or raw medium (M group), then the contents of blood glucose were determined 3 days after infusion. The serum insulin and C-peptide levels were monitored and the intraperitoneal glucose tolerance test (IPGTT) was performed on the 7th day of infusion to evaluate the therapeutic effect of MSCs supernatant infusion in diabetic rats. Finally, all the experimental animals were sacrificed at indicated time points and the pancreatic tissues were collected for multiple immunofluorescence staining (MIFS), in order to observe the β-cell regeneration after MSCs supernatant infusion, and to further explore the possible mechanism involved in the experiment.ResultsAt the early stage after infusion (<7 days), the blood glucose level declined and the contents of serum insulin and C-peptide increased obviously in CM group as compared with that of M group (P<0.05). IPGTT showed that the islet function was significantly enhanced in CM group compared with M group. MIFS showed that the number of β cells in thedestroyed islets in CM group rats was significantly increased as compared with that of M group rats. In addition, the proliferation rate of β cells was obviously higher in CM group (4%) than in control group (0.5%, P<0.01). ConclusionTreatment with MSCs culture supernatant obviously prompted β cell proliferation in the destroyed islets, resulting in regeneration of the islets with islet function recovery, thus it effectively controls the advance of diabetes.
mesenchymal stem cells; islets of Langerhans; regeneration; insulin-secreting cells
R587.1
A
0577-7402(2015)06-0449-05
10.11855/j.issn.0577-7402.2015.06.05
2015-01-15;
2015-03-23)
(责任编辑:张小利)
国家自然科学基金(81200615)
庞雅平,硕士研究生。主要从事间充质干细胞与糖尿病治疗方面的研究
075000 河北张家口 河北北方学院研究生院(庞雅平);100039 北京 解放军总医院生命科学院(程愈、郝好杰、刘杰杰);100091 北京 解放军309医院内分泌科(申晶)
申晶,E-mail:shenjingshenhua@126.com

