乌司他丁对热打击血管内皮细胞增殖及炎症因子释放的影响
潘志国,邵玉,耿焱,陈镜合,苏磊
乌司他丁对热打击血管内皮细胞增殖及炎症因子释放的影响
潘志国,邵玉,耿焱,陈镜合,苏磊
目的 探讨乌司他丁对热打击血管内皮细胞增殖及炎症因子释放的影响。方法 将人脐静脉内皮细胞株(HUVEC)细胞分为对照组及不同剂量(1000、2000、3000、4000、5000、6000、7000U/ml)乌司他丁组,采用CCK-8法检测不同剂量乌司他丁对热打击下HUEVC细胞增殖的影响。另将HUVEC分为对照组、43℃热打击组及43℃热打击+乌司他丁组,采用ELISA法测定乌司他丁对热打击条件下HUVEC细胞炎症因子白介素6(IL-6)和肿瘤坏死因子α(TNF-α)释放的影响。结果 不同剂量乌司他丁对HUVEC细胞增殖均无明显抑制作用(P>0.05)。ELISA检测结果显示,培养后即刻(0h),43℃热打击+乌司他丁组IL-6、TNF-α的释放较对照组及43℃热打击组明显降低(P<0.05);6h时43℃热打击+乌司他丁组IL-6、TNF-α的释放较43℃热打击组仍明显降低(P<0.05)。结论 乌司他丁对热打击下的HUEVC细胞增殖无抑制作用,但可抑制细胞IL-6和TNF-α的释放。
乌司他丁;中暑;内皮细胞;细胞增殖
中暑是一种严重威胁人民群众生命的疾病,是我国南方地区夏季的一种常见病,尤其在军事训练中时有发生[1]。国外流调显示中暑的病死率为10%~15%,一旦发展为重症中暑合并多器官功能衰竭(MODS),则病死率可达40%以上,即使存活也有30%以上遗留长期的神经系统等各类后遗症[2-4]。多项研究表明,在重症中暑的病理生理过程中,血管内皮细胞既是参与炎症应答的主要细胞之一,亦是炎症损害的靶细胞[5]。我们前期的临床研究通过检测重症中暑患者外周血循环血管内皮细胞数量、血清血管假性血友病因子(vWF)以及血栓调节蛋白(TM)溶度,发现乌司他丁使重症中暑患者培养上清脱落血管内皮细胞数量明显减少,vWF和TM浓度下降[6]。笔者前期实验亦证实热打击对血管内皮细胞具有细胞毒效应,可抑制其增殖,并促进炎症因子白介素6(IL-6)和肿瘤坏死因子α(TNF-α)的释放[7]。本实验旨在初步探讨乌司他丁对热打击下体外培养人血管内皮细胞增殖及炎症因子释放的影响,以进一步研究血管内皮细胞在重症中暑发生及发展中的作用,寻找可能有效的治疗药物。
1 材料与方法
1.1 实验材料及试剂 人脐静脉内皮细胞株(HUEVC)为广州总医院医学实验科创建并保存。人IL-6和TNF-α ELISA检测试剂盒分别购自中国CUSABIO和ExCell公司。CCK-8试剂盒购自日本同仁公司,乌司他丁购自天普公司。
1.2 方法
1.2.1 HUVEC细胞培养 HUVEC细胞复苏后,置于离心管中1000r/min离心10min,弃上清,用高糖DMEM培养液(含10%胎牛血清,10万U/L青霉素、100mg/L链霉素)混匀细胞,转入25ml培养瓶中,在37℃、5%CO2浓度及饱和湿度条件下培养,次日换液,以后根据细胞生长情况每48~72h更换培养液一次,每周传代1~2次。
1.2.2 CCK-8法检测乌司他丁对热打击下HUVEC细胞增殖的影响 取对数生长期HUVEC细胞,按5×103个/孔密度铺入可拆卸96孔板,培养24h后,更换无血清高糖DMEM(100μl/孔)培养过夜,细胞分为对照组和1000、2000、3000、4000、5000、6000、7000U/ml组,除对照组外,其余各组加入相应浓度乌司他丁,并设置4个复孔,过夜培养。于每组细胞上清中加入10μl CCK-8,重新置于标准37℃、5%CO2浓度培养箱中孵育2h,用酶联免疫检测仪在450nm处读取吸光度(A)值,计算细胞增殖率。继续培养24、48、72h后,再次计算细胞增殖率。每个独立实验重复3次[8]。
1.2.3 双抗体夹心ELISA法测定乌司他丁对HUVEC热打击下IL-6、TNF-α释放的影响 取对数生长期细胞,按5×105个/皿密度铺入60mm×15mm细胞培养皿,培养至单层融合后,更换无血清高糖DMEM(1.5ml/皿)培养过夜。实验分为对照组(细胞于37℃培养箱中培养1h)、43℃热打击组(细胞于43℃培养箱中培养1h)和43℃热打击+乌司他丁组(细胞培养液中加入3000U/ml乌司他丁并于43℃培养箱中培养1h)。分别于培养后即刻(0h)以及6h(置于37℃)后取上清待检。按CUSABIO和ExCell公司试剂盒说明,采用ELISA法检测培养上清中的IL-6 和TNF–α浓度。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料以±s表示,在方差齐性基础上多组间比较采用方差分析,进一步两两比较采用Bonferroni检验。P<0.05为差异有统计学意义。
2 结 果
2.1 乌司他丁对HUVEC细胞增殖的影响 CCK-8检测结果显示,与对照组(0h)比较,各种剂量组细胞24、48、72h增殖率均无明显下降(P>0.05)。且相对于未加乌司他丁的对照组,其他各剂量乌司他丁组对HUVEC细胞的增殖均无明显抑制作用(P>0.05,图1)。
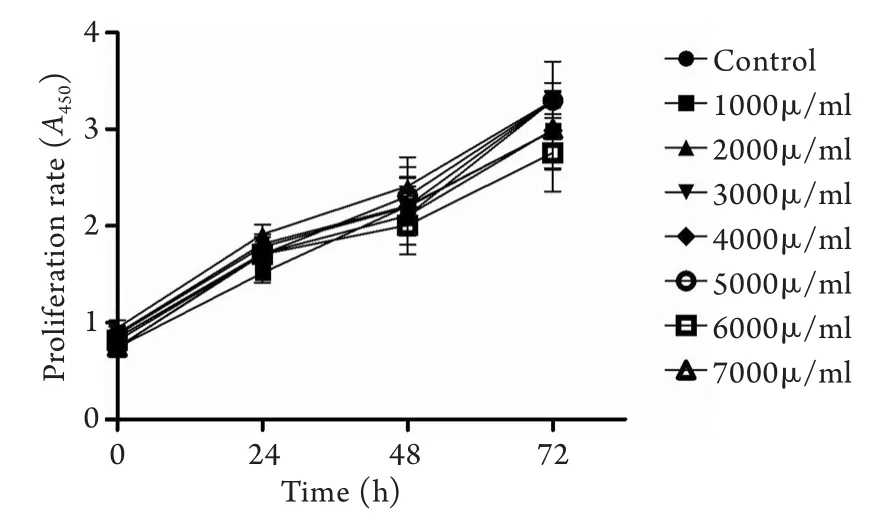
图1 不同剂量乌司他丁对HUVEC细胞活力及增殖的影响Fig.1 Influence of ulinastatin on activity and proliferation of HUVEC cells
2.2 乌司他丁对热打击下HUVEC细胞炎症因子释放的影响 与对照组比较,43℃热打击+乌司他丁组在0h时的IL-6、TNF-α释放均较对照组及43℃热打击组明显降低(P<0.05)。43℃热打击+乌司他丁组HUVEC细胞在6h时的IL-6、TNF-α释放均较43℃热打击组明显降低(P<0.05,图2)。
3 讨 论
目前认为重症中暑是一种继发于热损伤之后的全身炎症反应综合征(SIRS),进而发展为类脓毒症,引发多脏器功能衰竭的过程[9]。血管内皮细胞与炎症细胞的功能异常被视为重症中暑发生发展的病理基础[3,10]。大量的动物实验表明,重症中暑的死因包括:①全身炎症细胞的活化,如单核细胞的迁移和跨血管壁运动;②广泛出血和血栓形成(弥散性血管内凝血即DIC);③广泛血管床内皮细胞损伤[11-12],以上病理变化最后均作用于血管内皮细胞。有研究发现,在重症中暑动物模型中多脏器血管内皮结构和功能均受到损害,损伤血管内皮可促进白细胞和血小板黏附,为中暑炎症损伤和血栓形成提供了结构基础[13]。目前重症医学将血管内皮看作一个特殊的器官系统,有研究发现,血管内皮细胞损伤是影响重症中暑病理生理序贯进展的关键因素[5],血管内皮细胞不仅仅是炎症反应中的被动靶细胞,也是一种效应细胞,影响重症中暑的发生发展。
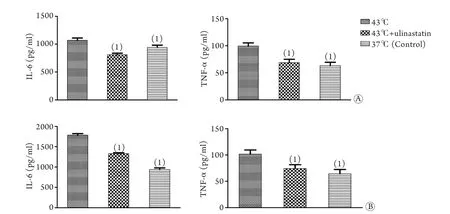
图2 乌司他丁对热打击条件下HUVEC细胞炎症因子释放的影响Fig.2 Influence of ulinastatin on IL-6 and TNF-α release of HUVEC under heatshock
乌司他丁是从人尿液中提取的一种弹性蛋白酶抑制物,因其具有抗炎、减轻细胞与组织损伤、改善微循环与内皮细胞通透性等作用,广泛应用于胰腺炎、急性肺损伤和脓毒症等的治疗[14-17]。有研究称乌司他丁能维护血管正常舒缩功能及内皮细胞完整性,使内皮细胞表达的细胞间黏附分子-1和CD11b明显减少,白细胞与血管内皮细胞的黏附减少,明显减轻血管内皮细胞损伤[14]。因此,乌司他丁对于抑制全身过度的炎症反应,保护机体免受炎症伤害具有重要意义。有文献指出,乌司他丁对患者机体无明显毒副作用,并建议增大治疗剂量[18-19]。本研究CCK-8实验结果显示,与对照组(0h)比较,各实验组细胞24、48、72h增殖率均无明显下降(P>0.05),且各剂量组乌司他丁对HUVEC细胞增殖均无明显抑制作用(P>0.05)。
在本研究中,相对于37℃对照组,在给予3000U/ml乌司他丁与HUVEC细胞共孵育1h后,检测0h及6h组细胞上清炎症因子IL-6、TNF-α的浓度,结果显示,在加入乌司他丁共孵育且经历43℃热打击1h后,不但在0h组HUVEC细胞IL-6、TNF-α的释放受到抑制(P<0.05),在6h后,加入乌司他丁共孵育的HUVEC细胞上清中的IL-6、TNF-α均较43℃有所下降(P<0.05)。提示乌司他丁可抑制热打击后IL-6、TNF-α的分泌,且可持续6h。
总之,针对乌司他丁在热打击中对HUVEC细胞作用机制的进一步研究,将有助于进一步了解重症中暑发生、发展的机制以及寻找新的有效治疗药物。
[1]Su L, Guo ZH, Qian HJ. Epidemiological study and key-point analysis of severe heatstroke patients[J]. Med J Chin PLA, 2006, 31(9): 909-911. [苏磊, 郭振辉, 钱洪津. 重症中暑住院病人流行病学调查与分析[J]. 解放军医学杂志, 2006, 31(9): 909-911.]
[2]Glazer JL. Management of heatstroke and heat exhaustion[J]. Am Fam Physician, 2005, 71(11): 2133-2140.
[3]Bouchama A, Knochel JP. Heat stroke [J]. N Engl J Med, 2002, 346(25): 1978-1988.
[4]Hammami MM, Bouchama A, Al-Sedairy S, et al. Concentrations of soluble tumor necrosis factor and interleukin-6 receptors in heatstroke and heatstress[J]. Crit Care Med, 1997, 25(8): 1314-1319.
[5]Roberts GT, Ghebeh H, Chishti MA, et al. Microvascular injury, thrombosis, inflammation, and apoptosis in the pathogenesis of heatstroke: a study in baboon model[J]. Arterioscler Thromb Vasc Biol, 2008, 28(6): 1130-1136.
[6]Tong HS, Chen Y, Tang YQ, et al. Protection of ulinastatin on the endothelial cell injury of patients with severe heatshock[J]. Guangdong Med J, 2011(12): 1574-1576. [童华生, 陈怿, 唐柚青, 等. 乌司他丁对重症中暑患者血管内皮细胞损伤的保护作用[J]. 广东医学, 2011(12): 1574-1576.]
[7]Pan ZG, Geng Y, Zhang JM, et al. Effect of heat stress on the injury of vascular endothelial cells and release of IL-6 and TNF-α in vitro[J]. Shandong Med J, 2012, 52(3): 32-34. [潘志国, 耿焱, 张剑明, 等. 热刺激对体外培养的血管内皮细胞损伤及IL-6、TNF-α释放的影响[J]. 山东医药, 2012, 52(3): 32-34.]
[8]Pan ZG. Mechanism of rhabdomyolysis in patients with severe hearshock[D]. 2012. [潘志国. 重症中暑横纹肌溶解发病及机制研究[D]. 广州中医药大学, 2012.]
[9]Leon LR, Blaha MD, Dubose DA. Time course of cytokine, corticosterone, and tissue injury responses in mice during heatstrain recovery[J]. J Appl Physiol, 2006, 100(4): 1400-1409.
[10]Tong HS, Duan PK, Zhang XQ, et al. Inflammatory activity of endothelial cells activated by intestinal lymph in severe heat stroke[J]. Med J Chin PLA, 2014, 39(10): 791-794. [童华生,段鹏凯, 张兴钦, 等. 重症中暑肠淋巴激活血管内皮细胞炎性活性的研究[J]. 解放军医学杂志, 2014, 39 (10): 791-794.]
[11]Chen CM, Hou CC, Cheng KC, et al. Activated protein C therapy in a rat heat stroke model[J]. Crit Care Med, 2006, 34(7): 1960-1966.
[12]Bouchama A, Roberts G, AI Mohanna F, et al. Inflammatory, hemostatic, and clinical changes in a baboon experimental model for heatstroke[J]. J Appl Physiol, 2005, 98(2): 697-705.
[13]Keuren JF, Baruch D, Legendre P, et al. von Willebrand factor C1C2 domain is involved in platelet adhesion to polymerized fibrin at high shear rate[J]. Blood, 2004, 103(5): 1741-1746.
[14]Masuda T, Sato K, Noda C, et al. Protective effect of urinary trypsin inhibitor on myocardial mitochondria during hemorrhagic shock and reperfusion[J]. Crit Care Med, 2003, 31(7): 1987-1992.
[15]Li N, You SY, Wang CL, et al. The effects of ulinastatin on SP-A in lung injury induced by severe acute pancreatitis in rats[J]. Tianjin Med J, 2013, 41(3): 241-243+290. [李楠, 尤胜义, 王春立, 等. 乌司他丁对大鼠重症急性胰腺炎肺损伤中SP-A的影响[J]. 天津医药, 2013, 41(3): 241-243, 290.]
[16]Liu YF, Wang ZG, Tang HW, et al. Protective effect of ulinastatin on inhalation lung injury caused by black gunpowder smoke in rats and its inhibitory effect on the mRNA expression of IL-1β and TNF-α[J]. Med J Chin PLA, 2014, 39(3): 235-239. [刘一凡, 王正冠, 唐红卫, 等. 乌司他丁对黑火药烟雾所致吸入性肺损伤大鼠的保护作用以及对IL-1β、TNF-α基因表达的抑制作用[J]. 解放军医学杂志, 2014, 39(3): 235-239.]
[17]Wang H, Liu GJ, Hu M. Protective effect of ulinastatin combined with xuebijing on multiple organ function in Patients with sepsis[J]. Chin J Pract Intern Med, 2014, 34(S1): 113-116. [王虹, 刘贵建, 胡敏. 乌司他丁联合血必净对脓毒症患者器官功能的保护作用[J]. 中国实用内科杂志, 2014, 34(S1): 113-116.]
[18]Wu CY, Xiao F, Yu L, et al. Tolerance test of ulinastati[J]. Chin J Clin Pharmacol Ther, 2007(1): 103-106. [吴成义, 肖峰, 干磊, 等. 乌司他丁人体耐受性试验[J]. 中国临床药理学与治疗学, 2007(1): 103-106.]
[19]Jing BW. Progress of the clinical application of ulinastati on the critical illness[J]. Chin Crit Care Med, 2006, 18(2): 117-120.[景炳文. 乌司他丁在急危重症临床应用的进展[J]. 中国危重病急救医学, 2006, 18(2): 117-120.]
Influence of ulinastatin on the proliferation of vascular endothelial cells and IL-6 and TNF-α release under heat stress
PAN Zhi-guo1, SHAO Yu2, GENG Yan1, CHEN Jing-he3, SU Lei1*1Department of Intensive Care Unit, The Military Key Laboratory of Trauma Care in Hot Zone and Tissue Repair in PLA,2Department of Overseas Chinese, Guangzhou General Hospital of Guangzhou Command, Guangzhou 510010, China
3Department of Internal Medicine, First Hospital Affiliated to Guangzhou University of Chinese Medicine, Guangzhou 510405, China
*
, E-mail: slei_icu@163.com
This work was supported by the “Twelfth-Five Year” Plan Key Projects of Military Medicine Science and Technology Development (BWS12J018) and Science and Technology Plan of Guangdong Province (2013B031800010)
ObjectiveTo explore the influence of ulinastatin on the proliferation of vascular endothelial cells and release of IL-6 and TNF-α under heat stress.MethodsHUVEC cells were divided into control, and ulinastatin of different dosage groups (1000, 2000, 3000, 4000, 5000, 6000, 7000U/ml), and CCK-8 assay was used to investigate the influence of ulinastatin on the proliferation of vascular endothelial cells. HUVEC cells were also divided into control, 43℃ heat stress, and 43℃ heat stress plus ulinastatin groups. ELISA assay was used to determine the effect of ulinastatin on the release of IL-6 and TNF-α.ResultsAll the above mentioned doses of ulinastatin showed no significant inhibitory effect on proliferation of HUVEC cells (P>0.05). ELISA results showed that, compared with control group and 43℃ heat-stress group, both the IL-6 and TNF-α releases were decreased at 0h in treatment group with ulinastatin (P<0.05). The IL-6 and TNF-α releases were much lower at 6h in the treatment group with ulinastatin than those undergoing 43℃ heat-stress only group (P<0.05).ConclusionsVarious doses of ulinastatin have no effect on proliferation of endothelial cells. However, it can inhibit the IL-6 and TNF-α releases from HUEVC cells under heat stress.
ulinastatin; heat stroke; endothelial cell; cell proliferation
R594.12
A
0577-7402(2015)05-0362-04
10.11855/j.issn.0577-7402.2015.05.06
2014-12-14;
2015-04-07)
(责任编辑:熊晓然)
全军医学科学技术研究“十二五”发展计划重点项目(BWS12J018);广东省科技计划(2013B031800010)
潘志国,医学博士,主治医师。主要从事急危重症救治与重症中暑方面的研究
510010 广州 广州军区广州总医院重症医学科、全军热区创伤救治与组织修复重点实验室(潘志国、耿焱、苏磊),华侨科(邵玉);510405 广州 广州中医药大学第一附属医院(陈镜合)
苏磊,E-mail: slei_icu@163.com

