Cre重组酶调控的OVA-HBsAg转基因乙肝模型小鼠的制备及鉴定
李秀梅,刘光泽,陈媚娟,谢勇,孔祥平
Cre重组酶调控的OVA-HBsAg转基因乙肝模型小鼠的制备及鉴定
李秀梅,刘光泽,陈媚娟,谢勇,孔祥平
目的 制备Cre重组酶调控的卵清蛋白(OVA)-HBsAg转基因小鼠,为乙肝的防治提供更好的动物模型。方法 采用原核显微注射方法将线性化的携带OVA-HBsAg基因并带有LoxP位点的质粒注入C57BL/6J×DBA小鼠受精卵的雄原核内,制备受Cre重组酶调控表达的OVA-HBsAg转基因小鼠。将F1代OVA-HBsAg阳性母鼠与本室饲育的Alb-Cre转基因阳性公鼠进行杂交,获得子代小鼠,观察Cre对OVA-HBsAg转基因小鼠HBsAg的诱导表达情况。采用PCR、ELISA和免疫组化方法检测HBsAg基因、Cre基因在转基因小鼠体内的整合及表达情况。结果 共注射受精卵491枚,成活337枚,成活率68.6%。产下F0代小鼠29只,其中PCR阳性4只,外源基因整合率13.8%。目前已传至F4代,F1-F4代PCR阳性率分别为27.5%、32.0%、22.9%、25.0%,ELISA法未检测到血清中HBsAg表达。将F1代OVA-HBsAg阳性母鼠与Alb-Cre阳性公鼠杂交,获得16只子代小鼠,PCR检测Cre基因和HBsAg基因双阳性的子代小鼠有6只,其中2只小鼠血清HBsAg检测为阳性,诱导表达阳性率为33.3%。结论 成功制备出OVA-HBsA转基因小鼠,且可稳定传代,Cre重组酶可以诱导小鼠体内HBsAg的表达。
小鼠,转基因;重组酶类;肝炎,乙型,慢性
乙型肝炎病毒(hepatitis B virus,HBV)感染是全球范围内影响人类健康的重大卫生问题,全球范围内约30%的肝硬化和超过50%的肝癌是由于HBV感染造成的,每年因HBV感染造成的死亡人数约为100万~200万[1-3]。HBV慢性感染的机制至今仍未明确,目前仍缺乏有效的治疗手段[4]。在乙肝相关研究中,乙肝动物模型具有非常重要的地位[5],但目前仍缺乏可用于慢性HBV感染和慢性乙肝研究的具有正常免疫功能的动物模型,客观上影响了相关研究的深入开展[6]。本研究采用原核显微注射方法制备受Cre重组酶调控表达的、非免疫耐受的卵清蛋白(ovalbumin,OVA)-HBsAg转基因小鼠,以期为乙肝防治提供更好的动物模型。
1 材料与方法
1.1 试剂及仪器 携带目的基因OVA-HBsAg的表达载体pCCALL-Anton由中科院生物物理所王盛典教授惠赠。在目的基因OVA-HBsAg上游加入CMV增强子及鸡β-actin启动子,并加入两个同向的LoxP位点,以实现后续Cre酶对其表达的调控(图1A)。目的基因构建成功后,连接入pCCALL2表达质粒(图1B)。KSOM小鼠胚胎培养基购自Millipore公司;孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(HCG)购自宁波第二制药厂;小鼠基因组抽提试剂盒购自Omega公司;Taq酶及PCR相关试剂购自TaKaRa公司;HBsAg ELISA检测试剂盒购自上海科华生物技术有限公司;HBsAg免疫组化检测-抗山羊抗HBsAg多克隆抗体购自Lifespan Biosciences公司;NIKON NT88显微注射操作系统、P-97拉针仪购自美国Sutter Instrument公司。全自动生化仪Cobas c 501购自Roche公司。
1.2 方法
1.2.1 显微注射法制备转基因小鼠 选6~8周龄发育良好的C57BL/6J×DBA母鼠,腹腔注射PMSG 10U,48h后注射HCG 10U促排卵,与C57BL/6J公鼠按1:1合笼,次日清晨检阴栓阳性者为受精卵供体鼠。取受精卵置于KSOM培养基于37℃培养5h,在显微注射仪上将经内切酶Apa Ⅰ作用线性化的pCCALL-Anton注射入受精卵雄性原核内。取注射后存活的受精卵移植到假孕KM母鼠的输卵管内,待其怀孕产仔后,进行检测。

图1 携带目的基因OVA-HBsAg的表达载体pCCALL2-AntonFig.1 Plasmid pCCALL-Anton carrying OVA-HBsAg gene
1.2.2 转基因小鼠的鉴定 剪取约1cm长鼠尾,提取基因组DNA行PCR,检测HBsAg基因片段。上游引物:5'-TAGACTCGTGGTGGACTT-3';下游引物:5'-GATACATAGAGGTTCCTTGAGCAGT-3'。反应条件:94℃ 5min;94℃ 30s、52℃ 30s、72℃40s,35个循环;72℃ 5min。扩增片段318bp。
1.2.3 OVA-HBsA转基因小鼠的繁育、传代扩群为尽快扩群,并使子代小鼠背景趋于一致,OVAHBsAg转基因小鼠首建鼠建成后,与C57BL/6J小鼠杂交进行传代、培育。对所得子代小鼠进行PCR鉴定,并用ELISA法检测HBsAg表达[检测波长450nm,参比波长630nm,吸光度(A)值>0.105为阳性]。PCR条件如1.2.2所述。对PCR阳性鼠,于眼眶后静脉丛采血300μl,37℃放置2h后,3000r/min离心10min,取上清,采用ELISA方法检测HBsAg表达。
1.2.4 OVA-HBsAg转基因小鼠模型目的基因HBsAg的诱导表达 将F1代OVA-HBsAg转基因母鼠与本室饲育的C57BL/6J背景Alb-Cre转基因小鼠公鼠按照2:1的数量比例合笼,随机交配获得子代小鼠。对所获子代小鼠行PCR鉴定Cre基因及HBsAg基因,ELISA法检测HBsAg及HBsAb的表达。采用全自动生化仪检测小鼠血清转氨酶的变化情况。取HBsAg表达阳性小鼠肝脏,置10%甲醛固定12~14h,按常规方法制作组织切片,行免疫组化分析(HBsAg抗体1:500稀释)。PCR检测Cre基因所用引物:上游引物:5'-AGCGATGGATTTCCGTCTCTGG-3';下游引物:5'-AGCTTGCATGATCTCCGGTATTGAA-3'。反应条件95℃ 5min;94℃ 30s、56℃ 30s、72℃30s,30个循环;72℃ 5min。扩增片段272bp。
2 结 果
2.1 转基因小鼠F0代的制备 共注射受精卵491枚,筛选注射后成活的受精卵共337枚,注射成活率68.6%。注射后受精卵共移植假孕雌鼠14只,产下F0代小鼠29只。PCR检测共有4只(13.8%)整合阳性,携带有外源目的基因(图2)。
2.2 OVA-HBsA转基因小鼠中HBsAg的表达及传代稳定性研究 将F0代OVA-HBsAg转基因小鼠与C57BL/6J小鼠杂交进行传代、培育。目前顺利传至F4代,子代PCR阳性率较稳定,分别为27.5%、32.0%、22.9%、25.0%,ELISA法未检测到血清中有HBsAg表达(表1)。随机选取3只PCR阳性鼠肝脏进行HBsAg免疫组化分析,未见阳性表达(图3)。
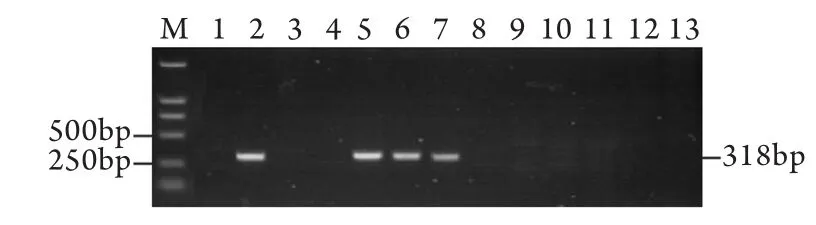
图2 F0代OVA-HBsAg转基因小鼠PCR鉴定Fig.2 PCR detection of F0founder OVA-HBsAg mice
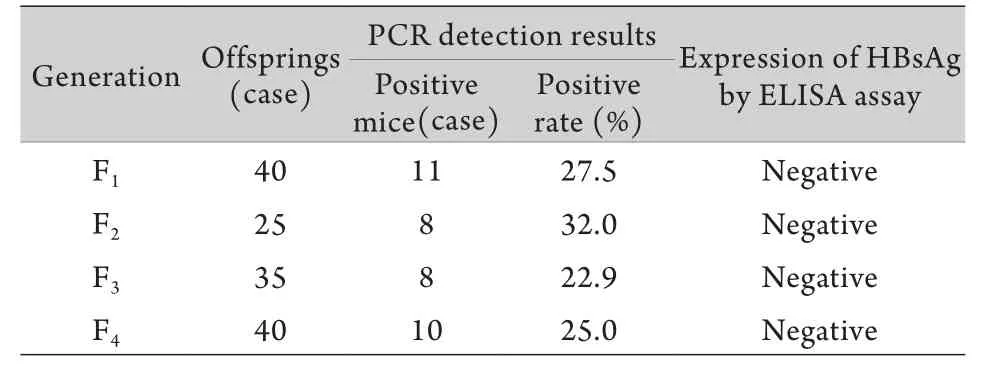
表1 OVA-HBsAg转基因小鼠的传代鉴定Tab.1 Passage detection of OVA-HBsAg transgenic mice

图3 OVA-HBsAg转基因小鼠肝脏HBsAg组化结果(DAB ×400)Fig.3 Immunohistochemical analysis of HBsAg in OVAHBsAg transgenic mice (DAB×400)
2.3 Cre诱导OVA-HBsAg转基因小鼠中HBsAg的表达 将F1代OVA-HBsAg阳性母鼠与Alb-Cre阳性公鼠进行杂交,获得16只子代小鼠。经PCR检测,其中8只小鼠Cre为阳性,阳性率50% (图4A),其中HBsAg PCR阳性6只(图4B)。对上述6只阳性子代小鼠进行HBsAg及HBsAb表达的ELISA检测,结果显示,有2只小鼠血清HBsAg检测为阳性,A值分别为1.203和0.192,HBsAb均为阴性。取上述2只小鼠肝组织行免疫组化检测HBsAg的表达,未见阳性。8只阳性子代小鼠的血清转氨酶均为正常水平。
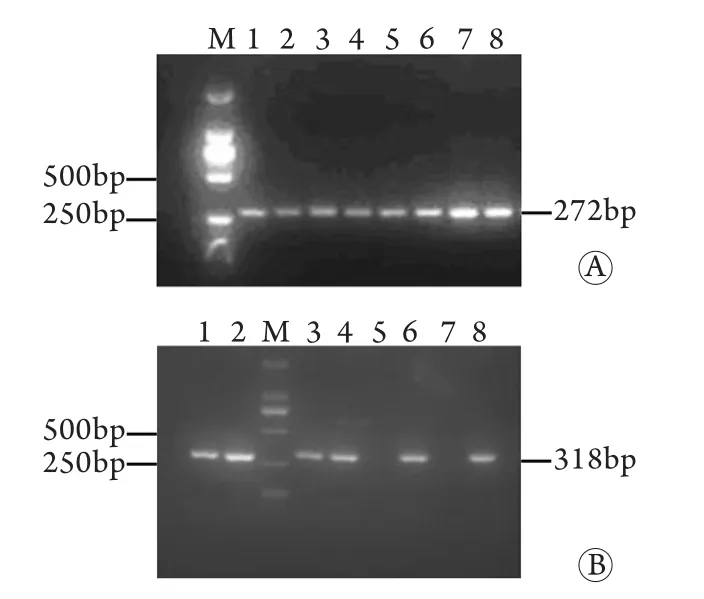
图4 OVA-HBsAg转基因小鼠×Alb-Cre小鼠后代PCR鉴定结果Fig.4 PCR detection of offsprings of OVA-HBsAg transgenic mice×Alb-Cre transgenic mice
3 讨 论
由于遗传和免疫背景清楚、易于饲养等优点,小鼠逐渐成为构建HBV动物模型的最佳选择[6-8]。研究人员建立了人-鼠肝嵌合体HBV小鼠模型、基因转染HBV小鼠模型和HBV转基因小鼠模型。尽管人-鼠肝嵌合体HBV小鼠模型可以说是目前最好的HBV感染复制模型,但由于该模型小鼠不具有免疫功能,不能进行免疫介导的病毒清除和肝炎免疫致病机制的研究[9-10]。基因转染HBV小鼠模型是一过性的HBV复制模型,不适用于慢性HBV感染和慢性乙肝研究。此外,由于注射剂量太大(相当于小鼠全身体液的总量),对小鼠肝脏和其他器官造成的损伤也不能忽视[11]。已有的HBV转基因小鼠目前也存在着明显缺陷。首先,已有的HBV转基因小鼠并非通过被HBV感染的途径建立,因此无法用于进行HBV进入被感染机体和HBV在机体内的分布研究;其次,已有的HBV转基因小鼠对HBV病毒抗原处于免疫耐受状态,机体不能产生对HBV的免疫反应,也不产生乙肝病变[6-7]。以上原因导致可用于慢性HBV感染和慢性乙肝非免疫耐受的动物模型的缺失,客观上影响了相关研究的深入开展。因此,建立可控的、支持HBV体内感染并能导致类似临床乙肝病变的非免疫耐受的HBV小鼠模型成为深入了解乙肝发病机制、肝脏病变的发展和转归机制、抗乙肝药物的研发及评价新的乙肝免疫疗法的关键因素。
本研究通过构建携带有OVA-HBsAg基因,并带有LoxP位点的质粒,采取原核显微注射的方法制备出受Cre重组酶调控表达的、非免疫耐受的OVA-HBsAg转基因小鼠,且可稳定传代。这一模型具有与传统的转基因小鼠不同的特点[12-13]:一是该模型只有在Cre重组酶的作用下,转入小鼠体内的HBsAg才能表达,因此其体内的免疫系统对于HBsAg是非耐受的,从而可以真实、全面地反映临床乙肝发生、发展的过程,为进一步研究HBV的致病机制、HBsAg感染后机体的病理改变以及机体免疫系统在抗病毒感染和免疫致病过程中的作用机制提供理想的动物模型。二是通过本研究制备的HBV小鼠模型,还可以通过Cre重组酶调控OT-Ⅰ表位(由OVA 257-264位氨基酸残基组成)、OT-Ⅱ表位(由OVA 323-339位氨基酸残基组成)的表达。而OT-Ⅰ,OT-Ⅱ T细胞的受体(TCR)可特异识别MHCⅠ类分子和MHC Ⅱ类分子提呈的这两个OVA抗原表位,进而引起特异性T细胞增殖,启动机体针对HBsAg的免疫应答反应,进而抑制或清除机体内的HBsAg,这将可能成为一种控制HBV感染的有效途径,为乙肝的免疫治疗提供新的方向和思路。
目前的研究还存在的问题是制备出的OVAHBsAg转基因小鼠与Cre小鼠杂交后代HBsAg表达率较低,6只Cre和HBsAg PCR检测双阳性的子代小鼠仅有2只检测出血清HBsAg阳性,且这两只小鼠的肝组织免疫组化未观察到HBsAg阳性。我们分析可能的原因:一是外源基因表达沉默。外源基因沉默机制主要与位置效应(整合到异染色质区)、外源基因的表观遗传学修饰(DNA甲基化和组蛋白乙酰化)和遗传效率(外源基因的整合形式)相关,而这3个因素又由外源基因整合位点决定[14-15]。本研究采用原核显微注射方法制备得到的转基因小鼠中,外源基因是随机整合到染色体上的,所以可能是由于整合位点的不合适影响了基因表达。二是Cre重组酶的表达不可控。本研究中HBsAg的表达严格受到Cre重组酶的调节。如果Cre重组酶不能发挥作用或在取样时尚未发挥作用,HBsAg就不能表达。基于以上考虑,下一步我们将通过外源基因的定点整合及对Cre重组酶的表达进行调控来对模型进行改进。
[1]Scaglione SJ, Lok AS. Effectiveness of hepatitis B treatment in clinical practice[J]. Gastroenterology, 2012, 142(6): 1360-1368.
[2]Dandri M, Locarnini S. New insight in the pathobiology of hepatitis B virus infection[J]. Gut, 2012, 61(Suppl 1): 16-17.
[3]Chen DD, Liu Y, Ji XH, et al. A case-control study on influencing factors of primary hepatic carcinoma[J]. J Zhengzhou Univ (Med Sci), 2013, 48(2): 249-253. [陈丹丹, 刘媛, 姬旭慧, 等. 原发性肝癌发病影响因素的病例对照研究[J]. 郑州大学学报(医学版), 2013, 48(2): 249-253.]
[4]Yang XK, Xu GS. Efficacy of glucocorticoid in treatment of HBV-related hepatic failure: a meta-analysis[J]. Med J Chin PLA, 2013, 38(7): 581-585. [杨晓鲲, 徐贵森. 糖皮质激素治疗乙型肝炎病毒相关性肝衰竭疗效的Meta分析[J]. 解放军医学杂志, 2013, 38(7): 581-585.]
[5]Zang LM, Wu XW, Zhao XJ, et al. Establishment of a standardized duck hepatitis B virus model using Henan Cherry Valley ducks in vivo[J]. J Zhengzhou Univ (Med Sci), 2013, 48(6): 732-735. [臧利敏, 吴学炜, 赵雪杰, 等. 后天感染河南樱桃谷鸭乙型肝炎病毒模型的建立[J]. 郑州大学学报(医学版), 2013, 48(6): 732-735.]
[6]Dandri M, Lütgehetmann M, Petersen J. Experimental models and therapeutic approaches for HBV[J]. Semin Immunopathol, 2013, 35(1): 7-21.
[7]Chayama K, Hayes CN, Hiraga N, et al. Animal model for study of human hepatitis viruses[J]. J Gastroenterol Hepatol, 2011, 26(1): 13-18.
[8]Chen MJ, You YQ, Liu GZ, et al. Preparation and identification of 1.3 copies C-type HBV transgenic mice[J]. Med J Chin PLA, 2011, 36(9): 967-969. [陈媚娟, 尤玉琴, 刘光泽, 等. 1.3拷贝C基因型HBV转基因小鼠的制备及检测[J]. 解放军医学杂志, 2011, 36(9): 967-969.]
[9]Bissig KD, Wieland SF, Tran P, et al. Human liver chimeric mice provide a model for hepatitis B and C virus infection and treatment[J]. J Clin Invest, 2010, 120(3): 924-930.
[10]Dandri M, Petersen J. Chimeric mouse model of hepatitis B virus infection[J]. J Hepatol, 2012, 56(2): 493-495.
[11]Li L, Shen H, Li A, et al. Inhibition of hepatitis B virus (HBV) gene expression and replication by HBx gene silencing in a hydrodynamic injection mouse model with a new clone of HBV genotype B[J]. Virol J, 2013, 10: 214.
[12]Peacey M, Wilson S, Perret R, et al. Virus-like particles from rabbit hemorrhagic disease virus can induce an anti-tumor response[J]. Vaccine, 2008, 26(42): 5334-5337.
[13]Barnden MJ, Allison J, Heath WR, et al. Defective TCR expression in transgenic mice constructed using cDNA-based alpha- and beta-chain genes under the control of heterologous regulatory elements[J]. Immunol Cell Biol, 1998, 76(1): 34-40.
[14]Kong QR, Liu ZH. Inheritance and expression stability of transgene in transgenic animals[J]. 2011, 33(5): 504-511. [孔庆然, 刘忠华. 外源基因在转基因动物中遗传和表达的稳定性[J]. 遗传, 2011, 33(5): 504-511.]
[15]Ohtsuka M, Miura H, Sato M, et al. PITT: pronuclear injectionbased targeted transgenesis, a reliable transgene expression method in mice[J]. Exp Anim, 2012, 61(5): 489-502.
Establishment and identification of OVA-HBsAg transgenic mice regulated by Cre recombinase
LI Xiu-mei, LIU Guang-ze, CHEN Mei-juan, XIE Yong, KONG Xiang-ping
Centre of Liver Disease, Transgenic Animal Key Lab, 458 Hospital of PLA, Guangzhou 510600, China
This work was supported by the Science and Technology Project of Guangzhou (201510010004)
ObjectiveTo breed OVA-HBsAg transgenic mice regulated by Cre recombinase in order to provide a better animal model for the study of HBV prevention and therapy.MethodsThe OVA-HBsAg transgenic mice were generated by microinjection of OVA-HBsAg gene with LoxP sites into the pronucleus of C57BL/6J×DBA zygotes. Pups of F1OVA-HBsAg female mice cross-fertilized with Alb-Cre male mice were assayed for the expression of HBsAg induced by Cre recombinase. PCR, ELISA and immunohistochemical methods were used to detect the integration and expression of HBsAg gene and Cre gene in the transgenic mice.Results491 fertilized eggs were injected and a total of 337 survived. The survival rate of injection was 68.6%. 29 F0pups were produced with 4 PCR-positive mice, and the positive rate was 13.8%. Up to now, F4pups were obtained. The positive rates from F1to F4were 27.5%, 32.0%, 22.9% and 25.0%, respectively. No HBsAg-positive mice were found among these pups. Furthermore, among 16 pups of F1OVA-HBsAg female mice crossed with Alb-Cre male mice, 6 were positive for both HBsAg and Cre as detected by PCR. There were 2 pups showed positive HBsAg by ELISA assay. The expression rate of HBsAg after Cre recombinase induction was 33.3%.ConclusionOVA-HBsAg transgenic mice has been reproduced successfully, and it can be stably passaged. Cre recombinase can induce the expression of HBsAg in vivo.
mice, transgenic; recombinases; hepatitis B, chronic
R512.62
A
0577-7402(2015)05-0372-04
10.11855/j.issn.0577-7402.2015.05.08
2014-09-15;
2014-11-03)
(责任编辑:熊晓然)
广州市科技计划项目(201510010004)
李秀梅,主治医师。主要从事乙肝转基因动物的研究及抗乙肝药物评价
510600 广州 解放军458医院全军肝病中心、全军转基因动物重点实验室(李秀梅、刘光泽、陈媚娟、谢勇、孔祥平)

