rhKGF、CBLB502和WR2721对放射性口腔黏膜炎的防治效果观察
杨超,王丽梅,崔宇,徐铁柱,赵致维,李中堂,王俊可,善亚君,柳晓兰,唐红卫,从玉文
rhKGF、CBLB502和WR2721对放射性口腔黏膜炎的防治效果观察
杨超,王丽梅,崔宇,徐铁柱,赵致维,李中堂,王俊可,善亚君,柳晓兰,唐红卫,从玉文
目的 比较rhKGF、CBLB502、WR2721对放射性口腔黏膜炎(ROM)的防治作用。方法 健康雄性C57BL/6J小鼠随机分为正常对照组、照射对照组、rhKGF组、CBLB502组及WR2721组。其中24只小鼠观察17Gy头颈部照射小鼠的30d存活率及体重变化,另外20只小鼠利用1%甲苯胺蓝染色法观察照射小鼠舌组织溃疡情况,HE染色观察舌组织病理学改变,Ki-67免疫组化检测黏膜角化上皮细胞增殖情况。结果 与照射对照组相比,rhKGF和WR2721给药组小鼠30d存活率显著提高,体重恢复较快,角化上皮细胞增殖显著,未发生明显的口腔黏膜炎;CBLB502组小鼠的存活率、体重变化及组织病理学指标与照射对照组比较差异无统计学意义(P>0.05)。结论 rhKGF和WR2721对放射性口腔黏膜炎有较好的防治作用,而CBLB502并不能减轻放射性口腔黏膜炎的发生。
辐射损伤,实验性;辐射防护剂;成纤维细胞生长因子7;鞭毛蛋白;氨磷汀
放射性口腔黏膜炎(radiation-induced oral mucositis,ROM)是指电离辐射引起的急慢性口腔黏膜损伤。它是头颈部肿瘤放射治疗的常见副作用[1-2],严重时可影响原发病的治疗,降低患者生活质量,甚至造成死亡。因此,ROM是头颈部恶性肿瘤放射治疗的主要剂量限制因素,并成为临床亟待解决的重要问题。角质细胞生长因子(keratinocyte growth factor,KGF)属于成纤维细胞生长因子(fibroblast growth factor,FGF)家族,又称FGF-7,可与FGF受体(FGFR)的亚型FGFR2-Ⅲb特异性结合,通过旁分泌方式作用于多种上皮细胞(如角化细胞、小肠上皮细胞和肝细胞等)[3-4]。KGF的功能包括增强上皮细胞的丝裂原活性、促进角化细胞的分化与增殖、促进上皮细胞迁移、抗凋亡及细胞保护作用等[4-5]。2004年帕利夫明(重组人角质细胞生长因子,rhKGF)被美国FDA批准上市用于恶性血液肿瘤患者接受造血干细胞移植并发口腔黏膜炎的治疗[6]。CBLB502是一种细菌鞭毛优化衍生的重组蛋白,作为Toll样受体的专一性激动剂,是美军重点研制的候选抗放药物之一,对放射性肺炎、放射性肺纤维化均有良好的防护效果[7]。最近有文献报道CBLB502能减轻小鼠头颈部单次照射引起的口腔黏膜炎,并加快受照组织的恢复[8]。氨磷汀(WR2721)是一种有机的硫代磷酸盐,可清除辐射诱导产生的自由基,降低头颈部肿瘤患者接受放化疗或单独放疗后口腔干燥症的发生率,但其对于口腔黏膜炎的防治作用目前存在一定争议[9]。
本研究采用17Gy小鼠头颈部照射模型系统比较了rhKGF、CBLB502和WR2721对放射性口腔黏膜炎的防治效果并探讨其作用机制,为临床防治放射性口腔黏膜炎以及相关新药的研发提供实验依据。
1 材料与方法
1.1 实验动物及分组 SPF级C57BL/6J雄性小鼠50只,体重22~24g,购自北京华阜康生物科技股份有限公司,动物质量合格证号SCXK(京)2009-0004,动物饲养设施合格证号SYXK-(军)-2007-004。小鼠饲养7d后随机分为正常对照组、照射对照(IR)组、rhKGF组、CBLB502组及WR2721组,每组10只。
1.2 主要试剂及仪器 rhKGF冻干粉(批号:141116)购自成都美兮生物技术有限公司。CBLB502由军事医学科学院放射与辐射医学研究所葛常辉副研究员馈赠。WR2721(批号:20120921)购自军事医学科学院。1%甲苯胺蓝溶液购自北京雷根生物技术有限公司。小鼠Ki-67抗体(批号:D3B5)购自美国Cell Signaling公司。KD-TS1A型生物组织自动脱水机,KD-BM、BL生物组织冷冻包埋机,KD-P型电脑生物组织摊片机及KD-P型电脑生物组织烘片机购自浙江省金华市科迪仪器设备有限公司。RM2235型轮转式切片机购自德国Leica公司。DP72型荧光倒置显微镜购自日本Olympus公司。
1.3 处理方法 rhKGF组照射前连续3d和照后24h连续3d腹腔注射6.25kg/mg rhKGF(0.2ml/只)[10],CBLB502组照射前30min腹腔注射0.05mg/kg CBLB502(0.2ml/只)[8],WR2721组照射前30min腹腔注射150mg/kg WR2721(0.2ml/只)[9];照射对照组和正常对照组均由腹腔注射等量生理盐水。组织及病理学观察实验每组4只小鼠,存活率及体重变化观察实验每组各6只小鼠。照射前氯胺酮麻醉小鼠,将鼠仰放入自制照射盒,铅板放置于颈部以下完全屏蔽小鼠其他部位,将鼠舌牵拉出口外,然后接受一次性17Gy头颈部照射,照射剂量率为1.325Gy/ min(电压220kV,电流25mA),每次照射8只。
1.4 存活率和体重变化观察 24只小鼠称重后随机分为照射对照组(IR组)、rhKGF组、CBLB502组和WR2721组(n=6),照射剂量均为17Gy。照射后连续30d观察动物存活数和体重变化,绘制存活曲线和体重变化图。
1.5 舌组织溃疡情况观察 照射后7d颈椎脱臼处死小鼠,取舌组织,先用棉签蘸取1%乙酸涂于舌表面以溶解表面附着的黏液,再用棉签蘸取1%甲苯胺蓝涂抹于舌表面,至少停留1min,然后再用棉签蘸取1%乙酸擦洗已涂甲苯胺蓝部位,拍照观察。
1.6 舌组织病理学观察 甲苯胺蓝染色后的舌组织经10%甲醛固定,石蜡包埋,切成5μm厚的切片,然后在二甲苯中脱蜡,梯度乙醇水合,HE染色,脱水、透明,封固,Olympus DP72显微镜下观察、拍照。用Image Pro Plus 6.0软件测量溃疡长度、上皮厚度(每个舌头随机取10个视野,每个视野取两个点测量)进行定量分析。
1.7 上皮角化细胞增殖情况检测 小鼠舌组织制成5μm厚的切片,经脱蜡水合,放入抗原修复液中,100℃水浴锅加热30min,然后室温冷却30min。PBS漂洗后,3%过氧化氢溶液孵育15min,用含5%山羊血清的TBST封闭1h,加入1:200稀释的Ki-67一抗4℃孵育过夜,PBS漂洗后加入山羊抗兔二抗孵育1h,最后用DAB染色,Olympus DP72显微镜拍照,用Image Pro Plus 6.0软件进行手动采点法计数阳性细胞数并测量整个舌头的周长,进行定量分析。
1.8 统计学处理 采用SPSS 17.0软件进行统计分析。数据结果以±s表示,采用GraphPad Prism 6软件包作图。各组动物存活率采用Mantel log-rank法进行生存分析,溃疡大小和上皮厚度、角化细胞增殖的比较采用单因素方差分析(one-way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 rhKGF、CBLB502、WR2721对17Gy头颈部照射小鼠体重和存活率的影响 小鼠照射后第1~3天摄食无明显变化,从第5天开始每日摄食量减少。各照射组小鼠体重呈缓慢下降趋势,照射对照组和CBLB502组下降尤为明显(图1)。各组小鼠在照射后11d体重下降到最低点,存活小鼠体重约在照射后15d缓慢回升,以rhKGF组和WR2721组恢复最快。照射对照组小鼠照射后第10天开始出现死亡,第12天全部死亡,存活时间为11.0±0.6d。CBLB502组小鼠从照射后第11天开始出现死亡,30d小鼠存活率为16.67%,死亡鼠存活时间13.8±4.5d。rhKGF和CBLB502组小鼠存活率均为100%,与照射对照组相比,差异有统计学意义(P=0.0008,图2)。

图1 rhKGF、CBLB502和WR2721对辐照后小鼠体重的影响Fig. 1 Effect of rhKGF, CBLB502 and WR2721 on the weight of irradiated mice
2.2 rhKGF、CBLB502和WR2721对17Gy头颈部照射小鼠舌部溃疡的影响 甲苯胺蓝染色显示,正常对照组大鼠舌体黏膜呈粉红色,表面湿润、连续、无着色;照射对照组和CBLB502组小鼠照射后舌背出现红色斑点,黏膜下出现充血及肉眼可辨的散在点状溃疡,部分小鼠出现成片溃疡,染色后舌体颜色变深,病损区着色阳性;rhKGF组和WR2721组舌体表面湿润,舌背部有散在红色斑点及黏膜下充血现象,但无明显溃疡,无明显着色,甲苯胺蓝染色阴性(图3)。

图2 rhKGF、CBLB502和WR2721对辐照后小鼠存活率的影响Fig. 2 Effect of rhKGF, CBLB502 and WR2721 on the survival rate of irradiated mice

图3 rhKGF、CBLB502和WR2721对头颈部照射小鼠舌部溃疡的影响(1%甲苯胺蓝染色)Fig. 3 Effert of rhKGF, CBLB502 and WR2721 on tongue ulcer of head and neck irradiated mice (1% toluidine blue stain)
2.3 rhKGF、CBLB502和WR2721对放射性口腔黏膜炎病理变化的影响 HE染色显示,正常对照组大鼠舌黏膜组织的上皮结构完整,可见角化上皮细胞(舌背)、味蕾和非角化上皮(舌腹)等正常结构。照射对照组和CBLB502组舌背部上皮结构完全崩解,鳞状上皮坏死脱落形成溃疡,其下大量炎性细胞浸润,毛细血管扩张充血,胶原纤维断裂,可见较多纤维性渗出覆盖溃疡表面,其内交织有大量炎症渗出细胞,上皮下固有层血管进一步扩张、充血,管壁及上皮变薄,固有层细胞核浓缩。rhKGF组和WR2721组上皮层基本保持完整,偶见散在溃疡点,可见完整的上皮钉突甚至味蕾,出现鳞状上皮增生,基底细胞层增厚,但也有少量炎性细胞浸润,毛细血管扩张充血(图4A)。定量分析发现,rhKGF组和WR2721组溃疡面积小于CBLB502组和照射对照组,差异有统计学意义(P<0.05,图4B),上皮厚度大于CBLB5021组和照射对照组,差异有统计学意义(P<0.01,图4C)。
2.4 rhKGF、CBLB502和WR2721对角化上皮细胞增殖的影响 Ki-67免疫组化染色显示,与正常对照组比较,照射对照组和CBLB502组舌背面的角化上皮细胞增殖不明显,尤其是溃疡创面几乎无角化上皮细胞增殖,而rhKGF组和WR2721组角化上皮细胞增殖明显,增殖的细胞分布在基底部且排列整齐,接近正常对照组(图5A)。定量分析表明,rhKGF组和CBLB502组角化上皮细胞增殖明显多于CBLB502组和照射对照组,差异有统计学意义(P<0.001,图5B)。
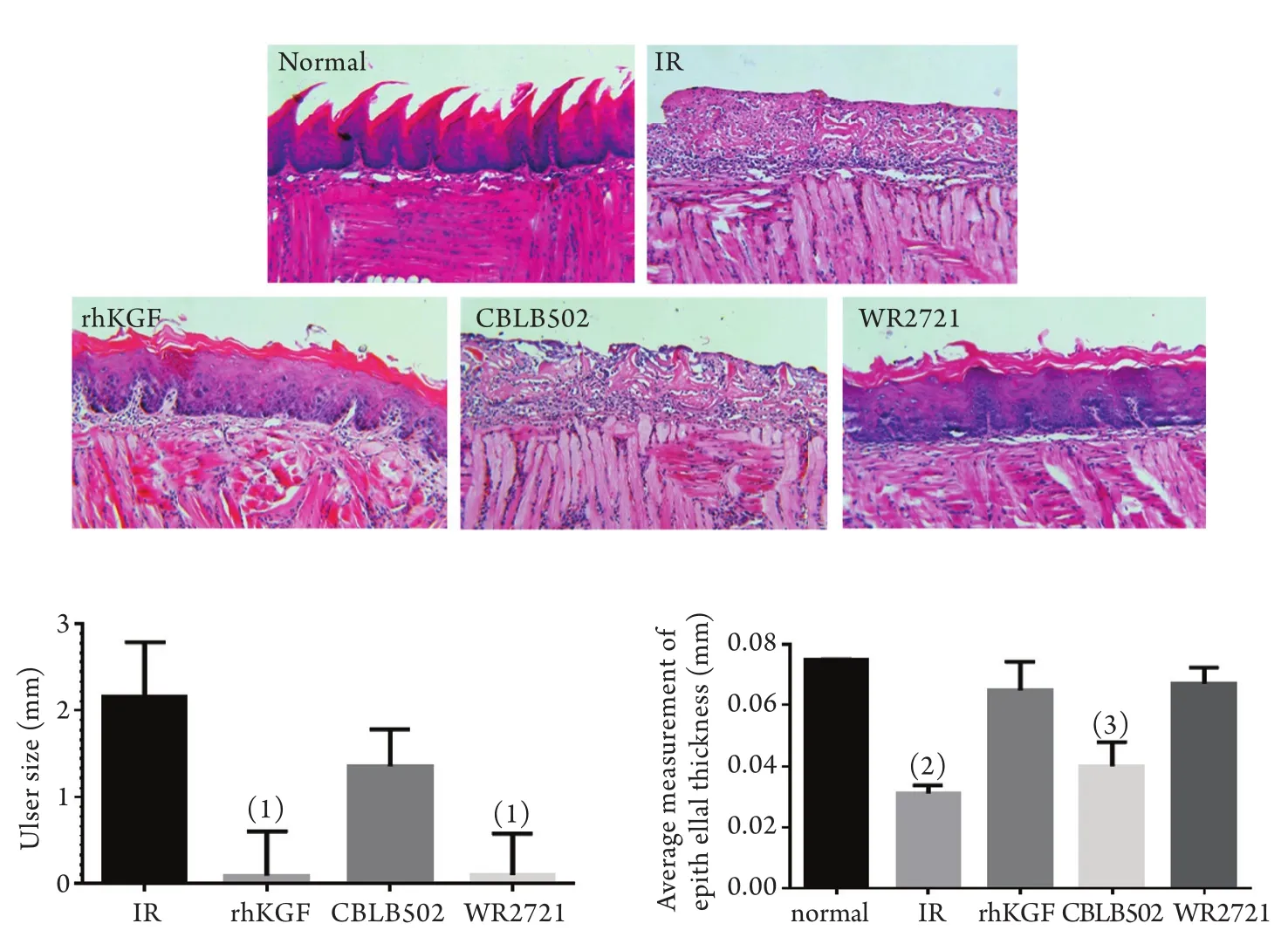
图4 17Gy头颈部照射小鼠照后7d舌黏膜的病理变化Fig. 4 Pathological changes of tongue mucosa of mice 7d after 17Gy head and neck irradiation
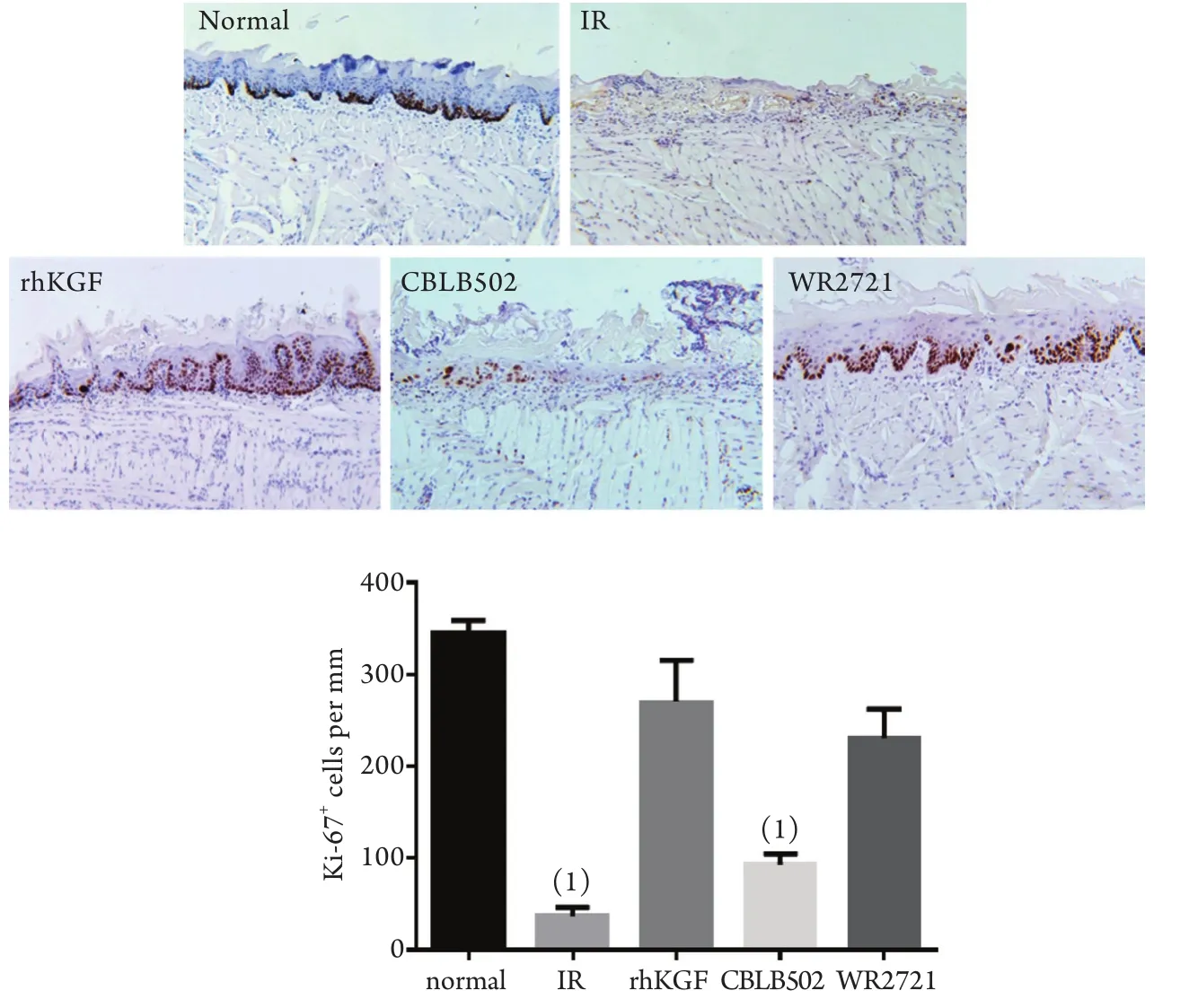
图5 rhKGF、CBLB502和WR2721对角化上皮细胞增殖的影响Fig. 5 Effect of rhKGF, CBLB502 and WR2721 on the proliferation of keratinized epithelial cells
3 讨 论
半个世纪以来,放射性口腔黏膜炎的临床特征及评价手段已取得阶段性的进展。Sonis[11]认为其病理过程可分为起始阶段、初级损伤阶段、信号放大阶段、溃疡形成和愈合五个阶段。本研究结果表明,小鼠经17Gy头颈部照射(IR组)后均出现口腔溃疡,进食量迅速减少,体重明显下降,在照后11d左右全部死亡。rhKGF防治给药以及WR2721预防给药均能显著促进受照小鼠口腔黏膜损伤的恢复,避免严重溃疡的发生,虽然有一过性黏膜下水肿和红斑形成,但小鼠的进食量并无明显减少,体重下降低于照射对照组,并在照后15d迅速回升,存活率显著提高(100%),镜下观察见上皮保持完整,Ki-67免疫组化染色见角化细胞增殖明显,排列整齐,表明其防治效果显著。CBLB502组小鼠照射后均出现口腔溃疡,体重下降明显,与正常对照组比较小鼠存活率没有显著提高,角化细胞增殖不明显,没有体现出较好的辐射防护作用。文献报道,CBLB502能够减轻单次头颈部15Gy或20Gy照射NIH-Swiss雌性小鼠的黏膜炎、加快组织恢复并降低照射后小鼠的体重损失,但是在25Gy照射时无效[8]。Dörr等[12]研究证实,同一近交系动物雌性和雄性在同一剂量照射下诱发的放射性口腔黏膜炎不存在差异,但在不同的种系间存在差异。Burdelya 等[8]研究中应用的NIH-Swiss小鼠与本研究中的C57BL/6J小鼠辐射敏感性可能不同,故CBLB502对放射性口腔黏膜炎的防治作用有待进一步观察。
机体发生损伤反应时,KGF表达上调,这种上调对于损伤上皮的愈合具有重要作用。KGF是调节上皮细胞分化与增殖的重要生长因子,尤其对角化细胞的生长至关重要,而角化细胞又是放射敏感细胞,因此KGF对于辐射后口腔黏膜损伤的修复不可或缺[1,11,13-14]。WR2721在进入人体后,其有效成分WR-1065不被自由基清除,可保护DNA免受损伤,并加速DNA修复,同时WR-1065还可灭活自由基的活性[9,15],从而在辐射损伤的修复中发挥重要作用。
当前口腔黏膜炎研究的热点是如何积极防治癌症患者放疗和化疗后口腔黏膜产生的严重的毒副作用,但是现有的医疗状况是,被认证为专门治疗口腔黏膜炎的药物只有帕利夫明[6],而临床上大多采取姑息支持疗法(除美国以外的大多数地区)。帕利夫明价格昂贵,并能促进上皮来源的肿瘤细胞增殖,对于头颈部肿瘤患者存在增加复发的可能;WR2721用药后产生的低血压、恶心、呕吐等副作用和用药成本使其应用推广受限[5]。因此,对于绝大多数高危患者,口腔黏膜炎的防治缺乏有效手段。以后仍需要进一步了解口腔黏膜炎发生、发展的机制,揭示其干预靶点,最终目标是能够预测毒性风险,并进行基于患者的个性化干预。
[1]Sonis ST. Efficacy of palifermin (keratinocyte growth factor-1) in the amelioration of oral mucositis[J]. Core Evidm, 2010, 12(4): 199-205.
[2]Vagliano L, Feraut C, Gobetto G, et al. Incidence and severity of oral mucositis in patients undergoing haematopoietic SCT--results of a multicentre study[J]. Bone Marrow Transplant, 2011, 12(46): 727-732.
[3]Xue P, Zhu XJ, Liu XJ, et al. Expression of recombinant truncated human keratinocyte growth factor 1 in insect cells[J]. J Jilin Univ (Med Ed), 2012, 38(4): 633-639. [薛萍, 朱小静, 刘孝菊, 等. 重组截短型人角质细胞生长因子1在昆虫细胞中的表达[J]. 吉林大学学报(医学版), 2012, 38(4): 633-639.]
[4]Yen TT, Thao DT, Thuoc TL. An overview on keratinocyte growth factor: from the molecular properties to clinical applications[J]. Protein Pept Lett, 2014, 21(3): 306-317.
[5]Raffa S, Leone L, Scrofani C, et al. Cholesteatoma-associated fibroblasts modulate epithelial growth and differentiation through KGF/FGF7 secretion[J]. Histochem Cell Biol, 2012, 138(2): 251-269.
[6]Yuan A, Sonis S. Emerging therapies for the prevention and treatment of oral mucositis[J]. Expert Opin Emerg Drugs, 2014, 19(3): 343-351.
[7]Wang ZD, Qiao YL, Tian XF, et al. Toll-like receptor 5 agonism protects mice from radiation pneumonitis and pulmonary fibrosis[J]. Asian Pac J Cancer Prev, 2012, 13(9): 4763-4767.
[8]Burdelya LG, Gleiberman AS, Toshkov I, et al. Toll-like receptor 5 agonist protects mice from dermatitis and oral mucositis caused by local radiation: implications for head-and-neck cancer radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 228-234.
[9]Nicolatou-Galitis O, Sarri T, Bowen J, et al. Systematic review of amifostine for the management of oral mucositis in cancer patients[J]. Support Care Cancer, 2013, 11(21): 357-364.
[10]Han G, Bian L, Li F, et al. Preventive and therapeutic effects of Smad7 on radiation-induced oral mucositis[J]. Nat Med, 2013, 19(4): 421-428.
[11]Sonis ST. New thoughts on the initiation of mucesitis[J]. Oral Dis, 2010, 16(7): 597-600.
[12]Dörr W, Spekl K, Martin M. Radiation-induced oral mucositis in Mice: strain differences[J]. Cell Prolif, 2002, 35 Suppl 1:60-67.
[13]Wu HG, Song SY, Kim YS, et al. Therapeutic effect of recombinant human epidermal growth factor (RhEGF) on mucositis in patients undergoing radiotherapy, with or without chemotherapy, for head and neck cancer: a double-blind placebo-controlled prospective phase 2 multi-institutional clinical trial[J]. Cancer, 2009, 21(115): 3699-3708.
[14]Weigelt C, Haas R, Kobbe G. Pharmacokinetic evaluation of palifermin for mucosal protection from chemotherapy and radiation[J]. Expert Opin Drug Metab Toxicol, 2011, 11(7): 505-515.
[15]Chen C, Tian L, Zhang M, et al. Protective effect of amifostine on high-dose methotrexate-induced small intestinal mucositis in mice[J]. Dig Dis Sci, 2013, 58(11): 3134-3143.
Comparative study of the effects of rhKGF, CBLB502 and WR2721 on radiation-induced oral mucositis
YANG Chao1, WANG Li-mei2, CUI Yu2, XU Tie-zhu2, ZHAO Zhi-wei3, LI Zhong-tang2, WANG Jun-ke2, SHAN Ya-jun2, LIU Xiao-lan2, TANG Hong-wei3*, CONG Yu-wen2*1School of Postgraduate, Xinxiang Medical College, Xinxiang, Henan 453003, China
2Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
3Department of Gastroenterology, Armed Police General Hospital, Beijing 100390, China
*
. TANG Hong-wei, E-mail: thwwjp@hotmail.com; CONG Yu-wen, E-mail: congyw@nic.bmi.ac.cn
ObjectiveTo compare the protective effect of rhKGF, CBLB502 and WR2721 on radiation-induced oral mucositis (ROM).MethodsFifty male 6-8-week-old C57BL/6J mice were randomly divided into normal group, irradiation control group, rhKGF group, CBLB502 group, and WR2721 group (n=10 each). The 30-day survival rate and change in body weight of mice that had
17Gy irradiation of head and neck area were recorded. In another group of 20 mice, 1% toluidine blue staining and HE staining were used to observe oral ulcers and pathological changes in the tongue tissue. The proliferation of keratinocyte cells was assessed by Ki-67 immunohistochemistry.ResultsCompared with the irradiation control group, administration of rhKGF and WR2721 could significantly improve the 30-day survival rate, accelerate the recovery of body weight, and promote the proliferation of keratinized epithelial cells of mice after irradiation, without inducing obvious oral mucositis. However, There was no significant difference between CBLB502 group and irradiation control group in survival rate, body weight and pathological changes in tongue tissues of mice.ConclusionrhKGF and WR2721 could alleviate ROM and improve the survival of mice, while CBLB502 has no such effect.
radiation injuries, experimental; radiation-protective agents; fibroblast growth factor 7; flagellin; amifostine
R818.898
A
0577-7402(2015)05-0420-05
10.11855/j.issn.0577-7402.2015.05.19
2015-01-20;
2015-03-29)
(责任编辑:李恩江)
杨超,硕士研究生。主要从事急性放射病发病机制方面的研究
453003 河南新乡 新乡医学院研究生院(杨超);100850 北京 军事医学科学院放射与辐射医学研究所(王丽梅、崔宇、徐铁柱、李中堂、王俊可、善亚君、柳晓兰、从玉文);100390 北京 武警总医院消化内科 (赵致维、唐红卫)
唐红卫,E-mail:thwwjp@hotmail.com;从玉文,E-mail:congyw@163.com

