载VEGFR-3抗体淋巴管靶向微泡的体外寻靶试验研究
杨阳,朱梅Δ,刘政,章晓锋,严飞,赵溪岩
(1.昆明医科大学第一附属医院 超声科/云南省超声影像研究中心,云南 昆明 650032;2.第三军医大学新桥医院 超声科,重庆 400037; 3.中国科学院 深圳先进技术院,广东 深圳 518055;4.海南医学院 机能实验室,海南 海口 571199)
载VEGFR-3抗体淋巴管靶向微泡的体外寻靶试验研究
杨阳1,朱梅1Δ,刘政2,章晓锋1,严飞3,赵溪岩4
(1.昆明医科大学第一附属医院 超声科/云南省超声影像研究中心,云南 昆明 650032;2.第三军医大学新桥医院 超声科,重庆 400037; 3.中国科学院 深圳先进技术院,广东 深圳 518055;4.海南医学院 机能实验室,海南 海口 571199)
目的 制备载VEGFR-3抗体的淋巴管靶向微泡,观察体外寻靶效果。方法 采用生物素-亲和素桥接法制备载VEGFR-3抗体靶向微泡,进行体外寻靶实验,采用分组对照实验以直接、间接法观察寻靶效果。直接法使用图像分析软件IPP进行离线分析及采用SPSS软件包进行统计学分析;间接法采用分组孵育、离心法直观观察靶向结合效果。结果 图像软件IPP离线分析结果显示靶向组微泡与淋巴管内皮细胞结合数量明显多于普通组;高倍显微镜下(×100倍)靶向组平均每个视野有(151±20)个靶向微泡粘附,普通组平均每个视野有(12±4)个普通微泡粘附,靶向组与普通组微泡结合数量差异有统计学意义(t=19.19,P<0.01)。间接观察法结果显示:与普通组相比,靶向组中靶向微泡与细胞能逐步牢固的结合。结论 制备的载VEGFR-3抗体淋巴管靶向微泡体外寻靶效果明显优于普通微泡。
VEGFR-3抗体;微泡;寻靶;体外实验
目前,靶向超声造影已成为一种能靶向显影特定区域肿瘤的影像学方法[1-2]。相比普通的超声造影剂,携载配体的靶向超声造影剂能以抗原抗体的方式,靶向到特定的肿瘤区域,大量的聚集、长时间的停留在靶区,以此可获得良好的超声增强显影效果[3-4]。
研究表明在肿瘤组织中,肿瘤周边新生淋巴管、扩张的淋巴管、有癌栓的淋巴管和有肿瘤转移淋巴结内淋巴管的内皮细胞中VEGFR-3呈高表达[5]。基于此,设想在培养皿中接种肿瘤新生淋巴管内皮细胞,以VEGFR-3作为靶点,制备载VEGFR-3抗体的靶向微泡,进行分组对照实验,以直接、间接法观察寻靶效果,并做相关图像分析,以期为下一步在体内淋巴管显影提供理论基础和依据。
1 材料与方法
1.1 材料和主要仪器
雄性Wistar大鼠,5~7周龄,体质量200g左右,购自北京维通利华,动物合格证号:,SCXK(京)2014-0004。
自制生物素化脂质微泡(第三军医大学),生物素化VEGFE-3抗体(eBioscience,美国),亲和素、细胞膜染料DII(Sigma,美国),细胞培养皿(Corning,美国)。
倒置显微镜(Leica-DMI3000B,德国),台式高速冷冻离心机(RHERMO-STRATOS,德国),微泡机械震荡仪(威尔德-DZ2014,深圳)。
1.2 方法
1.2.1 生物素化脂质微泡的制备:把一定量的二棕榈酰磷脂酰胆碱(DPPC),二棕榈酰磷脂酰乙醇胺(MPEG200),二棕榈酰磷脂酸(DPPA),聚乙二醇(PEG400),生物素化脂质(DSPE-PEG2000-Biotin)等按一定比例充分混悬后分装于3 mL的西林瓶中,按设定好的冻干工艺程序进行冷冻干燥,制备脂质冻干粉,并以全氟丙烷置换其中的空气,加入溶酶液,按特定程序机械振荡仪充分混悬,制备生物素化微泡。
1.2.2 生物素-亲和素桥接法制备靶向微泡:取制备好的生物素化微泡用PBS稀释至1×107/mL,取500 μL加入亲和素50 μg,充分混合,室温孵育30 min,400 g条件下离心3 min,弃下清液,加入等量PBS,重复3次,以1:100的比例加入生物素化的VEGFE-3抗体室温孵育30 min,400 g条件下离心3 min,弃下清液,加入等量PBS,重复3次,得到载VEGFR-3抗体的靶向微泡。
1.2.3 小鼠胸导管淋巴内皮细胞的分离和培养:采用胸导管内灌注酶消化分离法。取雄性Wistar大鼠,体视显微镜下小心分离胸导管,灌注胰酶消化。收集到的溶液1500 r/min离心3 min,将分离的细胞进行传代培养,通过检测因子Ⅷ相关抗原对细胞进行鉴定,将第三代细胞分别接种于培养皿与细胞培养瓶中,24 h贴壁后待用。
1.2.4 靶向微泡与普通微泡分组体外寻靶对照实验:选取6个细胞生长情况相近的培养皿,随机平均分为靶向组与普通组,分别取0.5 mL,浓度为1×109个/mL的靶向微泡与普通微泡分别缓慢注入培养皿中,轻微震荡,使微泡均匀混合于培养液中,静置5 min,以PBS冲洗3次,至显微镜下(×100倍)进行观察,使用图像分析软件(Image pro plus,IPP)进行离线图像分析;2组分别选取20个不同视野,对与细胞结合的微泡进行计数, 每个视野重复测量3次,每次测量由不同人员进行。
1.2.5 DII染色细胞混悬液的制备:选取细胞生长状态较好的细胞培养瓶,胰酶消化贴壁细胞,使之游离,加入完全培养基终止消化,移入15 mL离心管中,1500 r/min 离心3 min,弃上清液备用;称取10 μg DII染料溶于1 mL无水乙醇中,待充分溶解后加入离心管中,与细胞混匀,待细胞着色后,1500 r/min 离心3 min,弃上层液体,PBS涮洗3次,加入完全培养液调整细胞浓度至0.2×109/mL。
1.2.6 靶向微泡与普通微泡结合间接对照寻靶实验:以染色细胞与微泡1:20的比例,将0.5 mL,1×109/mL细胞混悬液分别加入到2支15 mL离心管中,随机标记为靶向组与普通组,分别向两支离心管中缓慢加入2 mL,1×109/mL靶向微泡与普通微泡,轻微振荡孵育10 min,1500 r/min 离心3 min,肉眼观察结合效果。

2 结果
2.1 微镜下和图像分析软件对2组微泡的分析结果 显微镜下观察,靶向组大量微泡粘附于细胞上,PBS冲洗后,仅游离微泡被洗掉,粘附于细胞的靶向微泡基本无变化;普通组微泡在PBS冲洗后几乎消失于整个视野中。使用图像分析软件IPP离线分析后,软件自动标记的微泡(红色),靶向组与结合的微泡数量远高于普通组。见图1。
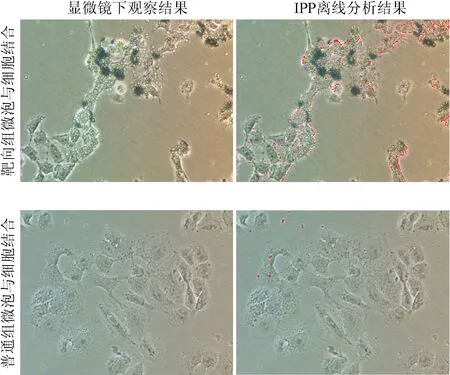
图1 显微镜下和图像分析软件IPP离线分析图像(×100)Fig.1 Off-line analysis by image analysis software IPP under microscope(×100)
显微镜下靶向组平均每个视野有(151±20)个靶向微泡粘附,普通组平均每个视野有(12±4)个普通微泡粘附,靶向组与普通组微泡结合数量比较差异有统计学意义(t=19.186,P<0.01),见图2。

图2 靶向组、普通组与细胞结合的微泡数量比较Fig.2 Comparison of combining microbubbles between targeted-group and ordinar-group
2.3 间接法观察靶向组、普通组与染色细胞结合结果 间接观察法中,起初2组并无明显差异,见图3A。振荡孵育3 min后,靶向组中白色靶向微泡与紫红色细胞2者颜色开始混合,染色细胞开始出现在白色微泡层中;而普通组中并无颜色混合,少量紫红色细胞开始沉淀于离心管底部,见图3B。振荡孵育10 min后,靶向组紫红色细胞几乎全位于白色微泡层;普通组紫红色细胞更多的沉淀于管底,见图3C。离心后,靶向组紫红色细胞位于白色微泡层,管底几乎不见染色细胞;普通组白色微泡层不见紫红色,管底可见与实验开始时等量的染色细胞沉淀见图3D。间接证明靶向组中靶向微泡与细胞能逐步牢固的结合,并在1500 r/min,离心3 min条件下仍能保证稳固的结合效果,而普通组中细胞在上述离心力下,几乎全部沉于管底。
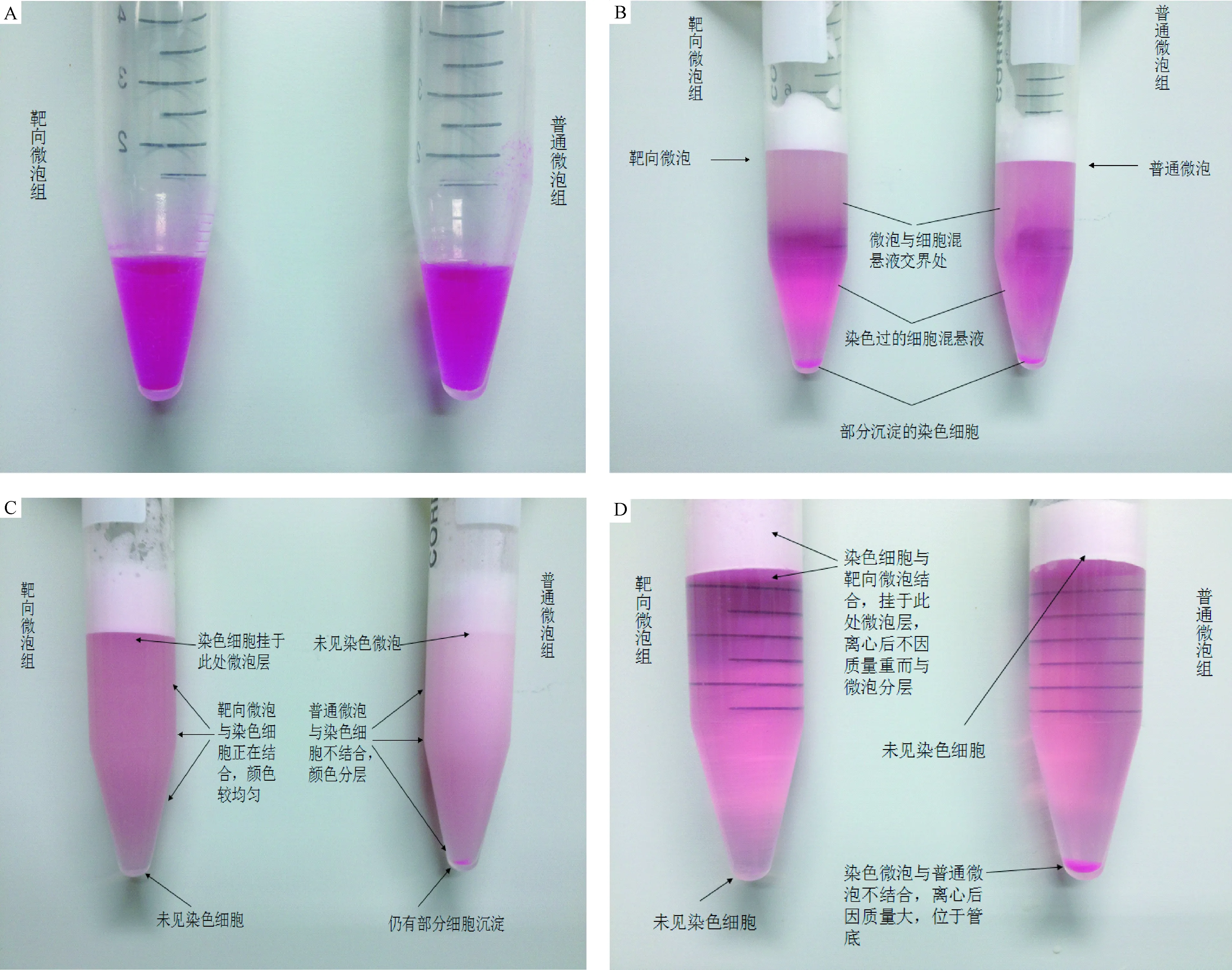
图3 间接法观察靶向组、普通组与染色细胞结合效果比较A.染色细胞混悬液;B.分别向两组加入靶向、普通微泡;C.振荡孵育10 min后效果;D.1500 r/m,离心3 min后效果Fig.3 Comparison of combination with unstained cells between targeted-group and ordinar-group by Indirect methodA.suspension of unstained cells;B.targeted and ordinar-microbubbles added respectively to the two groups;C.effect after mechanical oscillation incubate 10 min;D.result after centrifuge 1500 r/min,3 min
3 讨论
传统的超声造影,主要依靠观察动脉像、静脉像特征性的时间——强度关系,记录开始增强时间、达峰时间、消退时间及增强区域的先后顺序来鉴别肿瘤的良恶性质,这在一定程度上会受主观因素的影响,各学者对此的研究结果也各不相同,且差异多无统计学意义[6-9]。目前,相比传统的超声造影剂,在微泡表面标记肿瘤相关特异性抗体的靶向超声造影剂,通过抗原抗体结合方式,使微泡大量特异性的与肿瘤细胞结合,让特定区域持续、显著的增强,在很大程度上能客观的证明该区域为肿瘤所在[10-12]。
在国内外相关研究中,靶向微泡的制作、与细胞特异性结合的研究均有报道,但总体靶向粘附率不高,容易脱靶,因此靶向效果不尽如人意[13-15]。本课题组经过长期研究,不断改进、筛选制备方法,优化流程,调整试剂配比,成功制备出粒径均一、长效稳定,抗体粘附率高的载VEGFE-3抗体靶向微泡。本次体外实验以直接、间接方式观察寻靶效果,并用图像分析软件及SPSS软件进行客观评价。尤其在间接观察法中,课题组利用微泡质量轻,细胞质量大的特性,将2者加入离心管,充分孵育,靶向组微泡能与细胞结合,离心后细胞仍位于微泡层;普通组同等条件处理后,因普通微泡不会与细胞结合,细胞明显与微泡分层,在离心力作用下沉淀于管底。最终,通过软件分析,直接、间接的证实了载VEGFE-3抗体靶向微泡体外寻靶效果明显优于普通微泡。
此靶向造影剂的成功制备及较好的体外寻靶效果为下一步在体内肿瘤新生淋巴管靶向显影提供了重要依据。不仅有望使造影剂大量聚集在淋巴管靶区,增加对比显像效果,更能使造影剂长时间粘附于淋巴管内皮细胞,相比造影剂短时间消退区域更容易被识别,也使淋巴管靶向微泡成为客观诊断淋巴系统肿瘤的有效方法。总之,靶向微泡有望作为一种特异性识别淋巴系统肿瘤细胞的分子探针,在超声介导下,准确的显示肿瘤新生淋巴管,并对肿瘤良恶性质做出鉴别。
[1] 刘吉斌,王金锐.超声造影显像[M].北京:科学技术文献出版社.2010:6.
[2] Moestue SA,Gribbestad IS,Hansen R.Intravascular targets for molecular contrast-enhanced ultrasound imaging[J].Int J Mol Sci,2012,13(6):6679-6697.
[3] Li YH,Du LF.Research of monoclonal antibody in ultrasound molecular imaging of tumor vasculature[J].Chin J Ultrasonogr,2011,20(7):628-630.
[4] Tlaxca JL,Rychak JJ,Ernst PB,et al.Ultrasound-based molecular imaging and specific gene delicery to mesenteric vasculature by endothelial adhesion melecule targeted microbubbles in a mouse model of Crohn’s disease[J].J Control Release,2013,165(3):216-225.
[5] 张瑰红,杨文涛,施达仁.肿瘤淋巴管形成的研究进展[J].国外医学肿瘤学分册,2005,l(32):6-10.
[6] 周晓东,王茵,赵宝珍.实时灰阶超声造影鉴别诊断浅表良恶性淋巴结[J].中国医学影像技术,2013,7(29):1170-1174.
[7] A Sporea I,Badea R,Martie A,et al.Contrast enhanced ultrasound for the characterization of focal liver lesions[J].Med Ultrason,2011,13(1):38-44.[8] Sporea I,Badea R,Martie A,et al.Contrast Enhanced Ultrasound for the evaluation of focal liver lesions in daily practice.A multicentre study[J].Med Ultrason,2012,14(2):95-100.
[9] Sporea I,Martie A,Bota S,et al.Characterization of focal liver lesions using contrast enhanced ultrasound as afirst line method:a large monocentric experience[J].J Gastrointestin Liver Dis,2014,23(1):57-63.
[10] Kaczmarek MM,Blitek A,Schams D,et al.Effect of luteinizing hormone and tumour necrosis factor-alpha on VEGF secretion by cultured porcine endometrial stromal cells[J].Reprod Domest Anim,2010,45(3):481-486.
[11] Lyshchik A,Fleischer AC,Huamani J,et al.Molecular imaging of vascular endothelial growth factor receptor 2 expression using targeted contrast-enhanced high-frequency ultrasonography[J].J Ultrasound Med,2007,26(11):1575-1586.
[12] Palmowski M,Huppert J,Ladewig G,et al.Molecular profiling of angiogenesis with targeted ultrasound imaging:early assessment of antiangiogenic therapy effects[J].Mol Cancer ther,2008,7(1):101-109.
[13] Lentacker I,Geers B,Demeester J,et al.Design and evaluation of doxorubicin-containing microbubbles for ultrasound-triggered doxorubicin delivery: cytotoxicity and mechanisms involved[J].Mol Ther,2010,18(1):101-108.
[14] Yan F,Li L,Deng ZT,et al.Paclitaxel-liposome-microbubble complexes as ultrasound-triggered therapeuticdrug delivery carriers[J].J Controlled Release,2013,166(3):246-255.
[15] 郭娟,常淑芳,孙江川.LHRHa靶向微泡造影剂的制备及体外寻靶实验[J].中国医学影像技术,2011,3(27):466-469.
(编校:吴茜)
Targeting study of VEGFR-3 antibody loaded microbubble in vitro
YANG Yang1,ZHU Mei1Δ,LIU Zheng2,ZHANG Xiao-feng1,YAN Fei3,ZHAO Xi-yan4
(1.Department of Ultrasound, First Affiliated Hospital of Kunming Medical University, Kunming 650031, China; 2.Department of Ultrasound, Xinqiao Hospital of Third Military Medical University, Chongqing 400037, China; 3.Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China; 4.Laboratory of Human Function, Hainan Medical University, Haikou 571199, China)
ObjectiveTo prepare targeted microbubbles which load anti-VEGFR-3 and observe the targeting effect in vitro.MethodsTargeted microbubbles loaded VEGFR-3 antibody were prepared and the targeting effect in vitro were tested by direct and indirect methods.Direct method took off-line analysis by image analysis software IPP and statistical analysed with SPSS software package.Indirect method took direct observation the target binding effect after incubation and centrifugal sedimentation.Results Image software IPP results showed that the quantity of microbubbles in targeted-group was obviously more than ordinary group.The average microbubbles per field in targeted-group was (151±20).The average microbubbles per field in ordinary group was (12±4) microbubbles, the numbers of combined microbubbles between targeted-group and ordinary-group had significant differences(t=19.19,P<0.01).The indirect method results showed that, compared with ordinary group, the microbubbles in targeted-group could combined with cell gradually.ConclusionTargeted microbubbles load anti-VEGFR-3 have a better contrast effect than common microbubbles.
VEGFR-3 antibody; microbubbles;target;in vitro
国家自然科学基金 (81160178)
杨阳,男,硕士在读,研究方向:超声基础研究,E-mail:yangyzyyx@163.com;朱梅,通讯作者,女,硕士、副主任医师,研究方向:靶向声学造影和非创伤性超声治疗,E-mail:zhumeics@163.com。
R318
A
1005-1678(2015)03-0010-03

