54例乳腺癌术后胸壁转移患者的临床特征及预后因素分析
徐睿 李惠平 邵彬 王晶 宋国红 邸立军 梁旭 严颖 刘笑然
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科/恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142
54例乳腺癌术后胸壁转移患者的临床特征及预后因素分析
徐睿 李惠平#邵彬 王晶 宋国红 邸立军 梁旭 严颖 刘笑然
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科/恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142
目的 探讨乳腺癌术后局部胸壁转移患者的临床特征、治疗方式及影响预后的因素。方法 收集54例术后以胸壁复发为首发转移部位的乳腺癌患者的临床资料,分析各项临床和病理因素同局部控制率及生存期之间的关系;并搜索万方及Pubmed数据库中的相关文献,进行汇总分析。结果 54例患者原发肿瘤术后无病生存期(DFS)为4~277个月,中位DFS为50个月。单纯胸壁转移患者局部复发后无进展生存期(PFS)2~120个月,中位PFS为21个月。单纯胸壁转移组的单因素分析结果显示患者的原发肿瘤病理类型、脉管癌栓情况、激素受体水平、HER2表达情况是原发肿瘤术后DFS及OS的相关预后因素;多因素分析结果显示原发肿瘤的病理类型、脉管癌栓情况、术后辅助放疗、辅助内分泌治疗及原发肿瘤术后DFS是总生存期的独立预后因素。结论 乳腺癌术后局部复发将增加远处转移及死亡风险,明确高复发风险因素,采取全身综合治疗及局部治疗可改善患者预后。
乳腺癌;胸壁转移;治疗;预后因素
Oncol Prog,2015,13(5)
对于乳腺癌术后局部转移率文献报道不一,但均报道以胸壁转移为首发转移部位者最为常见[1-2],且此类患者发生远处转移的风险较高[3-4]。本研究对2014年北京大学肿瘤医院乳腺肿瘤内科收治的54例术后以胸壁转移为首发症状的乳腺癌患者的临床资料进行了系统分析,以明确乳腺癌术后局部复发风险及其对患者预后的影响。
1 资料与方法
1.1 一般资料
自2014年1月至2014年12月,北京大学肿瘤医院乳腺肿瘤内科共收治乳腺癌术后以单纯胸壁转移为首发转移部位的患者54例。患者均为女性,原发乳腺癌诊断年龄为30~67岁,中位发病年龄46岁。其中绝经前患者34例,绝经后18例,2例不详。原发肿瘤临床分期参照美国癌症联合会(American Joint Comm ittee on Cancer,AJCC)乳腺癌分期标准第6版,其中Ⅰ期3例,Ⅱ期18例,Ⅲ期22例,另有11例临床分期不详。病理分型:浸润性导管癌42例,浸润性小叶癌7例,导管原位癌伴早期浸润2例,浸润性乳头状癌1例,2例病理类型不详。腋窝淋巴结阳性者34例,阴性15例。肿瘤大小:≤2 cm共11例,>2~5 cm共22例,>5 cm共7例,14例不详。脉管癌栓阳性者占13例,阴性者6例,35例不详。激素受体ER阳性者21例,阴性25例;PR阳性19例、阴性27例。HER2阳性24例、阴性19例。
1.2 原发肿瘤首次治疗情况
54例患者均接受改良根治术。其中7例接受新辅助化疗,化疗方案以含蒽环或紫衫类药物为主,化疗周期为2~6个。术后共50例接受辅助化疗,化疗方案多包含蒽环、紫衫类药物或含环磷酰胺及卡培他滨。共22例行术后局部放疗,部位以胸壁+同侧锁骨上区淋巴结为主。共19例接受内分泌治疗,放化疗后以应用三苯氧胺为主,部分绝经后女性放疗后应用芳香化酶抑制剂。54例均未接受辅助靶向治疗。
1.3 胸壁转移后治疗情况
所收集的54例病例均以胸壁转移为乳腺癌术后首发转移部位。胸壁转移后多采用全身化疗或局部放疗联合全身化疗的综合治疗,部分行转移灶切除。放疗照射范围主要为胸壁局部或联合腋下、锁骨上区淋巴结。
1.4 统计学方法
应用Excel的统计功能分析患者发病年龄、生存期及相应中位时间;采用统计软件SPSS 18.0对生存及相关因素进行统计分析,对可能影响乳腺癌胸壁转移患者预后的因素进行单因素(采用Kaplan-Meier法)分析和多因素分析(采用Cox回归分析)。P<0.05为差异有统计学意义。
2 结果
2.1 随访情况
本组病例随访至2014年12月,失访5例,失访病例的失访日期计为截止日期,随访率90.7%。截至末次随访日期,本组病例已有6例死亡,病死率为11.1%。
2.2 胸壁转移前后DFS及PFS
无病生存期(disease-free survival,DFS)是指从随机化开始至疾病复发或患者因任何原因导致死亡的时间。统计数据中原发肿瘤至胸壁首次转移时间为4~277个月,中位DFS为50个月。其中2年内复发占38%,5年内复发占76%。无进展生存期(progression free survival,PFS)指从治疗开始至出现疾病进展或死亡的时间。统计数据中首次胸壁转移至出现疾病进展或死亡的时间为2~120个月,中位PFS为21个月。乳腺癌术后胸壁复发后1年生存率为100%,其中部分患者仍在随访中,未进一步计算2年、5年生存率。
2.3 影响胸壁复发后生存期的单因素分析
采用Kaplan-Meier法对原发肿瘤特征进行单因素分析(分别对单纯胸壁转移与伴随远处转移者进行分析)。单纯胸壁转移组的结果显示:患者的原发肿瘤病理类型、脉管癌栓情况、激素受体水平、HER2表达情况与DFS及总生存期存在相关性(P均<0.05);原发肿瘤术后DFS与总生存期(overall survival,OS)存在相关性(P<0.05),详见表1。首次胸壁转移后复发灶手术切除与PFS存在相关性(P<0.05),其中复发后内分泌治疗倾向与PFS存在相关性(P<0.05),详见表2。

表1 原发肿瘤的临床特征与原发肿瘤术后DFS及OS的关系
2.4 多因素Cox回归分析
多因素Cox回归分析显示:原发肿瘤病理类型、脉管癌栓情况、术后行辅助放疗、辅助内分泌治疗及原发肿瘤术后DFS是总生存期的独立预后因素(均P<0.05),详见表3。
3 讨论
乳腺癌术后局部复发可增加远处转移及死亡风险,乳腺癌术后局部区域性复发可能是发生远处转移的新播散源或疾病进展的局部表现[3,5-6]。乳腺癌局部复发部位中以胸壁最为常见,占所有复发患者的50%~94%[1]。胸壁转移可发生在乳腺癌术后任何时间,在本分析中收集的54例术后单纯胸壁转移病例中,原发肿瘤术后DFS为4~277个月,中位DFS为50个月,文献报道以2年内局部复发为主[1,7],5年后复发较少。原发肿瘤术后DFS经单因素分析,显示与总生存期存在相关性(P=0.000),该结论同Van Tienhoven、王准等[8-9]的报道一致。

表2 胸壁复发灶的治疗情况与胸壁复发后生存期的关系
此次关于原发肿瘤的临床特征的统计中,单因素分析显示患者的原发肿瘤病理类型、脉管癌栓情况、激素(ER、PR)受体水平、HER2表达情况与原发肿瘤术后DFS及总生存期相关,同Park和Yu等报道的一致[10-11]。其中激素受体情况、HER2情况在多个文献中均有报道[2,4,10],认为HER2阳性同较短的DFS及OS相关,激素受体阴性及HER2阳性者较激素受体阳性及HER2阴性者局部复发及远处转移风险高,三阴性乳腺癌局部复发风险最高[11-12]。多因素分析中病理类型、脉管癌栓情况与单因素分析一致。另有多数文献报道,原发肿瘤分期(pT1~pT2)同预后相关[8],原发肿瘤大小>5cm提示为胸壁转移后生存期的显著预后不良因素,淋巴结阴性者有较好的预后[10,13],且阳性淋巴结数目越少提示预后越好[8]。其中淋巴结转移数目对DFS及OS的影响较为明确,因本统计中淋巴结转移与未转移两组病例不均衡,未进一步进行分析。同时有文献报道发病年龄是影响预后的独立危险因素,其中年轻患者(<40岁)较老年患者10年局部复发率高出约10%[12,14],本组病例因年龄分布不均未显示出相关性。
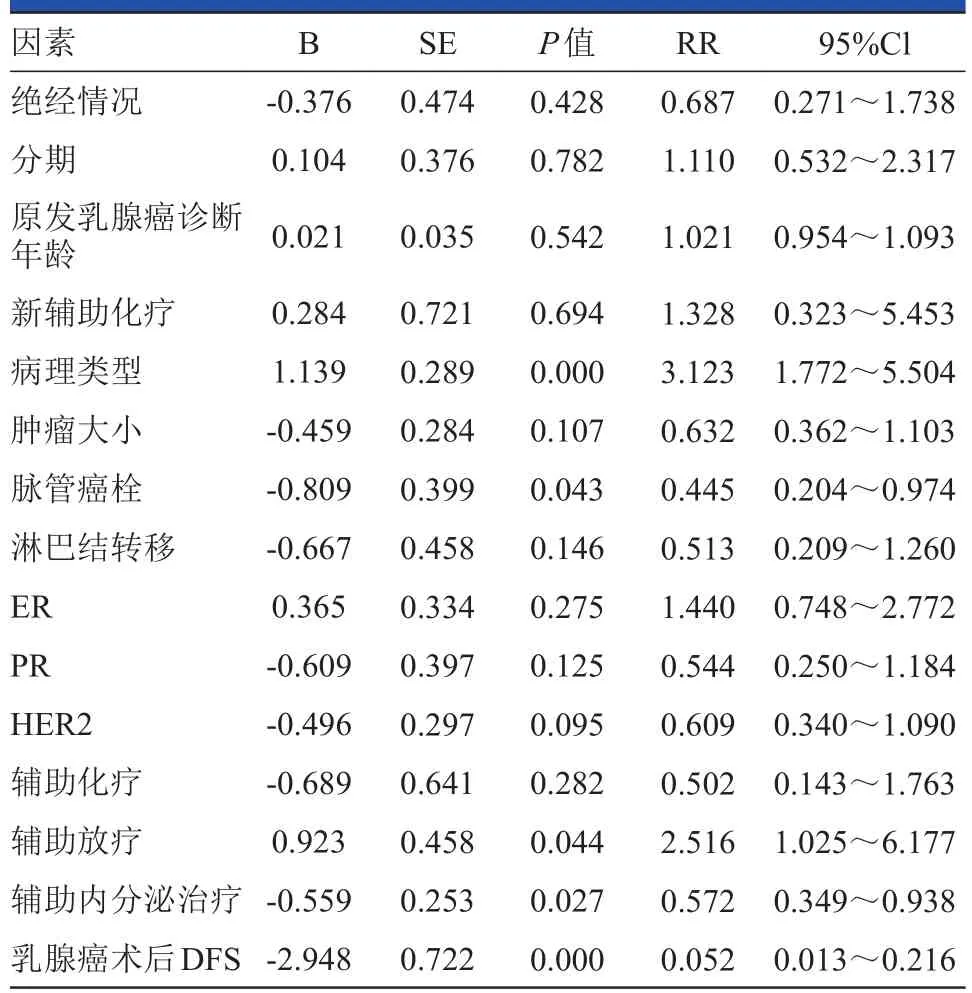
表3 Cox回归分析结果
对原发肿瘤的治疗情况可以影响局部复发率及总生存期,且乳腺癌局部复发后控制率低,60.8%~80.0%出现远处转移而死亡[1,15],因此强调该类患者应在全身综合治疗的基础上辅以局部治疗,以达到更好的治疗效果。治疗方式上包括新辅助化疗、术后辅助放疗、辅助化疗及辅助内分泌治疗。局部放疗方面,多项研究证实其对控制乳腺癌术后局部复发率及改善总生存期的疗效较为明确[16-19],是目前乳腺癌术后主要的局部治疗方式[8,13],特别是对≥4个腋窝淋巴结阳性的患者[17,20]。放疗范围主要包括胸壁及锁骨上淋巴结[19]。最新EBCTCG2014研究表明,建议对1~3个淋巴结阳性的患者亦实施术后辅助放疗[13,17],其数据显示,术后未进行放疗的患者的10年整体复发率为45.7%,而接受放疗者复发率为34.2%。但目前对淋巴结阴性者仍没有证据显示术后局部放疗可改善其预后(考虑到复发风险低及放疗相关毒性)。DBCG的两项研究[21-22]证实对于绝经前联合化疗的改良根治术后女性及绝经后联合他莫昔芬的改良根治术后女性(主要为存在1~3个腋窝淋巴结阳性、肿瘤大小>5cm、皮肤或胸筋膜浸润者),放疗均改变了其预后格局。同时Skinner[23]的研究显示在标准照射剂量基础上增加局部放疗照射剂量不能延缓乳腺癌术后胸壁局部转移时间。术后辅助化疗方面,乳腺癌术后辅助化疗可显著提高胸壁局部复发患者的DFS及OS[20],特别是对雌激素受体阴性的患者[24]。另有研究证实术后辅助内分泌治疗可显著提高患者的DFS,降低局部转移及远处转移率[4,25]。芳香化酶抑制剂在改善DFS方面优于他莫昔芬,并已广泛推荐应用于绝经后期、激素受体阳性的乳腺癌患者[25]。术后辅助化疗及内分泌治疗的顺序方面,建议内分泌治疗应在完成化疗后开始进行[20]。本研究的多因素分析显示术后辅助放疗及辅助内分泌治疗与局部转移及总生存期存在显著性差异(P<0.05),未进行相关单因素分析,有如下原因:①该研究为回顾性分析,选择病例非随机,病例数较少且随访时间短,未得到临床终点结果,从而影响了结果的可信度。②样本量较小,单纯胸壁转移例数仅54例,且每项预后因素分类中病例数不均衡,增加了统计中Ⅱ型错误的概率,检验效能不够充分,可能使总体间存在的差异未被检验出来。仍需进一步扩大样本量提高结论的可信度。③大多数患者首次治疗不在本院,在治疗的规范性及提供临床信息方面可能存在偏差。
对于单纯胸壁复发后发生远处转移的患者,我们的数据显示局部转移后疾病进展或发生远处转移的中位时间为21个月。单因素分析显示对复发灶行手术切除及复发后靶向治疗与PFS存在相关性。有前瞻性研究认为,再次复发的患者采用综合治疗方案对于预后好的复发患者(指术后至复发间隔>12个月,ER、PR均阳性,复发结节少于4个且最大肿物直径小于3cm)有利[1,26],建议对局部复发肿瘤行手术、全身综合治疗及局部放疗。因目前随访病例数较少及随访时间短,其远处转移后治疗有效率还有待进一步观察。
综上所述,目前患者的肿瘤大小、脉管癌栓情况、淋巴结受累情况、激素受体水平及HER2表达情况证实为局部复发及总生存期的预后因素。原发肿瘤术后的全身治疗及辅助放疗的疗效也较为明确,可降低局部复发率及远期生存,同时随着放疗技术的发展,放疗相关毒性作用的降低可使患者带来更大的获益。但目前关于术后及局部复发后靶向治疗的报道仍较少,考虑其中HER2表达性分析病例数较少,尤其是胸壁转移同时伴随远处转移者,为取得乳腺癌术后胸壁转移的更多共识,还需进一步扩大样本量进行大规模、分组研究。
[1]张晟,张敏,李春艳,等.乳腺癌根治术局部复发后影响预后的相关因素分析[J].中华乳腺病杂志(电子版),2010,4(1):32-41.
[2]Clarke CA,Keegan TH,Yang J,et al.Age-specific incidence of breast cancer subtypes:understanding the black-white crossover[J].J Natl Cancer Inst,2012,104 (14):1094-1101.
[3]Shenouda MN,Sadek BT,Goldberg SI.Clinical outcome of isolated locoregional recurrence in patients w ith breast cancer according to their primary local treatment [J].Clin Breast Cancer,2014,14(3):198-204.
[4]Jeong Y,Kim SS,Gong G.Treatment results of breast cancer patientsw ith locoregional recurrence aftermastectomy[J].Radiat Oncl J,2013,31(3):138-146.
[5]王准,刘冠,郑晓,等.早期乳腺癌根治术后胸壁复发的治疗[J].浙江医学,2007,29(7):709-711.
[6]Fodor J,Major T,Polgar C,et al.Prognosis of patients w ith local recurrence after mastectomy or conservative surgery for early-stage invasive breast cancer[J].Breast, 2008,17(3):302-308.
[7]Navarrete MD,Gonzalez MN,Montalvo VMT,et al.Patterns of recurrence and survival in breast cancer[J].Oncl Rep,2008,20(3):53l-535.
[8]Van Tienhoven G,Voogd AC,Peterse JL,et al.Prognosis after treatment for loco-regional recurrence aftermastectomy or breast conserving therapy in two random ised trials(EORTC 10801 and DBCG-82TM)[J].Eur JCancer,1999,35(1):32-38.
[9]王准,封巍,刘冠,等.88例早期乳腺癌术后胸壁复发的多因素分析[J].实用肿瘤杂志,2006,21(5): 453-456.
[10]Park H,Chang SK,Kim JY,et al.Risk factors for distantmetastasis as a primary site of treatment failure in early-stage breast cancer[J].Chonnam Med J,2014,50 (3):96-101.
[11]Yu JB,Wilson LD,Dasqupta T,et al.Postmastectomy radiation therapy for lymph node-negative,locally advanced breast cancer after modified radicalmastectomy [J].Cancer,2008,113(1):38-47.
[12]Rudra S,Yu DS,Yu ES,et al.Locoregional and distant recurrence patterns in young versus elderly women treated for breast cancer[J].Int J Breast Cancer,2015, 2015(1):1-9.
[13]Kuo SH,Huang CS,Kuo WH,et al.Comprehensive locoregional treatment and systemic therapy for postmastectomy isolated locoregional recurrence[J].Int JRadiat Oncol Biol Phys,2008,72(5):1456-1464.
[14]Cheng SH,Tsai SY,Yu BL,et al.Validating a prognostic scoring system for postmastectomy locoregional recurrence in breast cancer[J].Int J Radiat Oncol Biol Phys,2013,85(4):953-958.
[15]赵雪桃,金保红,陈文璞,等.乳腺癌改良根治术联合化疗对患者并发症与生活质量的影响[J].中国普通外科杂志,2013,22(11):1514-1516.
[16]Clarke M,Collins R,Darby S.Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials[J].Lancet,2005, 366(9503):2087-2106.
[17]M cGale P,Taylor C,Correa C,et al.Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality:metaanalysis of individual patient data for 8135 women in 22 randomized trials[J].Lancet,2014,383(9935):2127-2135.
[18]Ragaz J,Olivotto IA,Spinelli JJ,et al.Locoregional radiation therapy in patients w ith high-risk breast cancer receiving adjuvant chemotherapy:20-year results of the British Columbia randomized trial[J].J Natl Cancer Inst,2005,97(2):116-126.
[19]Brown LC,Mutter RW,Halyard MY.Benefits,risks, and safety of external beam radiation therapy for breast cancer[J].Int JWomens Health,2015,1(7):449-458.
[20]EBCTCG.Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival:an overview of the random ized trials[J].Lancet,2005,365(9472):1687-1717.
[21]Overgaard M,Hansen PS,Overgaard J,et al.Postoperative radiotherapy in high-risk premenopausal women w ith breast cancer who receive adjuvant chemotherapy [J].N Engl JMed,1997,337(14):949-955.
[22]Overgaard M,Jensen MB,Overgaard J,et al.Postoperative radiotherapy in high-risk postmenopausal breastcancer patients given adjuvant tamoxifen[J].Lancet, 1999,353(9156):1641-1648.
[23]Skinner HD,Strom1 EA,Motwani SB.Radiation dose escalation for loco-regional recurrence of breast cancer aftermastectomy[J].Radiat Oncol,2013,8(13):1-9.
[24]Aebi S,Gelber S,Anderson SJ,et al.Chemotherapy for isolated locoregional recurrence of breast cancer (CALOR):a randomized trial[J].Lancet Oncol,2014, 15(2):156-163.
[25]Pennery E.The role of endocrine therapies in reducing risk of recurrence in postmenopausal women w ith hormone receptor--positive breast cancer[J].Eur J Oncol Nurs,2008,12(3):233-243.
[26]Christiansen P,A l-Suliman N,Bierre K,et al.Recurrence pattern and prognosis in low-risk breast cancer patients data from the DBCG 89-A programme[J].Acta Oncol,2008,47(4):691-703.
Clinical featuresand prognosisof 54 breastcancer patientsw ith chestwall recurrenceaftermastectomy
XU Rui LIHui-ping#SHAO Bin WANG Jing SONGGuo-hong DILi-jun LIANG Xu YAN Ying LIU Xiao-ran
DepartmentofMedicalOncology,Key Laboratory of Carcinogenesisand Transformation Research(M inistry of Education), Peking University Cancer Hospital&Institute,Beijing 100142,China
Objective To analyze the clinical features,treatmentmodality and prognosis of breast cancer patients w ith chestwall recurrence(CWR)aftermastectomy.Method The clinical-pathologic profiles of 54 breast cancer patients w ith CWR were collected,and the relation between various clinical-pathological factors and local control,as well as survival,was investigated,besides,associated literatures were searched in the database of WANFANG and Pubmed and reviewed.Result Of all the 54 patients,the postoperative disease-free survival(DFS)was 4 to 277 months,w ith amedian DFS of 50 months.For simple CWR patients,the progression-free survival(PFS)after CWR was 2 to 120 months,w ith a median PFS of 21 months.The univariate analysis showed that,the pathological type, blood vessel invasion,hormone receptor status and HER2 status were associated w ith the DFS and overall survival (OS).And the multivariate analysis suggested that the pathological type,blood vessel invasion,postoperative radiotherapy,adjuvant endocrine therapy and the DFS aftermastectomy were independent prognostic factors for OS.Conclusion Postoperative chest wall breast cancer recurrence increases the risk of distantmetastases and death,and sys-tem ic treatment combined w ith local treatment is beneficial in improving patients'prognosis.
breast cancer;chestwall recurrence;treatment;prognostic factors
R737.9
A
10.11877/j.issn.1672-1535.2015.13.05.10
#通信作者(corresponding author),e-mail:Chevy296@163.com
2015-07-04)

