非小细胞肺癌中ETS-1与E-cadherin、N-cadherin、Vimentin表达相关性的研究△
周立莉 葛新国 蔡茂怀 唐峰 朱建峰 孙林 李霞 刘菊林 王彩莲
盐城市第二人民医院/盐城市肿瘤医院1肿瘤内科,2肿瘤外科,3病理科,江苏盐城224003 4东南大学医学院附属中大医院肿瘤科,江苏南京210009
非小细胞肺癌中ETS-1与E-cadherin、N-cadherin、Vimentin表达相关性的研究△
周立莉1,4葛新国2蔡茂怀1#唐峰1朱建峰3孙林3李霞3刘菊林1王彩莲4#
盐城市第二人民医院/盐城市肿瘤医院1肿瘤内科,2肿瘤外科,3病理科,江苏盐城2240034东南大学医学院附属中大医院肿瘤科,江苏南京210009
目的 探讨ETS-1与E-cadherin、N-cadherin、Vimentin在肺癌中的表达相关性及其临床意义。方法选择接受手术切除并经病理证实的110例非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的肿瘤组织和距肿瘤3 cm以上的癌旁正常肺组织,采用免疫组化SP法检测组织中ETS-1与E-cadherin、N-cadherin、Vimentin的表达,并结合临床资料进行相关性分析。结果 非小细胞肺癌组织中ETS-1与N-cadherin、Vimentin的阳性表达率分别为65%(72/110)、56%(62/110)、34%(37/110),明显高于正常癌旁肺组织的6%(3/50)、8%(4/ 50)、2%(1/50),组间差异具有统计学意义(P<0.01);E-cadherin的阳性表达率为41%(45/110),明显低于正常癌旁肺组织中的84%(42/50)。ETS-1的阳性率与淋巴结转移和TNM分期呈正相关(P<0.05),而与性别、年龄、肿瘤直径、组织学类型及分化程度无关(P>0.05)。E-cadherin的阳性率与肿瘤分化程度、淋巴结转移和TNM分期呈负相关(P<0.05),N-cadherin和Vimentin的阳性率与肿瘤分化程度、淋巴结转移及TNM分期呈正相关(P<0.05),E-cadherin、N-cadherin、Vimentin的表达与患者的性别、年龄、肿瘤直径、组织学类型无相关性(P>0.05)。在非小细胞肺癌中ETS-1与E-cadherin的表达呈负相关,ETS-1与N-cadherin的表达呈正相关。结论 ETS-1与E-cadherin、N-cadherin、Vimentin的表达和非小细胞肺癌的转移密切相关,其检测可作为判断非小细胞肺癌转移和预后的指标之一。
ETS-1;黏蛋白类;波形蛋白;非小细胞肺癌;肿瘤转移
Oncol Prog,2015,13(5)
肺癌是临床常见的恶性肿瘤,发病率和病死率在世界范围内居首位[1]。在我国,肺癌的发病率和病死率在男性中居首位,在女性中居第二位,给人们的健康带来了很大的威胁。中国已成为世界第一肺癌大国,目前,肺癌的发病率和病死率仍呈不断上升的趋势[2]。NSCLC约占肺癌的80%,早期诊断困难,容易出现复发和远处转移是导致肺癌患者死亡的主要原因[3]。研究表明恶性肿瘤中上皮间质转变(epithelial-mesenchymal transition,EMT)在肿瘤的浸润及转移过程中具有重要作用[4]。在EMT过程中的主要分子表达变化包括E-cadherin表达降低,而非上皮的黏附分子,如N-cadherin表达上调。研究表明大部分NSCLC患者体内都会表达Vimentin,而蛋白表达的增高通常是预测肿瘤转移的一个重要标志[5]。ETS-1是一种原癌基因,在多种肿瘤中均呈阳性表达。ETS-1基因参与细胞生长和细胞外基质侵袭,可促进肿瘤的侵袭转移。孙翠云等[6]的研究发现,ETS-1mRNA的表达与肺癌的侵袭转移有关。本研究旨在探讨ETS-1是否可通过诱导EMT来参与肿瘤侵袭转移的过程,通过检测NSCLC中ETS-1与EMT的标志物E-cadherin、N-cadherin、Vimentin表达的相关性,进一步阐明ETS-1在肺癌的发生、发展和转移过程中的作用机制。
1 资料与方法
1.1 资料
肺癌组织及癌旁组织标本取自2012年3月至2014年10月在盐城市第二人民医院及盐城市第一人民医院胸外科住院手术切除的存档组织和新鲜标本,所有病例均是未经化放疗和分子靶向治疗的初诊患者,由两名以上资深病理科专家确诊,具有完整的病理和临床资料。其中肺癌组织标本110例,包括男性86例,女性24例;年龄41~76岁,平均61.3岁。按照2004年WHO肺肿瘤组织学分类标准,包括鳞癌63例,腺癌42例,腺鳞癌5例;高分化(Ⅰ级)18例,中分化(Ⅱ级)51例,低分化(Ⅲ级)41例。发生淋巴结转移者59例,无淋巴结转移者51例。依据美国癌症联合会(American Joint Comm ittee on Cancer Staging,AJCC)标准[7]进行p-TNM分期,其中包括Ⅰ期47例,Ⅱ期25例,Ⅲ期38例。选择癌旁正常肺组织(距离肺癌组织边缘3 cm以上)50例作为对照,病理HE染色证实为正常肺组织。
1.2 方法
1.2.1 主要试剂 鼠抗人ETS-1免疫组化单克隆抗体(Ab10936)克隆号:1G11(英国Abcam公司);鼠抗人E-cadherin免疫组化单克隆抗体克隆号:36B5;鼠抗人N-cadherin免疫组化单克隆抗体克隆号:6G11;鼠抗人Vimentin免疫组化单克隆抗体克隆号:V9。免疫组化SP试剂盒和浓缩型DAB试剂均购自珠海市泉晖企业有限公司。
1.2.2 免疫组化染色 采用免疫组化染色链霉菌抗生物素蛋白-过氧化酶(streptavidin-perosidase,SP)法检测NSCLC组织中ETS-1与E-cadherin、N-cadherin、Vimentin的表达。所有组织标本均经10%中性福尔马林固定,常规石蜡包埋后制成4 μm的连续切片。经二甲苯脱蜡,梯度乙醇脱水,PBS冲洗三次后,具体步骤按照免疫组化染色试剂盒(Vector Labs,USA)提供的说明书进行染色。一抗ETS-1稀释浓度为1∶100,E-cadherin为1∶200,N-cadherin为1∶200,Vimentin为1∶100。阴性对照以PBS代替一抗,阳性对照为已知的阳性切片。
1.2.3 结果判定 所有染色切片均由两名资深病理科医师采用双盲法独立重复进行阅片。染色阳性结果表现为淡黄色、棕黄色或者棕褐色颗粒。ETS-1阳性主要定位于细胞核和(或)细胞质[8],E-cadherin阳性主要定位于细胞膜[9],N-cadherin阳性主要定位于细胞膜和(或)部分细胞质[10],Vimentin阳性主要定位于细胞质。最后根据阳性细胞比例和染色强度综合得分之和进行判定:0~1分为阴性(-),2~7分为阳性(+~++),>7分为强阳性(+++)。随机选取5个高倍视野,计数阳性细胞,观察阳性细胞染色强度。阳性细胞数:0~10%计0分,11%~25%计1分,26%~50%计2分,51%~75%计3分,76%~100%计4分。细胞染色强度:无染色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。若判定结果相差2分,则重新判定。
1.3 统计学处理
应用SPSS13.0统计学分析软件进行数据处理:ETS-1与E-cadherin、N-cadherin、Vimentin在NSCLC组织和癌旁正常肺组织中的表达比较,以及在各临床病理因素组间表达情况的差异性比较均采用χ2检验;ETS-1与E-cadherin、N-cadherin、Vimentin在NSCLC中表达的相关性采用Spearman秩相关检验分析。以P<0.05为具有统计学意义。
2 结果
ETS-1在NSCLC组织中的阳性表达率为65%(72/110),而在正常肺组织中阳性表达率为6%(3/ 50),差异有统计学意义(χ2=48.8,P<0.001)。E-cadherin在NSCLC组织中的阳性表达率为41%(45/110),明显低于癌旁正常肺组织中的84%(42/ 50),差异具有统计学意义(χ2=25.7,P<0.001)。N-cadherin在NSCLC组织中的阳性表达率为56℅(62/110),明显高于正常肺组织中的8%(4/50),差异具有统计学意义(χ2=33.2,P<0.001)。Vimentin在NSCLC组织中的阳性表达率为34%(37/110),明显高于正常肺组织中的2%(1/50)。差异具有统计学意义(χ2=19.0,P<0.001)。
2.2 ETS-1与E-cadherin、N-cadherin、Vimentin在NSCLC中的表达与临床病理特征的关系
ETS-1、E-cadherin、N-cadherin、Vimentin的阳性表达均与患者的性别、年龄、肿瘤直径、癌组织的病理类型及分化程度无关(P>0.05)。ETS-1、N-cadherin、Vimentin在淋巴结转移组的阳性率分别为79.7%、71.2%、45.8%,而对应的无淋巴结转移组的阳性率分别为49.0%、39.2%、17.6%,有淋巴结组的阳性率均高于无淋巴结组,差异有统计学意义(P<0.05)。E-cadherin在淋巴结转移组的阳性率为30.5%,明显低于无淋巴结转移组的52.9%,差异具有统计学意义(P=0.02)。
Ⅰ~Ⅱ期NSCLC患者的ETS-1阳性表达率为51.5%,Ⅲ期NSCLC患者的ETS-1阳性表达率为86.4%,差异具有统计学意义(P=0.0002)。Ⅰ~Ⅱ期NSCLC患者的E-cadherin阳性表达率为51.5%,Ⅲ期NSCLC患者的E-cadherin阳性表达率为25.0%,差异具有统计学意义(P=0.0056)。Ⅰ~Ⅱ期NSCLC患者的N-cadherin阳性表达率为47.0%,Ⅲ期NSCLC患者的N-cadherin阳性表达率为70.5%,差异具有统计学意义(P=0.015)。Ⅰ~Ⅱ期NSCLC患者的Vimentin阳性表达率为24.2%,Ⅲ期NSCLC患者的Vimentin的阳性表达率43.2%,差异有统计学意义(P=0.037)。在NSCLC组织的分化程度方面,随着分化程度越来越差,E-cadherin的阳性表达率也越来越低,经χ2趋势性检验差异具有统计学意义(P<0.05);而N-cadherin、Vimentin的阳性表达率明显增高,经χ2趋势性检验差异具有统计学意义(P<0.05),见表1。
在110例NSCLC患者中,ETS-1和E-cadherin表达呈负相关(r=-0.329,P<0.01),ETS-1和N-cadherin表达呈正相关(r=0.247,P<0.01),ETS-1和Vimentin的表达无相关性(r=-0.049,P>0.05),见表2。
3 讨论
肺癌细胞的侵袭、转移是一个受多因素调控的复杂的生物学过程,其关键步骤是癌细胞脱离原发病灶并黏附到靶器官。细胞黏附参与整个过程并起重要作用,EMT在恶性肿瘤浸润转移的过程中发挥重要作用[11-14]。研究表明,肺癌细胞中EMT不均匀,当循环肿瘤细胞发生EMT后,肿瘤细胞集体迁移和其生存率将大大增加,进而促进肺癌的转移[15]。并且E-cadherin和Vimentin分别是上皮细胞和间质细胞的重要生物标志物[16]。在EMT过程中的主要分子表达变化包括E-cadherin表达降低,而非上皮的黏附分子如N-cadherin表达上调。其中,E-cadherin表达降低是诱发EMT的基础,是肿瘤细胞发生侵袭的关键步骤[17]。
本研究通过免疫组化法检测了110例NSCLC及其癌旁正常肺组织中ETS-1、E-cadherin、N-cadherin及Vimentin的表达,发现ETS-1与E-cadherin、N-cadherin、Vimentin蛋白在NSCLC及其癌旁组织中的表达有明显的差异性,与肺癌的侵袭转移相关。

表1 肺癌组织中ETS-1、E-cadherin、N-cadherin与Vimentin的表达与临床病理特征的关系
E-cadherin属于钙依赖性跨膜黏附蛋白家族成员,主要介导同型细胞间的黏附作用,在调节器官、组织的形态发育和维持组织结构的完整性方面具有重要作用。已有相关研究证实E-cadherin基因是一个重要的肿瘤转移抑制基因,它可能通过促进同型细胞间的黏附而使癌细胞之间保持密切接触,进而减少癌细胞从原发灶脱离并向远处转移[18]。如果E-cadherin表达下降,肿瘤细胞连接松散,也可使肿瘤细胞分裂增殖失控,致肿瘤细胞从原发灶脱落而发生局部或远处转移[19]。Lee等[20]的研究表明,E-cadherin在早期、高分化、无浸润转移的肺癌细胞中高表达,而在晚期、低分化、有浸润转移的肺癌细胞中低表达。提示在肿瘤的发展过程中,E-cadherin的表达下降或消失使肿瘤细胞间的黏附力下降,促进了EMT的发生。本研究结果表明,E-cadherin的表达与肿瘤分化程度、淋巴结转移和TNM分期呈负相关,与上述文献报道一致。Shiwu等[21]和Wu等[22]研究证实了E-cadherin表达下调或缺失与肺癌的分化程度、浸润和转移密切相关。新近发现E-cadherin基因也是一种抑癌基因,其突变和丢失是肿瘤进展和转移中一个关键性的分子事件[23]。
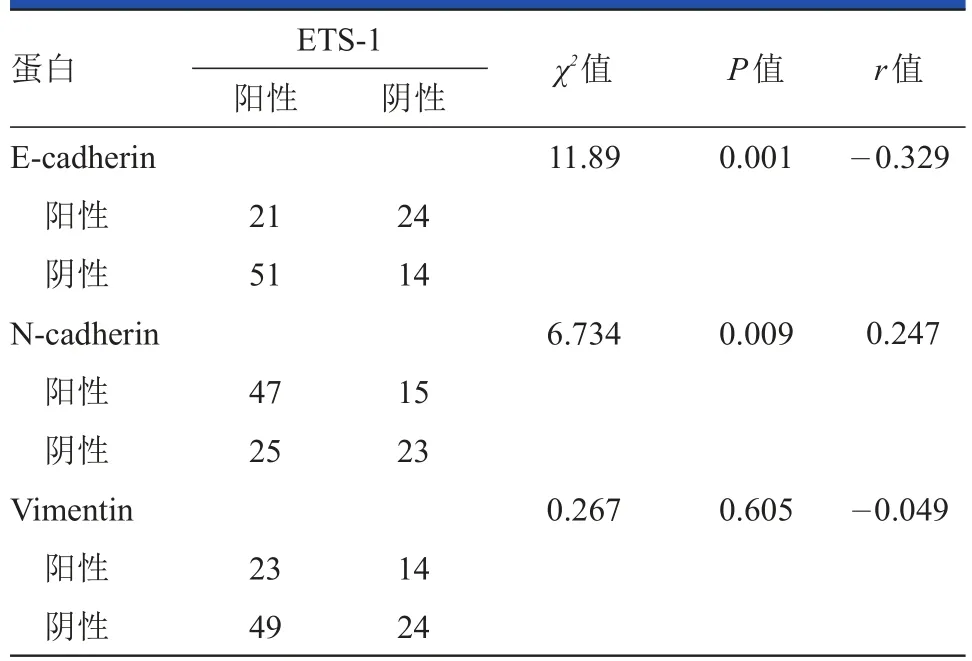
表2 ETS-1与E-cadherin、N-cadherin、Vimentin的相关性分析
N-cadherin由CDH2基因编码,定位于18q11.2,相对分子量为140 kD。常见于神经外胚层和中胚层组织[24]。N-cadherin对肿瘤上皮细胞、血管平滑肌细胞和外皮细胞之间的相互黏附起重要作用。在正常肺上皮组织中呈阴性。在肿瘤形成的过程中,N-cadherin的表达有助于血管形成及上皮细胞-间质细胞的迁移;还可以通过FGF激活MAPKERK信号转导途径,诱导MMP-9基因表达。从而有利于肿瘤血管的形成,使肿瘤易于生长和转移。近年来有多项研究表明,N-cadherin在恶性黑色素瘤[25]、胰腺癌[26]、乳腺癌[27]、前列腺癌[28]、胃癌[29]及口腔鳞癌[30]等诸多恶性肿瘤中表达上调或重新表达,与肿瘤的浸润和转移关系密切。本研究也发现,N-cadherin在肺癌组织中的表达与肿瘤分化程度、淋巴结转移和TNM分期呈正相关,而与患者的性别、年龄、肿瘤直径、组织学类型无相关性。
Vimentin是一种在间质表达的Ⅲ型中间丝状体蛋白,是肿瘤EMT的重要标志物。研究表明,在需要上皮细胞迁移的一系列病理和生理过程中,上皮细胞会表达Vimentin[31]。而Vimentin在上皮细胞迁移及肿瘤侵袭中具有重要的作用[31]。另有文献报道,Vimentin在膀胱癌中的高表达与肿瘤的浸润转移密切相关,Vimentin高表达预示着肿瘤预后不良[32]。已有的研究结果表明,大部分NSCLC患者均有Vimentin表达,而蛋白表达增加是预测肿瘤转移的一个重要标志[5]。本试验中,肺癌组织中Vimentin的表达率为34.0%,而在正常癌旁组织中不表达或极低表达,与国内外报道基本一致。
人类ETS(E26 tansformation-specific)基因属于原癌基因[33]。其编码产物构成了一个庞大的转录调控因子家族,参与调控细胞的增殖分化、迁移凋亡、血管发生和器官形成等。最近的研究显示,ETS-1在许多恶性肿瘤中普遍高表达[34]。ETS-1还可以调节部分ECM的靶基因包括基质蛋白及其他参与细胞-基质反应的细胞成分,当内源性ETS-1的表达被抑制之后,基质相关蛋白MMP-1及MMP-2在RNA水平表达下调[35]。周梅等[8]采用免疫组化及RT-PCR方法检测出ETS-1蛋白在NSCLC组织中过表达,ETS-1与肺癌的发生、浸润、转移和预后密切相关,并且有可能是肺癌的独立预后因素。亦有一项研究显示ETS-1可以作为前列腺癌患者,尤其是高风险患者评估预后的一项重要的分子标志物[36]。孙翠云等[6]利用mRNA FISH法和组织芯片技术,检测肺癌中ETS-1 mRNA的表达情况,结果有70.4%的患者ETS-1表达阳性,而在正常肺标本中未见表达,差异有统计学意义(P<0.05);该研究表明ETS-1 mRNA表达与肺癌的侵袭转移有关。本研究发现ETS-1在淋巴结转移和TNM分期晚的肺癌患者中呈高表达,表明肺癌组织中ETS-1的表达与临床病理特征具有明显的相关性。因此,ETS-1可能成为肺癌患者预后判断及指导临床治疗的重要指标。
本研究结果表明在NSCLC患者中,ETS-1与E-cadherin的表达呈负相关,与N-cadherin的表达呈正相关,与Vimentin的表达无相关性。通过检测NSCLC中ETS-1与EMT的标志分子E-cadherin、N-cadherin、Vimentin的表达情况,可初步了解肺癌组织中EMT的发生及发展状况,从而为进一步判断肿瘤的侵袭转移能力及制定有效的治疗方案提供帮助。
[1]Siegel R,Ma,J,Zou Z,et al.Cancer statistics[J].CA Cancer JClin,2014.64(1):9-29.
[2]张天泽,徐光伟.肿瘤学[M].天津:天津科学技术出版社,1996:1180.
[3]Travis WD.Pathology of lung cancer[J].Clinics in Chest Medicine,2011,32(4):669-692.
[4]de Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat Rev Cancer,2013,13(2):97-110.
[5]李岩,李欣,吴爱萍,等.波形蛋白在非小细胞肺癌组织的表达及其意义[J].中华实验外科杂志,2013, 30(11):2427-2429.
[6]孙翠云,王新允,李艳,等.应用FISH和组织芯片方法研究肺癌组织[J].肿瘤防治研究,2005,32(10): 616-618.
[7]Fernandez-Galilea M,Perez-Matute P,Prieto-Hontoria PL,et al.Effects of lipoic acid on lipolysis in 3T3-L1adipocytes[J].JLipid Res,2012,53(11):2296-2306.
[8]周梅,雷淑慧,胡兴胜.ETS-1在非小细胞肺癌中的表达及其临床意义[J].生命科学研究,2011,15(4): 334-338.
[9]M iao Y,Liu N,Zhang Y,et al.p120ctn isoform 1 expression significantly correlates w ith abnormal expression of E-cadherin and poor survival of lung cancer patients[J].Med Oncol,2010,27(3):880-886.
[10]耿秀东.N-cadherin和E-cadherin在非小细胞肺癌中的表达及相关性研究[D].山东:泰山医学院,2013.
[11]Hur K,Toiyama Y,Takahashi M,et al.M icroRNA-200c modulates epithelial-to-mesenchymal transition (EMT)in human colorectal cancer metastasis[J].Gut, 2013,62(9):1315-1326.
[12]Shirakihara TM,Saitoh,M iyazono K.Differential regulation of epithelial and mesenchymal markers by delta EF1 proteins in epithelial mesenchymal transition induced by TGF-beta[J].Mol Biol Cell,2007,18(9): 3533-3544.
[13]Okano K,Hibi A,M iyaoka T,et al.Inhibitory effects of the transcription factor Ets-1 on the expression of type I collagen in TGF-beta1-stimulated renal epithelial cells[J].Mol Cell Biochem,2012,369(1-2):247-254.
[14]de Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat Rev Cancer,2013,13(2):97-110.
[15]Hou JM,Krebs M,Ward T,et al.Circulating tumor cells as a w indow on metastasis biology in lung cancer [J].Am JPathol,2011,178(3):989-996.
[16]Kokkinos M I,Wafai R,Wong MK,et al.Vimentin and epithelial-mesenchymal transition in human breast cancer-observations in vitro and in vivo[J].Cells Tissues Organs,2007,185(1-3):191-203.
[17]Perl AK,Wilgenbus P,Dahl U,et al.A causal role for E-cadherin in the transition from adenoma to carcinoma [J].Nature,1998,392(6672):190-193.
[18]Danen EH,van Muijen GN,Ruiter DJ.Role of integrins and other cell adhesion molecules in tumor progression and metastasis[J].Lab Invest,1993,68(1):4-17.
[19]Dorudi S,Sheffield JP,Poulsom R,et al.E-cadherin expression in colorectal cancer.An immunocytochem ical and in situ hybridization study[J].Am J Pathol,1993, 142(4):981-986.
[20]Lee YC,Wu CT,Chen CS,et al.The significance of E-cadherin and alpha-,beta-,and gamma-catenin expression in surgically treated non-small cell lung cancers of 3 cm or less in size[J].J Thorac Cardiovasc Surg, 2002,123(3):502-507.
[21]Shiwu Wu,Lan Y,Wenqing S,et al.Expression and clinical significance of CD82/KAI1 and E-cadherin in non-small cell lung cancer[J].Arch Iran Med,2012,15 (11):707-712.
[22]Wu Y,Liu HB,Ding M,etal.The impactof E-cadherin expression on non-small cell lung cancer survival:ameta analysis[J].Mol BiolRep,2012,39(9):9621-9628.
[23]Le Bras GF,Taubenslag KJ,Andl CD.The regulation of cell-cell adhesion during epithelial-mesenchymal transition,motility and tumor progression[J].Cell Adh M igr,2012,6(4):365-373.
[24]Stemm ler MP.Cadherins in development and cancer[J]. Mol Biosyst,2008,4(8):835-850.
[25]Sandig M,Voura EB,Kalnins VI,et al.Role of cadherins in the transendothelialmigration of melanoma cells in culture[J].Cell Moti Cytoskeleton,1997,38(4):351-364.
[26]Nakajima S,DoiR,Toyoda E,etal.N-cadherin expression and epithelial-mesenchymal transition in pancreatic carcinoma[J].Clin CancerRes,2004,10(12Pt1):4125-4133.
[27]翟明翠.N-cadherin与mn23-Hl在乳腺癌中的表达及意义[J].黑龙江医学,2010,34(8):561-563.
[28]Nalla AK,Estes N,Patel J,et al.N-cadherin mediates angiogenesis by regulating monocyte chemoattractant protein-1 expression via PI3K/Akt signaling in prostate cancer cells[J].Exp Cell Res,2011,317(17):2512-2521.
[29]Kamikihara Y,Ueno S,Natsugoe S.Clinical implications of N-cadherin expression in gastric cancer[J].Pathol Int,2012,62(3):161-166.
[30]Di Domenico M,Pierantoni GM,Feola A,et al.Prognostic significance of N-cadherin expression in oral squamous cell carcinoma[J].Anticancer Research, 2011,31(12):4211-4218.
[31]Chernyatina AA,Nicolet S,Aebi U,et al.Atomic structure of the vimentin central alpha-helical domain and its implications for intermediate filament assembly[J].Proc Natl Acad Sci USA,2012,109(34):13620-13625.
[32]董大海,赵军,孙立江,等.E钙黏着素与波形蛋白在膀胱癌中的表达及意义[J].现代泌尿外科杂志, 2010,15(1):22-24.
[33]Oikawa T.ETS transcription factors:possible targets for cancer therapy[J].Cancer Sci,2004,95(8):626-633.
[34]Gambarotta G,Boccaccio C,Giordano S,et al.Ets upregulates MET transcription[J].Oncogene,1996,13(9): 1911-1917.
[35]Dittmer J,Vetter M,Blumenthal SG,et al.Importance of ets1 proto-oncogene for breast cancer progression[J].Zentralbl Gynakol,2004,126(4):269-271.
[36]Li B,Shimizu Y,Kobayashi T,et al.Overexpression of ETS-1 is associated w ithmalignantbiological features of prostate cancer[J].Asian JAndrol,2012,14(6):860-863.
The correlation between expression of ETS-1 and E-cadherin,N-cadherin and Vimentin in non-smallcell lung cancer△
ZHOU Li-li1,4GEXin-guo2CAIMao-huai1#TANG Feng1ZHU Jian-feng3SUN Lin3LIXia3LIU Ju-lin1WANG Cai-lian4#
1Departmentof Oncology,2Departmentof Oncological Surgery,3Departmentof Pathology,the Second People's Hospitalof Yancheng/The Tumour Hospitalof Yancheng,Yancheng 224003,Jiangsu,China4DepartmentofOncology,Zhongda Hospital,MedicalCollegeof SoutheastUniversity,Nanjing 210009,Jiangsu,China
Objective To observe the expression between ETS-1 and neuronal cadherin(E-cadherin,N-cadherin) and Vimentin in non-small cell lung cancer(NSCLC)tissues and to study the clinical correlation of thosemolecules.Method 110 cases of NSCLC patients who had undergone surgical resection were confirmed pathologically and were included in this study,of which the tumor tissues and normal lung tissues thatwere at least 3 cm away from the tumor were selected.The immunohistochem istry SPmethod was used to detect the expression of ETS-1,E-cadherin,N-cadherin and Vimentin,then the correlation was investigated.Result In NSCLC tissues,the positive expression rate of ETS-1,N-cadherin and Vimentin[65%(72/110),56%(62/110),and 34%(37/110),respectively]were significantly higher than those in normal lung tissues[6%(3/50),8%(4/50),2%(1/50),respectively](all P<0.01);The positive expression rate of E-cadherin was 41%(45/110),which was significantly lower than the 84%(42/50)of normal lung tissues.The expression of ETS-1 was positively correlated w ith the lymph node metastasis and TNM staging(P<0.05),butwas not associated w ith gender,age,tumor diameter,histological type and differentiation degree(P>0.05).The expression of E-cadherin was negatively correlated w ith tumor differentiation degree,the lymph node metastasis and TNM staging(P<0.05).The expression of N-cadherin and Vimentin were positively correlated w ith tumor differentiation degree,the lymph node metastasis and TNM staging(P<0.05).The expression of E-cadherin,N-cadherin and Vimentin were not correlated w ith gender,age,tumor diameter and histological type(P>0.05).While the expression of ETS-1 was negatively correlated w ith E-cadherin but positively correlated w ith N-cadherin in NSCLC.Conclusion The expression of ETS-1,E-cadherin,N-cadherin and Vimentin are closely related w ith metastasis of NSCLC,thus the detection on the expression of those molecules w ill be effective in estimating the metastasis and prognosis of NSCLC.
ETS-1;mucins;vimentin;non-small cell lung cancer;neoplasmsmetastasis
R734.2
A
10.11877/j.issn.1672-1535.2015.13.05.11
盐城市医学科技发展计划项目(YK 2014032)
#通信作者(corresponding author),蔡茂怀e-mail:wangcailian65@hotmail.com;王彩莲e-mail:cmhyc001@163.com
2015-01-12)

