术前TTV、NLR及HBV-DNA定量对预测肝癌术后复发的价值
袁 琳 万 磊 陈佳佳 刘建军 阚和平 谭永法
大量临床数据表明,部分肝癌(hepatocellular carcinoma,HCC)患者肝癌切除术后短时间内就存在肿瘤复发。因此预测HCC患者术后肿瘤复发的风险对肝癌的综合治疗有重要意义。肿瘤总体积(total tumor volume,TTV)是描述肿瘤负荷的一项参数。有研究指出,TTV是HCC行肝移植术后肿瘤复发的相关因素,而且具有良好的预测肿瘤复发的能力[1]。HBV感染导致的慢性炎症反应是HBV相关性肝癌发生、发展的重要因素,作为反映机体慢性炎症反应的一项重要指标,中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)与多种恶性肿瘤的预后相关[2]。HBV-DNA(Hepatitis B virus-DNA)定量主要是用来判断人体内存在乙肝病毒的多少和传染程度,在一定程度上能反映HBV的复制活跃程度,HBV复制的活跃程度与肝癌切除术后复发有密切的关系[3]。本文通过研究180例行根治性肝癌切除术的HBV相关性HCC患者临床资料,旨在探讨TTV、术前血清NLR及HBV-DNA水平在预测HBV相关性HCC患者术后肿瘤复发的价值。
资料与方法
一、一般资料
回顾分析2009年1月至2011年7月在南方医科大学南方医院肝胆外科行根治性肝癌切除术的180例HBV相关HCC患者临床资料。其中男157例,女23例;年龄23~76岁,中位年龄49岁。术后病理均证实为原发性肝癌。入选标准:①HBsAg阳性患者;②肝功能Child-Pugh分级为A级或B级;③术前未行射频消融、介入、化学药物治疗和放射治疗;④术前无全身感染征象者;⑤手术为根治性肝癌切除术,术后病理切缘肿瘤阴性。收集包括年龄、性别、术前血清甲胎蛋白(AFP)水平、HBV-DNA、术前1周内血常规、肝功能及凝血功能等检验结果,影像学资料包括肿瘤大小、位置、个数、门静脉癌栓(PVTT)、腹水、肝硬化等情况。术后病理资料包括病理类型、肿瘤最大直径、血管侵犯、标本切缘情况等。随访方式为门诊复诊或电话随访,时间由手术当日开始。总生存时间计算:从术后至死亡或最后随访日。复发以影像学检查(B超、CT、MRI、肝动脉造影等)发现复发病灶为准。无瘤生存时间的计算:自手术至复发出现之日。随访截止日期为2014年8月1日。
二、研究方法
1.计算TTV及NLR
根据影像学数据评估术前肿瘤负荷,肿瘤体积计算方法:肿瘤体积(cm3)=4/3× 3.14× r3(r= 可测量肿瘤结节的最大半径)。肿瘤总体积等于各可测量病灶体积总和。NLR根据患者术前1周内外周血检验结果计算得出。
2.确定TTV、NLR 界值
分别绘制TTV、NLR用于预测肿瘤复发的受试者工作特征(ROC)曲线,采用约登指数分别确定TTV、NLR界值。
3.不同组间患者生存情况比较
根据界值将患者分为低TTV和高TTV组、低NLR组和高NLR组。HBV-DNA根据预设界值1 000 ng/mL分为低HBV-DNA及高HBA-DNA两组。分别比较上述各组间患者累积生存率和无瘤生存率差异。
4.独立危险因素分析
将患者性别,年龄,术前外周血NLR,术前血清AFP、ALT、AST、TB、ALB、TBIL、DBIL、PT 水 平 ,TTV、肝硬化、PPTV以及肿瘤数目等临床参数纳入COX比例风险回归模型进行单因素及多因素分析,选出独立危险因素。
三、统计学处理
采用SPSS13.0统计软件进行数据处理。生存分析采用Kaplan-Meier法和Log-rank检验,肿瘤复发相关的独立危险因素分析采用COX比例风险回归模型。以P<0.05为差异有统计学意义。
结 果
一、确定TTV、NLR预测肿瘤复发的界值
ROC曲线下分析得TTV及NLR用于预测肝癌行肿瘤切除术后肿瘤复发有统计学意义 (p<0.05)。TTV的ROC曲线下面积是0.769,95%可信区间为0.702~0.837,通过约登指数确定TTV用于预测肿瘤复发的界值为183.59 cm3时,其灵敏度为0.492,特异度为0.964。NLR的ROC曲线下面积是0.701,95%可信区间为0.623~0.778,通过约登指数确定NLR用于预测肿瘤复发的界值为2.215时,其灵敏度为0.637,特异度为0.679。见图1。
二、不同组间患者生存时间比较
分别根据TTV、NLR及HBV-DNA界值把患者分为低TTV组(TTV≤183.59 cm3)和高TTV组(TTV > 183.59 cm3);低 NLR 组(NLR≤2.215)和高NLR组 (NLR>2.215);低HBV-DNA组 (HBVDNA<1 000 ng/mL)和高HBV-DNA 组 (HBVDNA≥1 000 ng/mL)。低TTV组、低NLR组、低HBV-DNA组的无瘤生存率和累积生存率明显高于高TTV组、高NLR组、高HBV-DNA组,差异有统计学意义(p<0.05)。
三、肝癌患者行肿瘤切除术后肿瘤复发相关因素分析
通过COX回归模型单因素分析,肿瘤数目、PVTT、TTV>183.59 cm3、术前血清 AFP≥400μg/L、HBV-DNA≥1 000 ng/mL、NLR > 2.215、血小板计数(PLT)、直接胆红素水平(DBIL)水平为肿瘤复发相关因素,均p<0.05。将以上各参数纳入多因素分析,结果提示PVTT、TTV>183.59 cm3、术前NLR>2.215、PLT及DBIL水平是影响患者行肿瘤切除术后肿瘤复发的独立危险因素 (RR=4.048,2.329,1.866,1.004,1.072;P<0.05)。见表 1。

表1 影响肝癌切除术后肿瘤复发的单因素及多因素分析结果
讨 论
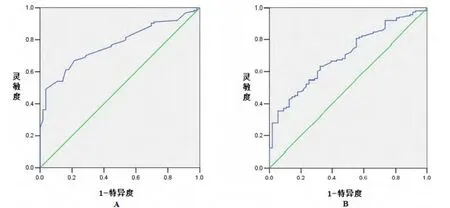
图1 TTV(A)与NLR(B)预测HBV相关HCC患者术后肿瘤复发的ROC曲线
研究指出,肿瘤的发生、转移与机体对肿瘤的免疫、炎症反应密切相关,肿瘤周围的许多基质细胞,包括胶质细胞、成纤维细胞、免疫和炎性细胞、血管细胞、平滑肌细胞等共同构成肿瘤微环境[4]。这些组成的基质细胞可以被肿瘤细胞诱导,产生大量的生长因子、细胞趋化因子和基质降解酶,促进肿瘤的发生、发展及转移。其中,中性粒细胞是重要的促进肿瘤发展的炎症细胞,其作用可能为:①分泌肿瘤血管内皮生长因子(VEGF)、肿瘤坏死因子(TNF)、白细胞介素(IL)-1、IL-4 等细胞因子促进肿瘤发展[5];②分泌基质金属蛋白酶9(MMP9)和基质金属蛋白酶13(MMP13)降解细胞外基质(ECM),增强肿瘤的侵袭能力[6];③产生活性氧、精氨酸酶等抑制T淋巴细胞介导的肿瘤免疫反应[7]。而淋巴细胞决定机体对肿瘤的免疫反应,淋巴细胞分泌的细胞因子及介导的细胞毒性作用能抑制肿瘤的增殖及转移[8]。Ohtani等认为,原发性肿瘤周围浸润的淋巴细胞数量增多是肿瘤预后较好的一个预测指标[9]。HBV相关性肝细胞癌的肿瘤细胞长期处于慢性炎症刺激的作用之下,作为一个评估中性粒细胞与淋巴细胞相对水平的免疫学指标,NLR能反映机体中促瘤性炎症反应与抗瘤性炎症反应的平衡关系。NLR比值的升高,意味着平衡向促瘤方向发展,增加肿瘤增殖、转移的风险。近年来,NLR已被研究指出是结直肠癌、原发性胃癌、非小细胞肺癌等恶性肿瘤预后的独立危险因素[2]。
目前临床上最常用的描述肿瘤负荷的指标是肿瘤最大直径。TTV是近几年新提出来的描述肿瘤负荷指标。相关文献报道,TTV为50~200 cm3、200~500 cm3和>500 cm3的肝癌患者的死亡风险分别比肿瘤总体积 <10 cm3的患者高出74%、115%和292%[10],提示TTV的大小与肝癌的预后有关。Toso等[1]研究指出,比起单纯用肿瘤数目及单个肿瘤大小来描述肝移植患者肿瘤负荷的Milan标准,TTV对于肿瘤负荷的衡量更为准确。而Teh等[10]认为,肿瘤总体积结合了肿瘤数目及大小两方面的特点,对肝癌肿瘤负荷的描述更为直观,尤其是瘤灶数目较多、不同病灶间体积差异较大时,肿瘤总体积更具有优势。
HBV主要通过基因整合、基因表达产物影响、免疫抑制等方式导致细胞癌变。HBV能将自身基因随机整合到宿主细胞内,导致染色体缺失、重复、异位及点突变,促进肝细胞癌变[11]。HBV-DNA是HBV感染最直接、灵敏度和特异度高的指标。HBVDNA高提示病毒复制强,复制活跃的HBV能增加肿瘤的发生与发展的风险。
本课题分别研究NLR、TTV及HBV-DNA水平与肿瘤复发的关系,发现TTV与术前NLR水平是影响HBV相关肝癌患者行手术切除术后肿瘤复发的独立危险因素,可作为预测肿瘤复发的相关指标。TTV>183.59 cm3、术前血清NLR>2.215患者预后较差,提示此部分患者也许可以通过介入治疗降低肿瘤负荷或增强免疫力、降低机体炎症反应等方法来改善预后。
1 Toso C,Trotter J,Wei A,et al.Total tumor volume predictsrisk of recurrencefollowing liver transplantation in patientswith hepatocellular carcinoma.Liver Transpl,2008,14(8):1107-1115.
2 Mallappa S,Sinha A,Gupta S,et al.Preoperativeneutrophil to lymphocyte ratio>5 is a prognostic factor for recurrent colorectal cancer.Colorectal Dis,2013,15(3):323-328.
3 丁晨,潘凡,胡还章,等.HBV DNA高载量的肝细胞癌患者肝癌根治术后抗病毒治疗疗效观察.临床肝胆病杂志,2014,30(7):656-659.
4 Sung SY,Hsieh CL,Wu D,et al.Tumor microenvironment promotes cancer progression,metastasis,and therapeutic resistance.Curr Probl Cancer,2007,31(2):36-100.
5 Kusumanto YH,Dam WA,Hospers GA,et al.Plateletsand granulocytes,in particular theneutrophils,form important compartmentsfor circulating vascular endothelial growth factor.Angiogenesis,2003,6(4):283-287.
6 Mueller MM,Fusenig NE.Friendsor foes-bipolar effectsof thetumour stromain cancer.Nat Rev Cancer,2004,4(11):839-849.
7 Ma Y,Xu YC,Tang L,et al.Cytokine-induced killer(CIK)cell therapy for patients with hepatocellular carcinoma: efficacy and safety.Exp Hematol Oncol,2012,1(1):11.
8 Keizman D,Ish-Shalom M,Huang P,et al.The association of pretreatment neutrophil to lymphocyteratio with responserate,progression free survival and overall survival of patients treated with sunitinib for metastatic renal cell carcinoma.Eur JCancer,2012,48(2):202-208.
9 Ohtani H.Focus on TILs:prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer.Cancer Immun,2007,7:4.
10 Huo TI,Hsu CY,Huang YH,et al.Prognostic prediction across a gradient of total tumor volume in patients with hepatocellular carcinoma undergoing locoregional therapy.BMC Gastroenterol,2010,10:146.
11 Studach L,Wang WH,Weber G,et al.Polo-like kinase 1 activated by the hepatitis B virus X protein attenuates both the DNA damage checkpoint and DNA repair resulting in partial polyploidy.JBiol Chem,2010,285(39):30282-30293.

