MRSA医院感染危险因素及分子流行病学调查
徐荣 张敏(宜春市人民医院检验科 宜春 336000)
MRSA医院感染危险因素及分子流行病学调查
徐荣*张敏
(宜春市人民医院检验科宜春336000)
目的:研究医院获得性耐甲氧西林金黄色葡萄球菌(HA-MRSA)感染的危险因素和耐药表型,并利用随机扩增DNA多态性PCR(RAPD-PCR)对菌株同源性进行分析。方法:以无感染者为对照,比较50例HA-MRSA感染者的年龄、基础疾病、住院时间、抗菌药物使用、免疫抑制剂使用和侵入性手术操作等感染相关因素。采用K-B法检测HA-MRSA的耐药表型。利用RAPD-PCR对50株HA-MRSA的基因同源性进行分析。结果:2种或7 d以上抗菌药物使用和住院时间延长(>12 d)是HA-MRSA的危险因素。HA-MRSA依据RAPD可分为Ⅰ~Ⅵ型,以Ⅰ型(40%)和Ⅲ型(26%)为主。RAPD分型相同菌株具有同样的耐药表型,Ⅴ型耐药最为严重。结论:为有效预防HA-MRSA感染,临床要注重合理选用抗菌药物,降低使用强度,并缩短病人住院时间。RAPD-PCR分型可为HA-MRSA的流行病学监控提供线索。
医院感染MRSA危险因素随机扩增DNA多态性
金黄色葡萄球菌抵抗力和致病力都很强,是医院感染最常见、最重要的病原菌之一。随着抗菌药物的广泛应用,环境选择压力下耐甲氧西林金黄色葡萄球菌(MRSA)感染率呈逐渐上升趋势,导致了患者病死率升高、住院期延长和医疗费用增加等问题[1]。因此,必须采取措施控制医院获得性耐甲氧西林金黄色葡萄球菌(HA-MRSA)的传播,指导临床合理使用抗菌药物。本研究旨在探讨HA-MRSA的易感因素,采用随机扩增DNA多态性PCR(RAPD-PCR)对我院分离的HAMRSA菌株进行分子流行病学分型,并调查其耐药表型。
1 材料与方法
1.1材料
1.1.1病例和菌株
收集我院2013年3月至2014年6月间出现的金黄色葡萄球菌医院感染病例和菌株,以50例HA-MRSA感染患者作为研究组,50例与研究组患者同科室、同期入院、无感染患者作为对照组。HA-MRSA感染患者筛选标准为入院时无感染或细菌培养未分离出金黄色葡萄球菌,2 d后才出现MRSA感染。
1.1.2仪器和试剂
DNA Engine PCR仪购自Bio-Rad公司,凝胶电泳仪和成像系统购自Tanon公司。K-B法药敏纸片购自杭州天和微生物有限公司,RAPD-PCR引物(5’-GAGAGGCCTCGCAGGCATGACCT-3’)、rTaq酶和DL2000 DNA Marker购自Takara公司。
1.2方法
1.2.1易感因素分析
根据预试验分析,调查研究组和对照组患者以下7种感染相关因素:①老龄(>65岁);②住院时间延长(>12 d);③基础疾病;④2种以上抗菌药物使用;⑤7 d以上抗菌药物使用;⑥免疫抑制剂使用;⑦2项以上侵入性手术操作。统计两组之间计数资料有无显著性差异,并计算比数比(odds ratio, OR)。统计软件为SPSS 13.0,方法采用多因素二分类Logistic回归,选入方程内变量的方法为“Enter”。
1.2.2耐药表型检测
参照CLSI 2012年标准,采用K-B法对从50例患者中分离到的50株HA-MRSA菌株的耐药表型进行检测,抗菌药物包括庆大霉素(GEN)、环丙沙星(CIP)、复方新诺明(SXT)、红霉素(ERY)和克林霉素(CLI)。
1.2.3RAPD分型
通过煮沸法[2]制备DNA模板,参照文献合成RAPDPCR引物[3]。反应体系(25 ml):MgCl22.5 mmol/L,dNTP 0.2 mmol/L,引物1.2 mmol/L,rTaq酶2.5 U,DNA模板约125 ng。反应过程:94℃预变性5 min;94℃1 min,36℃1 min,72℃2 min,35个循环;72℃10 min。PCR产物进行1.5%琼脂糖凝胶电泳,凝胶成像系统成像。
2 结果
2.1易感因素分析
对研究组和对照组各50例患者的感染相关因素符合率进行二分类Logistic回归分析(表1)。与对照组患者相比,HA-MRSA感染者的3个易感因素(P<0.05)依OR排序依次为:7 d以上抗菌药物使用(15)、2种以上抗菌药物使用(9.8)和住院时间延长(7.5)。

表1 两组感染相关因素符合率与Logistic回归分析(例)
2.2耐药表型检测
对50株HA-MRSA进行耐药表型检测(表 2),可分为A~D型,以A型和B型为主。A型耐药谱最窄,C型耐药谱最广。HA-MRSA对抗生素的耐药率从低到高依次为SXT(14%)、CIP(50%)、GEN(54%)、CLI(100%)和ERY(100%)。
2.3 RAPD分型
对50株HA-MRSA进行RAPD分型,48株菌(96%)得出清晰、稳定的谱带,谱带如有2条或2条以上条带不同就认为是不同菌株[4]。48株菌可分为Ⅰ~Ⅵ型(图1),以Ⅰ型(40%)和Ⅲ型(26%)为主。RAPD分型相同菌株具有相同的耐药表型,Ⅰ型和Ⅱ型的耐药表型为A型,Ⅲ型和Ⅳ型的耐药表型为B型,Ⅴ型和Ⅵ型的耐药表型则分别为C型和D型(表 3)。
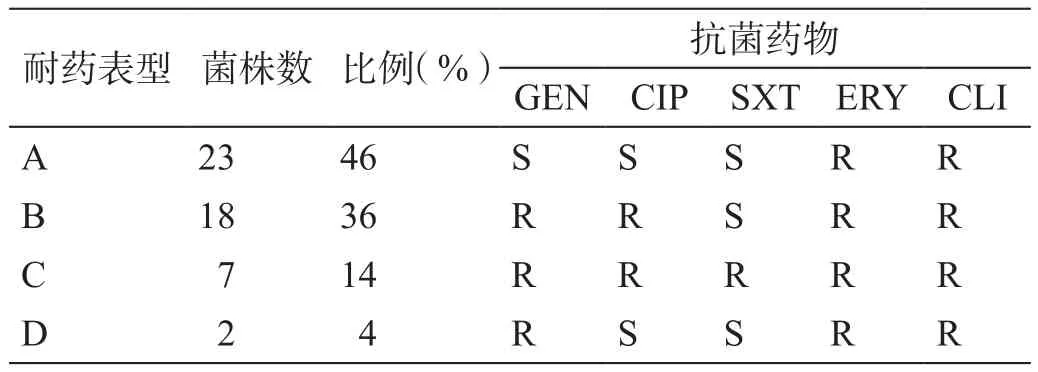
表2 50株HA-MRSA的耐药表型

图1 HA-MRSA菌株RAPD分型
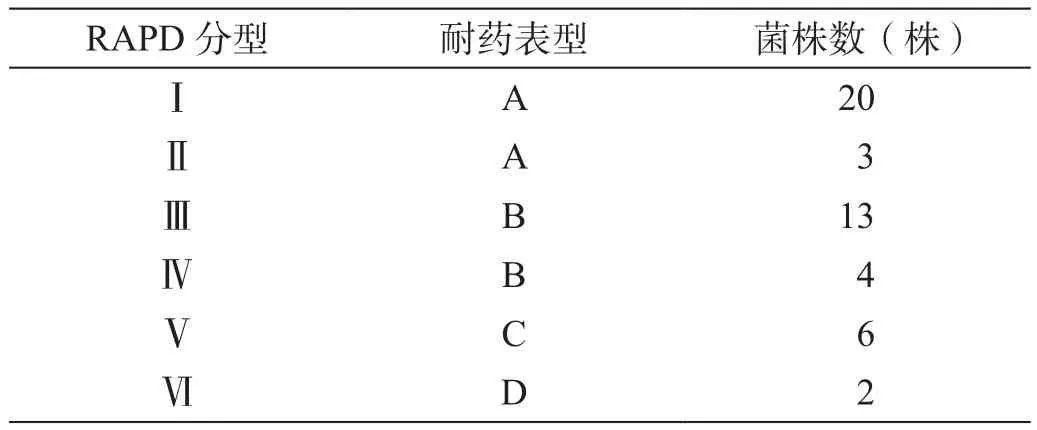
表3 RAPD分型与耐药表型的关系
3 讨论
HA-MRSA的感染可能的相关因素过去被认为可能包括年龄、基础疾病、住院时间延长、不规范使用抗菌药物、免疫抑制剂的使用和侵入性手术操作等[5]。对本院患者的调查分析显示,HA-MRSA的易感因素有住院时间延长(>12 d)、7 d以上抗菌药物使用和2种以上抗菌药物使用,其中7 d以上抗菌药物使用(OR=15)是最危险因素。数据进一步说明临床诊疗中必须依据药敏试验谨慎使用抗菌药物,并尽量缩短患者抗菌药物使用时间和住院时间。
耐药表型检测结果显示,本院HA-MRSA菌株耐药表型以A型(46%)和B型(36%)为主,有14%的菌株(C型)对分型用5种药物都耐药。可能由于本院药品采购目录无SXT,HA-MRSA对SXT的耐药率较低(<30%),但使用当中葡萄球菌对其易产生耐药性,建议临床在经验治疗HA-MRSA时仍应首选万古霉素。
葡萄球菌菌株分型方法主要有表型分型和基因分型二类,常用基因分型方法包括脉冲场凝胶电泳分型、RAPD分型、扩增片段长度多态性、多位点测序分型和spa基因分型等,其中RAPD分型因操作简便和成本低廉而被广泛应用于局域流行菌株的监测[3,6-10]。本院50株HA-MRSA采用RAPD分型方法可分为Ⅰ~Ⅵ型,RAPD分型相同菌株具有同样的耐药表型,说明在流行病学调查方面,其分辨率要高于耐药表型分型,可为HA-MRSA的流行病学监控提供线索。
[1] Drebes J, Künz M, Pereira CA, et al. MRSA infections: from classical treatment to suicide drugs [J]. Curr Med Chem, 2014, 21(15): 1809-1819.
[2] 黄晖, 安如俊, 周建党, 等. 移植患者呼吸道金黄色葡萄球菌感染的分子流行病学[J]. 中华医院感染学杂志, 2008, 18(2): 189-191.
[3] 卞彩云, 路永红, 周培媚, 等. 178例儿童脓疱疮皮损中金黄色葡萄球菌药敏及随机扩增多态性DNA分析[J]. 中华皮肤科杂志, 2012, 45 (11): 767-770.
[4] 曹晶晶, 王玫, 孔宪玺, 等. 分型方法结合DL MRSA Library数据库研究MRSA医院感染[J]. 中华临床感染病杂志, 2011, 4(2): 96-100.
[5] 黎映静, 廖九中, 曾茹, 等. 医院MRSA感染危险因素分析[J]. 临床和实验医学杂志, 2012, 11(13): 1029-1030.
[6] 李鹏, 刘军辉, 王淑梅. 耐甲氧西林金黄色葡萄球菌的基因多态性分型研究[J]. 西安交通大学学报(医学版), 2010, 31(6): 777-781.
[7] Mehraj J, Akmatov MK, Strömpl J, et al. Methicillin-sensitive and methicillin-resistant Staphylococcus aureus nasal carriage in a random sample of non-hospitalized adult population in northern Germany[J]. PLoS One, 2014, 9(9): e107937. doi: 10.1371/journal.pone.0107937.
[8] 吕国平, 李丽婕, 芦飞, 等. 食源性金黄色葡萄球菌脉冲场凝胶电泳分型分析[J]. 微生物学杂志, 2013, 33(4): 55-59.
[9] 贺文强, 陈宏斌, 赵春红, 等. 2010—2011年中国10个主要城市金黄色葡萄球菌分子流行病学研究[J]. 中华微生物学与免疫学杂志, 2013, 33(4): 247-251.
[10] Oppliger A, Moreillon P, Charrière N, et al. Antimicrobial resistance of Staphylococcus aureus strains acquired by pig farmers from pigs[J]. Appl Environ Microbiol, 2012, 78(22): 8010-8014.
Susceptible factors and molecular epidemiological investigation of MRSA nosocomial infection
XU Rong*, ZHANG Min
(Clinical Laboratory, The People’s Hospital of Yichun City, Yichun 336000, China)
Objective: To study the susceptible factors, drug-resistant phenotype and gene homology of hospitalacquired methicillin-resistant Staphylococcus aureus (HA-MRSA). Methods: Infection-related factors in 50 patients infected with HA-MRSA were investigated and analyzed, and the results were compared with those of the patients without infection. Drugresistant phenotypes of HA-MRSA were determined by K-B method. Gene homology of HA-MRSA was analyzed using RAPDPCR. Results: Use of antibacterial drugs more than 2 kinds or for over 7 days and prolonged hospitalization were the susceptible factors of HA-MRSA. HA-MRSA could be divided into typeⅠ~Ⅵ based on RAPD-PCR. TypeⅠand Ⅲaccounted for 40% and 26%. The isolated strains with same gene homology showed the same drug-resistant phenotype, in which the strains with typeⅤwere the most seriously resistant to the tested antibacterials. Conclusion: Great attention should be paid to the reasonable use of antimicrobial agents, reducing the intensity of their medication, and shortening the time for hospital stay in order to effectively prevent HA-MRSA infection. RAPD-PCR can provide effective technical support for epidemiological surveillance of HA-MRSA.
hospital infection; MRSA; susceptible factor; RAPD
R515.9; R378.11
B
1006-1533(2015)15-0033-03
徐荣(1985-),男,主管技师,从事临床微生物学研究。E-mail: rong.xunc@aliyun.com
2015-03-23)

