H1N1 亚型猪流感病毒 HA1 基因原核表达及鉴定
阮宝阳,王 林,宫晓倩,汪秀会,刘晓敏,汪 琪,单同领,李泽君,刘芹防,陈鸿军,滕巧泱,童光志,于 海
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 山东农业大学动物科技学院,泰安271000)
H1N1 亚型猪流感病毒 HA1 基因原核表达及鉴定
阮宝阳1,2,王 林2,宫晓倩1,汪秀会1,刘晓敏1,汪 琪1,单同领1,李泽君1,刘芹防1,陈鸿军1,滕巧泱1,童光志1,于 海1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 山东农业大学动物科技学院,泰安271000)
本研究利用RT-PCR技术扩增禽源H1N1亚型猪流感病毒(Swine influenza virus,SIV)的HA1基因片段,将其连接至pCold-TF载体上,菌液鉴定为阳性的克隆经测序验证正确后,提取质粒转化至高表达的表达宿主菌BL21(DE3)中,经IPTG诱导并大量表达目的蛋白。表达产物经过纯化及SDS-PAGE电泳分析,表明重组蛋白以可溶性形式在上清中大量表达,大小约90 kDa,且在 15℃、0.8mmol/L IPTG 条件下诱导 24 h 表达效果最好。通过 Ni 柱纯化后,经 Western blot 分析表明重组表达的蛋白能与禽源 H1N1 亚型 SIV 阳性血清发生特异性反应,具有较好的反应原性。
HA1 基因;禽源 H1N1 亚型猪流感病毒;原核表达;可溶性;抗原性
猪流感病毒(Swine infiuenza virus,SIV)属于正粘病毒、A型流感病毒属的分节段的负链RNA病毒,是引起猪呼吸道疾病的一种重要病原体。猪流感(swine influenza,SI)很少直接引起死亡,但多与其他疾病,如猪繁殖与呼吸障碍综合征、传染性胸膜肺炎、猪链球菌等并发或继发感染,使病情复杂化和严重化,导致死亡率升高。研究发现猪的呼吸道上皮细胞同时具有禽流感病毒受体和人流感病毒受体[1,2],因此猪被称为新型流感病毒产生的“混合器”和流感病毒跨越种间宿主屏障的重要“中间宿主”[3,4]。
HA蛋白是介导病毒与细胞表面结合的主要成分,是流感最重要的保护性抗原。它是由3个血凝素蛋白聚合在一起形成的三聚体结构,呈头茎结构,其中头部由HA1亚单位组成,是重要的病毒受体结合位点和抗原决定簇区域[5],而HA2是HA基因的高度保守区域[5,6]。本研究通过开展构建禽源H1N1亚型SIV的HA1蛋白原核表达及抗原性分析的研究,为进一步建立间接 ELISA 检测方法提供基础材料,并为防控SI提供有力的检测工具。
1 材料与方法
1.1 病毒株 禽源H1N1亚型SIV分离株A/Swine/ Shanghai/1/2014(H1N1)由本实验室分离、鉴定和保存。病毒在 MDCK 细胞上增殖,细胞呈现明显病变效应(cytopathic effect, CPE)后,收集细胞上清备用。
1.2 菌株、载体及主要试剂 克隆宿主菌DH5α、表达宿主菌BL21(DE-3)购自天根生物技术有限公司;表达载体pCold-TF由本实验室保存;IPTG购自Invitrogen公司;限制性内切酶 Sac I 和 Xba I 购自大连宝生物工程有限公司;病毒RNA提取试剂盒购自QIAGEN公司;引物由骏生物公司合成;辣根酶标记山羊抗小鼠lgG购自北京中杉金桥生物公司;6~8周龄雌性BALB/c老鼠购自斯莱克实验动物有限公司。
1.3 引物的设计与合成 根据禽源H1N1亚型SIV的HA1基因序列,设计一对特异性引物,并加上有效的酶切位点和保护性碱基。上游引物:CGAGCTCGACA CCATTTGTGTAGGC;下游引物:GCTCTAGATCT GGATTGAATAGAGGG(下划线是限制性内切酶Sac I和Xba I 酶切位点,加在前面的是保护性碱基)。
1.4病毒RNA提取及目的基因的RT-PCR扩增 按TRlzol试剂盒使用说明书提取病毒RNA,并反转录合成cDNA,通过RT-PCR进行目的片段HA1的扩增,PCR反应条件:95℃预变性1 min;95℃变性20 s,48℃退火20s,72℃延伸1min,30个循环;72℃再延伸10min。扩增后的核酸产物经1%琼脂糖凝胶电泳鉴定,并进行产物回收。
1.5 HA1基因的克隆和重组表达质粒pCold-TF-HA1的构建 将HA1基因的PCR产物胶回收后经Sac I 和Xba I 双酶切,连接转化大肠杆菌DH5α感受态细胞,克隆至 pCold-TF 载体中,菌液经 PCR 鉴定,阳性菌液送英骏生物公司测序。将测序正确的阳性菌液扩增,提取质粒并转化至表达宿主菌BL21(DE3)感受态细胞中,重组表达质粒命名为pCold TF-HA1。
1.6 重组质粒的诱导表达及 SDS-PAGE 分析 挑取单菌落在37℃、200 r/min 水平摇床上增菌培养,当菌液浓度活化至OD600达0.6左右,加入不同浓度的IPTG,将菌液转入15℃、200 r/min 水平摇床上,不同时间点收集菌液,经SDS-PAGE 分析,确定IPTG 的最佳诱导浓度和最佳诱导时间。
1.7 重组蛋白的纯化 将大量增殖的菌液10 000×g 离心10 min,弃上清;按照25:1 的体积比用冰浴预冷的1×结合缓冲液重悬菌体,加入蛋白酶抑制剂,进行超声破碎;将裂解产物14000×g离心20 min,分离上清和沉淀,上清液经0.45 µm滤膜过滤,收集的上清液按照His-Tag融合蛋白纯化操作手册进行重组蛋白的纯化。
1.8 重组蛋白的Western blot鉴定 将纯化后的重组蛋白进行SDS-PAGE鉴定,转印到硝酸纤维素(NC)膜,用5%脱脂奶粉封闭1h;H1N1亚型SIV的小鼠阳性血清作为一抗,4℃摇床上孵育过夜,用PBST漂洗纤维素膜3次,每次10 min;以辣根酶标记山羊抗小鼠lgG为二抗,常温孵育1.5h,PBST漂洗纤维素膜3次,每次10 min,最后经ECL发光试剂发光后暗室显影成像。
2 结果
2.1 目的基因的扩增及重组表达质粒pCold TF-HA1的构建 通过RT-PCR扩增HA1片段,产物经1%琼脂糖凝胶电泳,结果显示片段大小为981bp,与目的片段大小一致(图1)。通过PCR对菌液鉴定后(图2),将阳性的菌液送去测序,结果显示HA1正确连接到pCold TF载体上。

图1 HA1基因 RT-PCR 扩增产物Fig.1 The RT-PCR products of HA1 gene

图2 重组表达质粒 pCold TF-HA1 的菌液鉴定Fig.2 Identification of recombinant plasma pCold TF-HA1 in E.coli
2.2 转化菌的诱导表达和重组蛋白的SDS-PAGE 分析经过大量诱导表达,超声破碎菌液,分离得到的上清和沉淀进行8% SDS-PAGE 鉴定,结果表明重组目的蛋白大部分以可溶性的上清形式存在,以包涵体形式表达很少(图3)。IPTG的最佳诱导浓度为0.8 mmol/L,诱导时间为24 h(图3),可以大量表达目的蛋白,表达的蛋白大小约90kDa,其中目的蛋白约36 kDa,标签蛋白大小约52 kDa,与预期结果相一致。
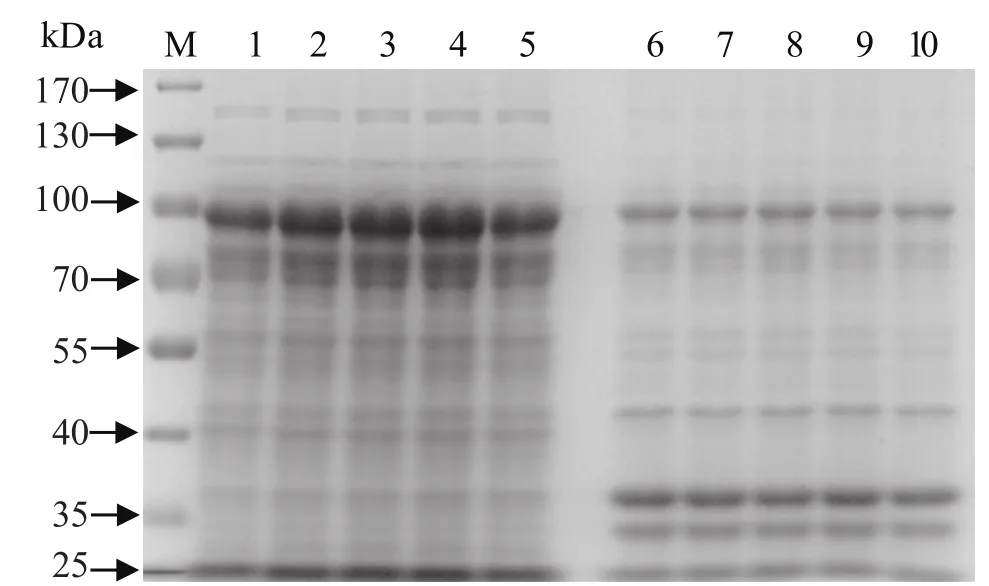
图 3 重组蛋白表达可溶性分析Fig. 3 Soluble analysis of recombinant HAI protein in E.coli
2.3 重组蛋白的纯化 表达出的可溶性蛋白通过Ni柱纯化,用1×Ni-NTA漂洗缓冲液连续漂洗4次,洗脱液分别做SDS-PAGE分析(图4),结果表明目的蛋白已被纯化。

图 4 重组蛋白的纯化Fig.4 The purification of recombinant protein
2.4 重组蛋白的 Western blot 分析 以H1N1亚型SIV的鼠阳性血清作为一抗,进行Western blot反应时出现明显条带,而以阴性血清作为一抗没有出现条带,同样诱导空载体表达蛋白与阴性、阳性血清进行蛋白免疫印迹反应均没有出现条带(图5)。可见重组目的蛋白具有良好的特异性。

图 5 重组蛋白 的 Western blot 分析Fig.5 Western blot analysis of the recombinant protein
3 讨论
虽然SIV感染猪导致的死亡率低,但是发病率高,而且极易引起其他病毒和细菌的混合感染[7],使疫情变得更为复杂。目前H1NI亚型流感病毒在我国的猪群中常年流行[8]。2007年,起源于欧洲的禽源H1NI亚型SIV在我国猪群中被发现,随后在国内猪群中广泛流行[9],这些病原在猪群中通过基因重组产生新的SIV基因型,其分布和进化也越来越复杂。我国拥有全球60%以上的猪群养殖,庞大的猪群与传统的畜禽混养的养殖模式都为新亚型或新基因型流感病毒的产生提供了机会[10],因此加强对猪群中禽源H1N1亚型SIV的检测并及时掌握SI流行规律意义重大。
本研究中原核表达的HA1蛋白大多以上清可溶形式表达,包含了原有蛋白的部分空间构象,具有较好的免疫原性[11]。同时带有His标签的重组蛋白通过Ni柱纯化后可得到大量纯化的蛋白,这为蛋白的纯化提供方便。Western blot 结果表明,重组的HA1蛋白与禽源H1N1亚型SIV免疫小鼠所制备的阳性血清反应明显,作为一抗的阳性血清稀释5000倍后仍然能显现出明显的阳性条带,表明重组得到HA1蛋白具有很强的特异性。由于HA1是HA蛋白重要的病毒受体结合位点和抗原决定簇区域,因此研究流感病毒的HA1位点的抗原性在疫苗的研究和发展中具有重要意义[12]。同时重组的蛋白可以用于SI抗体水平的检测,为今后建立检测猪流感抗体的间接ELISA方法奠定了坚实的物质基础[13]。
[1]Castrucci M R, Donatelli I, Sidoli L, et al. Genetic reassortment between avian and human influenza A viruses in Italian pigs[J]. Virology, 1993, 193(1): 503-506.
[2]Ma W, Kahn R E, Richt J A. The pig as a mixing vessel for influenza viruses: Human and veterinary implications[J]. J Mol Genet Med, 2008, 3(1):158-166.
[3]孙向东.流感病毒研究进展[J].医学研究杂志, 2011, 40(12): 25-27.
[4]Neummann G, Noda T, Kawaoka Y. Emergence and pandemic potential of swine-origin H1N1 influenza virus[J]. Nature, 2009, 459(7249): 931-939.
[5]杨帅,朱闻婓,舒跃龙.猪流感病毒概述[J].病毒学报,2013,29(3): 330-335.
[6]Shortridge K F, Webster R G. Geographical distribu-tion of swine(Hsw1N1) and Hong Kong (H3N2) influenza virus variants in pigs in Southeast Asia[J]. Intervirology, 1979,11(1): 9-15.
[7]Gutiérrez-Martín C B, Rodríguez-Delgado O,Alvarez-Nistal D, et al. Simultaneous serological evidence of Actinobacillus pleuropneumoniae, PRRS, Aujeszky's disease and influenza viruses in Spanish finishing pigs[J]. Res Vet Sci, 2006, 68(1): 9-13.
[8]刘天强,于海,张强. H3N2 亚型猪流感病毒血凝素基因的原核表达及间接ELISA诊断方法的建立[J].中国预防兽医学报, 2008, 30(10): 795-799.
[9]Vijaykrishna D, Smith G J, Pybus O G, et al. Long-term evolution and transmission dynamics of swine influenza A virus[J]. Nature, 2011, 473(7348): 519-522.
[10]Sawada T, Hashimoto T, Tokia H, et al. Ab initiobase fragement molecular or bital studies of influenza viral hemagglutinin HA1 full-domains in complex with sialoside receptors[J]. J Mol Genet Med, 2008, 3(1):133-142
[11]Verma S, Dimitrova M, Munjal A, et al. Oligomeric recombinant H5 HA1 vaccine produced in bacteria protects ferrets from homologous and Heterologous wild-typeH5N1 influenza challenge and controls viral loads better than Subunit H5N1 vaccine by eliciting high-affinity antibodies[J]. J Virol, 2012, 86(22): 12283-12293.
[12]Chiu F F, Venkatesan N, Wu C R, et al. Immunological study of HA1 domain of hemagglutinin of influenza H5N1 virus[J]. Biochem Biophys Res Commun, 2009, 383(1): 27-31.
[13]张敦伟,熊永忠,远立国,等. H3N2 亚型犬流感病毒HA1基因的原核表达及抗原性分析[J].中国预防兽医学报,2011, 33(2):157-159.
PROKARYOTIC EXPRESSION AND ANTIGENIC ANALYSIS OF HA1 GENE OF AVIAN-LIKE H1N1 SUBTYPE SWINE INFLUENZA VIRUS
RUAN Bao-yang1,2, WANG Lin2, GONG Xiao-qian1, WANG Xiu-hui1, LIU Xiao-min1,WANG Qi1,SHAN Tong-ling1, LI Ze-jun1, LIU Qin-fang1, TENG Qiao-yang, CHEN Hong-jun1,
TONG Guang-zhi1, YU Hai1
(1.Shanghai Veterinary Research Institute, CAAS, Shanghai 2002411, China; 2.College of Veterinary Medicine,Shandong Agricultural University, Taian 271000, China)
To express HA1 protein of H1N1 Subtype Swine influenza virus(SIV), the HA1 gene was amplified by RT-PCR and cloned into vector pCold-TF. After being sequenced, the recombinant plasmid was transformed into expression host strain DL21(DE3) then IPTG was added to induce expression. The expressed HA1 fusion protein was purified by Nickel colum and analyzed by SDS-PAGE. The results indicated that recombinant protein was expressed in soluble condition in the supernatant and was about 90 kDa in size. The optimum condition for the expression was that the bacteria was induced for 24 h under the conditions (15℃ and 0.8m mol/L IPTG). The result in Western blot of purified recombinant protein showed that the HA1 protein had good antigenicity, and could berecognized by SIV positive serum.
HA1 gene; H1N1 subtype Swine influenza virus(SIV);prokaryotic expression; soluble; antigenicity
S852.659.5
A
1674-6422 (2015)04-0014-05
2014-04-09
国家青年自然科学基金(31201916);上海市自然科学基金青年项目(12ZR1453500);中央级公益性科研院所基本科研业务费项目(2015JB07);中国农业科学院创新工程科研团队“动物流感病毒病原生态学”项目
阮宝阳,男,硕士研究生,临床兽医学专业
童光志, E-mail:gztong@shvri.ac.cn;于海, E-mail:haiyu@shvri.ac.cn

