油桐乙酰辅酶A羧化酶BC亚基全长cDNA克隆及序列分析
王 哲,谭晓风,龙洪旭
(中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004)
油桐乙酰辅酶A羧化酶BC亚基全长cDNA克隆及序列分析
王 哲,谭晓风,龙洪旭
(中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004)
以葡萄桐的近成熟种子为材料,根据油桐转录组测序结果设计引物,采用RT-PCR技术克隆了油桐乙酰辅酶A羧化酶BC亚基基因的全长cDNA序列。该基因cDNA序列全长1 605 bp,编码534个氨基酸。推导出的BC亚基氨基酸序列蛋白的等电点pI为7.98,相对分子量58 262.0 Da,稳定系数为38.13,生物信息学分析表明,此蛋白含有2个比较明显的跨膜区,是一个不稳定的非分泌蛋白。模体搜索结果表明在BC上具有ATP结合位点。三级结构中有16个α螺旋,3个部分形成一个内凹的结构。
油桐;乙酰辅酶A羧化酶;BC亚基;基因克隆;序列分析
油桐Vernicia fordii属大戟科Euphorbiaceae油桐属Vernicia,油桐原产于中国,是我国特有的经济林木,与油茶、核桃、乌桕并列为我国四大木本油料植物[1]。桐油是优质干性油,具有干燥快、光泽度高、附着力强、绝缘性能好、耐酸耐碱、防腐防锈等优良性能[2],是制造涂料和油漆的重要生产原料,也是制造生物柴油和改性高分子材料的优质原料。
桐油是甘油三酯的混合物,经测定,桐油中的的脂肪酸有9种,主要成分有6种,即棕榈酸、硬脂酸、油酸、亚麻酸和酮油酸[3]。软脂酸与硬脂酸属于饱和脂肪酸,仅占脂肪酸总量的约5%,其余7中为不饱和脂肪酸,约占总量的94%。其中,仅桐酸就占脂肪总量80%左右,是桐油的主要成分,决定着桐油化学性质。而以桐酸为主的7种不饱和脂肪酸,分别带有1~3个共轭双键,化学性质非常活泼,极易氧化干燥,聚合成薄膜,从而具有绝缘、耐酸等特性。同时,其开键结构也特别有利于各类官能团的引入,能聚合形成数万种桐油族化合物[4]。
油脂的合成是从乙酰辅酶A羧化酶(ACCase)催化乙酰辅酶A生成丙二酰辅酶A开始的[5],丙二酰辅酶A是脂肪酸合成和脂酰链延伸系统等重要代谢的底物[6],是脂肪酸合成中C2单位的供体,并且在脂肪酸氧化反应中起到调节线粒体穿梭系统的作用[7],乙酰辅酶A羧化酶被认定是生物体内的一个基本代谢底物和调控特定蛋白活性的调控因子[8]。所以乙酰辅酶A羧化酶催化反应不仅是第一和关键的步骤,同时也是限速步骤[9]。ACCase在反应过程中起到携带和转移羧基的作用。反应式如下:
ATP+acetyl-Coenzyme A+HCO3-= ADP+Pi+malonyl-Coenzyme A
自然界中的ACCase可分为两种形式。一种是原核型,也称多亚基或异质型ACCase,存在于细菌、双子叶植物和非禾本科单子叶植物的细胞质中[10],它是植物从头合成脂肪酸的限速酶和关键酶[11],包括生物素羧化酶(BC,又称accC)亚基、生物素羧基载体蛋白(BCCP,又称accB)亚基、α-羧基转移酶(α-CT,又称 accA),β-羧基转移酶(β-CT,又称 accD)四种亚基。以(BCCP)4(BC)2(α-CT)2(β-CT)2的复合体形式存 在[12]。 另一种ACCase 称为真核型,亦称多功能或同质型,只存在于真核生物中。它的肽链中含有三个功能结构域,即生物素羧化酶、生物素羧基载体蛋白和羧基转移酶,能够与原核形式的ACCase催化相同的反应,它主要在质体中起催化作用,这种ACCase一般以二聚体的形式存在[13]。一些研究结果表明,ACCase的BC、BCCP、β-CT、α-CT亚基中任何一个亚基的基因超量表达可提高种子的含油率[14-18],因此分离克隆这4个亚基基因对于调控油桐的脂肪酸生物合成具有重要理论意义和实用价值。
本实验室于2012年对不同发育时期的油桐种子进行了转录组测序,从分子水平来找出油脂合成途径中的重要基因,分析明油桐油脂合成基本规律,为油桐的分子育种奠定基础。
1 材料与方法
1.1 实验材料
采用的油桐近成熟种子来自于湖南省永顺县青坪镇中南林业科技大学永通实验基地,国家油桐种质资源保存库。2012年8月底采集葡萄桐近成熟种子为实验材料,保存于-80℃冰箱中。
大肠杆菌Trans-T1感受态细胞、pEASY-Blunt Simple Cloning Kit、2×EasyTaq PCR SuperMix 购自全式金公司,PureLinkTM RNA Mini Kit购自Invitrogen公司,高保真DNA聚合酶PrimeSTAR HS DNA Polymerase、100 bp Plus DNA Ladder购自Takara公司,琼脂糖凝胶DNA回收试剂盒购自天根公司,无水乙醇、异丙醇等均为分析纯。
1.2 实验方法
1.2.1 油桐种子总RNA的提取和cDNA的合成
油桐种子总RNA的提取参照Invitrogen公司的PureLinkTM RNA Mini Kit试剂盒的方法进行。琼脂糖凝胶电泳检测RNA的提取效果。采用TaKaRa公司的cDNA合成试剂盒,方法参照试剂盒说明书,得到第一链cDNA。
1.2.2 油桐ACCase基因BC亚基的克隆
油桐转录组测序结果中获得BC亚基的全长序列,其开放阅读框长为1 605 bp。利用Primer Premier 5软件设计引物,上游引物(BCF1),5'-TTGGATTTCAAGAATGGAGGCTACA-3';下游引物(BCR1),5'-TATCTATCATCTATCTAAGCCG TTG-3'。以葡萄桐近成熟种子反转录的单链cDNA为模板,进行PCR扩增。PCR反应体系(20μL):5×Preme STAR Buffer(Mg2+)4μL,dNTP Mixture 1.6μL,上下游引物(10 μmol)各0.4μL,模板cNDA 0.4μL,Prime STAR HS 0.2μL,dH2O 13μL。扩增条件:94℃ 5min,94℃ 30 s,63.4℃ 30 s,72℃ 90 s,30个循环;72℃ 10min;4℃Forever。将PCR产物用琼脂糖凝胶DNA回收试剂盒回收,回收产物与pEASY-Blunt Simple载体连接,并转化大肠杆菌Trans-T1感受态细胞,均匀涂抹在含有氨苄青霉素的LB平板上,37℃培养8h,挑取单菌落,37℃摇菌过夜。菌液作PCR检测,将阳性结果送至北京六合华大基因公司测序。
1.2.3 生物信息学分析
用NCBI的BLAST功能(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜索同源的核苷酸序列及氨基酸序列;用Vector NTI 10.0软件将BC亚基与其他物种的氨基酸进行比对并构建BC的系统进化树;用在线软件ProtParam(http://web.expasy.org/protparam/)计算BC的分子量、等电点、分子式、不稳定系数、脂肪系数;用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)检 测 信号肽序列;用在线软件protscale(http://expasy.org/tools/protscale.html)分析疏水性;用在线软件 TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)进行跨膜结构预测;用在线软 件 SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白质二级结构;用ESyPred3D Web Server 1.0(http://webapps.fundp.ac.be/esypred/)预测蛋白质三级结构。
2 结果与分析
2.1 目的基因全长cDNA克隆
以葡萄桐近成熟种子反转录的单链cDNA为模板,用特异性引物(BCF1、BCR1)进行扩增,将回收的目的片段连接到pEASY-Blunt Simple上,转化大肠杆菌Trans-T1感受态细胞,检测获得阳性克隆后测序(见图1)。
2.2 BC亚基序列的生物信息学分析
2.2.1 BC核苷酸序列分析
对BC的全长cDNA测序结果进行分析,发现与油桐转录组ACCase基因的BC亚基完全吻合,CDS长1 605 bp,编码534个氨基酸,将BC亚基CDS序列在NCBI中的 Blastn进行比对,列入表1中。从表1可以看出,BC亚基序列与麻疯树和蓖麻的相似度最高,达到92%。

图1 油桐BC基因PCR扩增结果Fig.1 PCR ampli fi cation results of BC gene from Vernicia fordii

表1 油桐BC全长cDNA序列的Blastn结果Table 1 Blastn result of full-length cDNA of BC from Vernicia fordii
2.2.2 BC蛋白质序列分析
用Vector NTI 10.0软件与其他12个物种的氨基酸序列进行多序列比对,结果如图2所示。由图2可以看出,不同物种的BC亚基相似性较高,中间和C端的保守型很强,N端的保守型很弱。用Vector NTI 10.0软件构建BC亚基的进化树,结果如图3所示。发现BC与麻疯树、蓖麻位于同一进化枝上,亲缘关系最为接近。
用在线软件ProtParam对BC蛋白质的理化性质进行分析,结果表明,BC蛋白质分子量为58 262.0 Da;理论等电点为7.98,其中负电荷氨基酸残基数目(Asp+Glu)为61,正电荷氨基酸残基(Arg+Lys)的数目为63;分子式可写成:C2578H4125N721O763S26;280nm光吸收值为0.504;该蛋白在大肠杆菌中半衰期大于10h;不稳定系数为38.13,划分为不稳定蛋白;脂肪系数:86.40。
在SignalP 4.1 Server网站提交BC的氨基酸序列,进行信号肽预测,结果表明BC中不存在信号肽切割位点,是一个非分泌蛋白。
用在线软件protscale对BC进行亲水性分析,结果如图4所示,该蛋白的疏水指数从-2.644 至2.078,约在第97、134、331、458位表现出较强的疏水性,在第44、273、305、306、392位表现出较强的亲水性。亲水指数为-0.164。
为了对BC进行跨膜结构预测,将BC的氨基酸序列提交到Tmpred网站,图5直观地给出了BC蛋白的跨膜区域,该蛋白有2个比较明显的跨膜区:一个是323~343位氨基酸的跨膜区,跨膜方向由内向外,另一个由外向内的跨膜区位于327~347位氨基酸。

图2 油桐与其他物种的BC氨基酸序列对比结果Fig.2 Comparison results of BC amino acid sequences of Vernicia fordii and other plants

图3 BC蛋白质水平进化树Fig.3 Phylogenetic tree on BC protein level
将BC氨基酸序列与SMART网站的数据库进行比对,找出相应的功能结构域。405~511位氨基酸是生物素羧化酶C端结构域;323~333位氨基酸为低复杂性序列。70~179位氨基酸和184~383位氨基酸具有氨甲酰磷酸合酶结构域的特征,188~359位氨基酸是ATP的结合区域。
SOPMA网站预测BC蛋白质中α螺旋结构占39.51%,延伸主链占17.98%,β折叠占8.99%,无规则卷曲占33.52%。
在SWISS-MODEL中找到了金黄色酿脓葡萄球菌(编号2vpqB)的BC蛋白与油桐BC蛋白的三级结构最为相似,其中73~513位氨基酸与2vpqB相似度最高,相似度达到54%,故以此作为预测BC蛋白质三级结构模板。在ESyPred3D中提交BC氨基酸序列和参考模板(2vpqB),得到油桐BC蛋白质三级结构(见图6)。由图6中可以看出,BC中有16个α螺旋,中间有一个凹陷的结构,推测这个凹陷是蛋白质结合生物素的位置。

图4 油桐BC蛋白质疏水性分析Fig.4 Hydrophobicity analysis of BC protein from Vernicia fordii
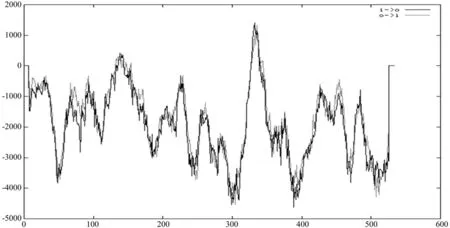
图5 Tmpred对油桐BC的跨膜区预测结果Fig.5 Prediction results of Tmpred prediction on BC of Vernicia fordii

图6 BC蛋白质三维结构模型Fig.6 Three-dimensional structure of BC from Vernicia fordii
3 结论与讨论
本文根据实验室构建的葡萄桐转录组数据,设计特异性引物,以cDNA为模板,克隆了ACCase基因的BC亚基,并对其进行一系列生物信息学分析。从BC氨基酸序列与不同物种对比结果可以看出,从80位到530位氨基酸,各物种同源性很高,与其他植物的同源性都在85%以上,而BC蛋白质的生物素羧化酶C端结构域、ATP结合区域等结构域均位于此同源性高的区域,其中,ATP结合位点是ACCase最保守的区域之一。从进化树可以看出,油桐BC亚基与麻疯树、蓖麻在同一进化枝上,这也与氨基酸比对结果相一致。由预测的三级结构来看,BC亚基是有3部分形成的内凹形结构,结合BC亚基在乙酰辅酶A羧化反应中是起到的作用来看,推测这个内凹形结构是结合生物素的位置。本文还对油桐BC亚基的理化性质及二级结构进行了分析,发现无论是理化性质还是二级结构,都与麻疯树、蓖麻BC亚基相似。
而包括BC亚基在内的由ACCase三个核基因组编码的亚基BC、BCCP和α-CT在N端都具有转移肽序列,它们表达的前体蛋白被分别运送到叶绿体中,随后除去转移肽,与质体基因组编码的β-CT亚基组装成高分子量的复合体,就具有了多亚基ACCase的催化活性。多亚基ACCase的催化活性,主要是通过以下几个方面起到调控作用:(1)BCCP亚基的生物素酰化作用;(2)核基因编码的BC、BCCP和α-CT 三个亚基的定位、运输以及与质体基因编码的β-CT亚基的装配;(3)异质型ACCase的可逆磷酸化作用;(4)异质型ACCase催化活性的生物化学调节(光暗、PH、Mg2+、NADPH等)。本文为以后油桐ACCase基因的研究工作提供了理论依据和科学基础,而油桐BC蛋白对ACCase酶活性及种子含油率的影响还有待进一步开展研究。
[1] 谭晓风.油桐的生产现状及其发展建议[J].经济林研究,2006,24(3):62-64.
[2] 孙 颖,卢彰显,李建安.中国油桐栽培利用与应用基础研究进展[J].经济林研究,2007,25(2):84-87.
[3] 方嘉兴,何 方.中国油桐[M].北京:中国林业出版社,1998:130-134,332-324.
[4] 何 方,何 柏,王承南,等.油桐产品质量等级标准制订说明[J].经济林研究,2005,23(4):118-122.
[5] 王伏林.植物中的乙酰辅酶A羧化酶[J].植物生理学通讯,2006,42(1):10-14.
[6] Konishi T,Shinohara K,Yamada K,et al.Acetyl-coA carboxylase in higher plants:most plants other than Gramineae have both the prokaryotic and the eukaryotic forms of this enzyme[J].Plant Cell Physiology,1996,37:117-122.
[7] 韩春春,王继文,魏守海.乙酰辅酶A羧化酶(ACC)的结构与功能[J].安徽农业科学,2006,34(3):413-414.
[8] 赵虎基,王国英.植物乙酰辅酶A羧化酶的分子生物学与基因工程[J].中国生物工程杂志,2003,23(2):12-16.
[9] Herbert D,Walker KA,rice L J,et al.Acetyl-CoA carboxylaseagraminicide target site[J].Pesticide Science,1997,50(1):67-71.
[10] Cronan J E,Waldrop G L.Multi-subunit acetyl-CoA carboxylases[J].Prog.Lipid Research,2002,41(5):407-435.
[11] Thelen J J,Ohlrogge J B.Metabolic engineering of fatty acid biosynthesis in plants[J].Metab Eng,2002,4(1):12-21.
[12] Sasaki Y,Nagano Y.Plant acetyl-CoA carboxylase:structure,biosynthesis,regulation,and gene manipulation for plant breeding[J].Biosci.Biotechnology Biochemy,2004,68(6):1175-1184.
[13] Roesler K R,Shorrosh B S,Ohlrogge J B.Structure and expression of an Arabidopsis acetyl-coenzyme A carboxylase gene[J].Plant Physiology,1994,105(2):611-617.
[14] Gengenbach.Transgenic plants expressing maize acetyl-CoA carboxy-lase gene and methods of altering oil content[J].United States Patent,2001,(4):6,222.
[15] Roesler K,Shintani D,Savage L,et al.Targeting of the Arabidopsis homomeric zcetyl-coenzyme A carboxylase to plastids of rapeseeds[J].Plant Physiology,1997,113:75-81.
[16] Davis M S,Solbiati J,Cronan JE.Overprodution of acetyl-CoA carboxy-lase activity increases the rate of fatty acid biosynthesis in Escherichia coli[J].Biol.Chem.,2000,275(37):28593-28598.
[17] Ohlrogge.Methods of increasing oil content of seeds[J].United States Patent,5,925,805,1999-7-20.
[18] 朱炳耀,杨志敏,庄志鸿,等.不同区域小油桐种质差异与ISSR分子标记研究[J].中南林业科技大学学报,2013,33(4):13-16.
Cloning and sequence analysis of BC gene from Vernicia fordii
WANG Zhe,TAN Xiao-feng,LONG Hong-xun
(Key Lab.of Non-wood Forest Products of State Forestry Administration,Central South University of Forestry and Technology,Changsha 410004,Hunan,China)
With nearly ripe Puputung tree seeds as the tested materials,the primers were designed according to the results of the transcriptome sequencing analysis of Vernicia fordii,anda full-length cDNA of BC gene was cloned by RT-PCR technique from nearly ripe seed in Vernicia fordii.The cDNA sequence length of BC gene is 1605 bp,encoding 534 amino acids.BC protein’s isoelectric point(pI)is 7.98 and the molecular mass of the protein is 58262.0 Da,it’s stability factor is 38.13.According to bioinformatics analysis,the protein bears two trans-membrane domains,and isa unstable protein.There isa ATP-grasp fold pro fi le in BC.There are 16 alpha helixes in the tertiary structure and there isa hollow concave structure in the central of this protein.
Vernicia fordii;ACCase;BC subunits;gene cloning;sequence analysis
S794.3
A
1673-923X(2015)03-0053-06
10.14067/j.cnki.1673-923x.2015.03.011
2014-01-10
国家林业公益性行业科研专项重点项目(201204403)
王 哲,硕士研究生
谭晓风,教授,博士生导师,E-mail:tanxiaofengcn@126.com
王 哲,谭晓风,龙洪旭.油桐乙酰辅酶A羧化酶BC亚基全长cDNA克隆及序列分析[J].中南林业科技大学学报,2015,35(3):53-58.
[本文编校:吴 毅]

