OGTT 0.5 h血糖切点值在诊断糖尿病及糖尿病前期中的临床意义
刘乐 于会宁 郭晓坤 张红梅 黄姣红 冯凭
·论著·
OGTT 0.5 h血糖切点值在诊断糖尿病及糖尿病前期中的临床意义
刘乐 于会宁 郭晓坤 张红梅 黄姣红 冯凭
目的 确定口服葡萄糖耐量试验(OGTT)负荷后0.5 h血糖(0.5 hPG)诊断糖尿病和糖尿病前期(preDM)的切点值及0.5 hPG与β细胞功能、胰岛素敏感性的关系。方法 4 351名受试者行OGTT,以2008年美国糖尿病协会(ADA)糖代谢异常诊断标准为参考标准,应用受试者工作特征(ROC)曲线分析0.5 hPG诊断糖尿病和preDM的切点值。将受试人群先按照2008年ADA糖代谢异常诊断标准分为正常糖耐量组(NGT组)、preDM组、糖尿病组,再按研究得出的切点值将NGT组中0.5hPG<诊断preDM切点值者作为N-NGT组,0.5hPG≥诊断preDM切点值者则为H-NGT组;将preDM组中0.5 hPG<诊断糖尿病切点值者作为N-preDM组,0.5 hPG≥诊断糖尿病切点值者则为H-preDM组。比较5组的血糖、胰岛素水平、胰岛素敏感性、早时相及总时相胰岛素分泌功能等指标,并进行0.5 hPG与上述指标的相关性分析。结果 以2008年ADA糖尿病诊断标准为参考标准,由ROC得出诊断糖尿病最佳的0.5 hPG切点值为10.79mmol/L,灵敏性为80.6%,特异性为86.1%,曲线下面积0.92±0.00;以2008年ADA关于preDM的诊断标准为参考标准,得出诊断preDM最佳的0.5 hPG切点值为8.69mmol/L,灵敏性为74.7%,特异性为70.9%,曲线下面积0.79±0.01。随着糖代谢异常的进展,5组的早时相胰岛素分泌指数、30 min处置指数(DI30)及总时相胰岛素分泌指数、120 min处置指数(DI120)、稳态模型评估-胰岛 β 细胞分泌指数(HOMA-β)逐渐下降(F=412.25~2 113.02,P 均<0.01),而稳态模型评估-胰岛素抵抗指数(HOMA-IR)逐渐升高(F=151.78,P<0.01)。0.5 hPG与 HOMA-β(r=-0.69)、胰岛素生成指数(r=-0.71)、Matsuda胰岛素敏感指数(r=-0.21)、早时相胰岛素分泌指数(r=-0.48)、总时相胰岛素分泌指数(r=-0.54)、DI30(r=-0.62)、DI120(r=-0.70)呈负相关(P均<0.01),与HOMA-IR呈正相关(r=0.34,P<0.01)。结论 0.5 hPG≥10.79mmol/L可诊为糖尿病,8.69mmol/L≤0.5 hPG<10.79mmol/L可诊为preDM。0.5 hPG在一定程度上可反映胰岛素敏感性及胰岛β细胞功能,随着0.5 hPG的升高,胰岛素敏感性逐渐下降,早时相胰岛素分泌缺陷亦逐渐加重,这种相关性独立于胰岛素敏感性。
糖尿病;口服葡萄糖耐量试验;0.5 h高血糖;胰岛素分泌早时相;胰岛素抵抗
2010年全国糖尿病患病率及血糖控制情况的流行病学调查显示,依据2010年美国糖尿病协会(ADA)诊断标准我国成人2型糖尿病患病率已达11.6%,糖尿病前期(preDM)的患病率高达50.1%,我国已成为名副其实的糖尿病大国[1]。因此,糖尿病的预防成为非常重要的公共卫生问题。在临床工作中发现一部分患者口服葡萄糖耐量试验(OGTT)0.5h血糖(0.5hPG)较高,但空腹及OGTT 2h血糖(2hPG)未达到诊断糖尿病或preDM的标准,此类人群的诊断以及其胰岛β细胞功能及胰岛素敏感性等问题尚不明确。本文旨在探讨OGTT 0.5 hPG在糖尿病及preDM诊断中的切点值及其与胰岛β细胞功能及胰岛素敏感性之间的关系。
1 对象与方法
1.1 观察对象 选取2013年1月至2014年12月于天津医科大学总医院门诊行OGTT的受试者共4 351名,所有研究对象均为既往未诊断过糖尿病,或已知糖尿病但未用药物干预者,除外严重的心、肝、肾疾病、贫血、应激、酮症、高渗状态、恶性肿瘤、妊娠及其他相关内分泌代谢疾病。依据2008年ADA诊断标准,分为正常糖耐量组(NGT组)共1 363名,男性 587名,女性 776名,年龄(48.3±15.2)岁;preDM组共998名,男性498名,女性500名,年龄(49.4±14.5)岁;糖尿病组共1 990例,男性1 002例,女性988例,年龄(52.1±16.1)岁。
1.2 研究方法 OGTT根据世界卫生组织的规定,受试者前1天晚餐后禁食8~14h,空腹采血后于5min内饮250~500ml含75 g葡萄糖水。服糖前、服糖后0.5 h、1 h、2 h及3 h抽取血样,检测血糖和胰岛素浓度。血糖检测采用自动化葡萄糖氧化酶法,胰岛素检测采用化学发光法,试剂盒购自德国拜耳公司。
1.3 诊断标准[2]根据2008年ADA关于糖尿病及preDM的诊断标准:空腹血糖<5.6mmol/L且2hPG<7.8mmol/L诊断为NGT,5.6mmol/L≤空腹血糖<7.0 mmol/L和(或)7.8mmol/L≤2hPG<11.1mmol/L诊断为preDM,有典型糖尿病症状者且随机血糖≥11.1mmol/L或空腹血糖≥7.0mmol/L或2 hPG≥11.1mmol/L,诊断为糖尿病,如无典型糖尿病症状者需另日复查方可诊断。再按照0.5hPG的切点值,将NGT组中0.5hPG<诊断preDM切点值者分为N-NGT组,0.5 hPG≥诊断preDM切点值者则为H-NGT组;将preDM组中0.5 hPG<诊断糖尿病切点值者分为N-preDM组,0.5 hPG≥诊断糖尿病切点值者则为H-preDM组。
1.4 计算公式 稳态模型评估-胰岛β细胞分泌指数(HOMA-β)=20×空腹胰岛素(FINS)/(空腹血糖-3.5);稳态模型评估-胰岛素抵抗指数(HOMA-IR)=空腹血糖×FINS/22.5;胰岛素生成指数=(30min胰岛素-空腹胰岛素)/(30min血糖-空腹血糖);Matsuda胰岛素敏感指数(ISIm)=10 000/(空腹血糖×FINS×OGTT平均血糖值×OGTT平均胰岛素值)1/2;早时相胰岛素分泌指数=(FINS+30min胰岛素)/(空腹血糖+30min血糖);总时相胰岛素分泌指数=(FINS+2×30min胰岛素+3×60min胰岛素+2×120min胰岛素)/(空腹血糖+2×30min血糖+3×60min血糖+2×120min血糖);处置指数评价校正胰岛素敏感性的β细胞功能,即30min处置指数(DI30)=早时相胰岛素分泌指数×ISIm,120 min处置指数(DI120)=总时相胰岛素分泌指数×ISIm。
1.5 统计学处理 采用SPSS 17.0统计软件进行分析。所有正态分布的计量资料均以±s表示,多组间均数比较采用方差分析,组内两两比较采用LSD法。采用受试者工作特征曲线(ROC)分析,以1-特异性作为横坐标、灵敏性作为纵坐标,将不同0.5hPG水平对糖尿病、preDM识别的灵敏性和特异性画曲线,以正确指数(正确指数=灵敏性+特异性-1)最大的0.5 hPG,即曲线最靠近左上角的点作为最佳切割点,ROC曲线下面积>0.5的情况下,曲线下面积越接近于1.0诊断准确性好,在0.9以上具有较好的准确性。相关分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 应用ROC计算0.5 hPG诊断preDM及糖尿病切点值 应用ROC分析,以2008年ADA糖尿病诊断标准作为参考标准,0.5 hPG诊断糖尿病的最佳切点值为10.79mmol/L,灵敏性为80.6%,特异性为86.1%,正确指数为0.67,曲线下面积为0.92±0.00;0.5 hPG诊断preDM的最佳切点值为8.69mmol/L,灵敏性为74.7%,特异性为70.9%,正确指数为0.46,曲线下面积为0.79±0.01。
应用2008年ADA糖代谢异常诊断标准及研究所得0.5h PG切点值分组后,N-NGT组1 021名,H-NGT组342名,N-preDM组791名,H-preDM组207名,糖尿病组1 990例。
2.2 OGTT各时点血糖、胰岛素及各参数比较 随着糖代谢异常的进展,5组的血糖水平及葡萄糖曲线下面积依次升高(P<0.01),见表1。其中H-NGT组的 0.5 hPG较 N-preDM组高(P<0.01),然而H-NGT组的1 hPG较N-preDM组低,但两组间差异无统计学意义(P>0.05)。
表1 OGTT各时点血糖及葡萄糖曲线下面积的比较(±s,mmol/L)
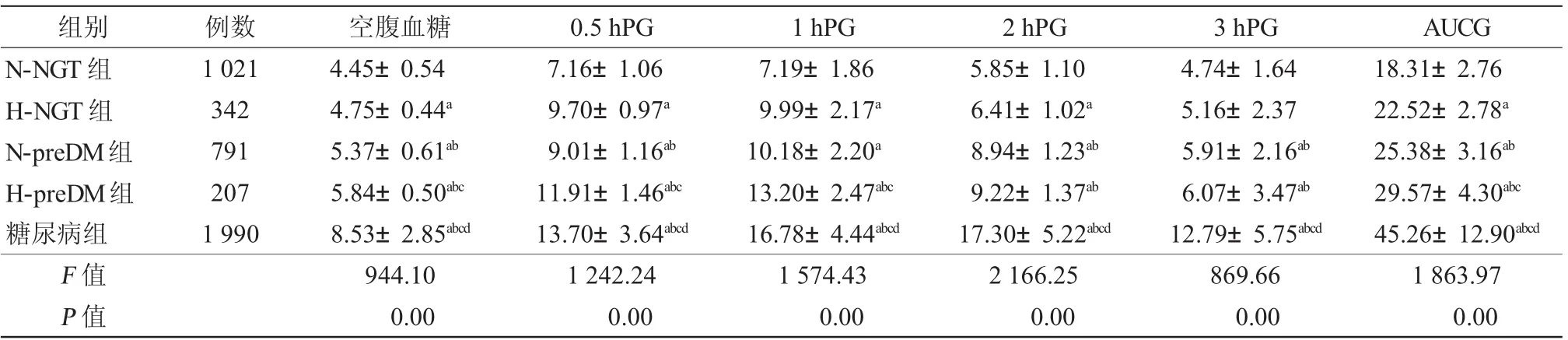
表1 OGTT各时点血糖及葡萄糖曲线下面积的比较(±s,mmol/L)
注:N-NGT组:0.5 hPG<8.69 mmol/L的正常糖耐量组;H-NGT组:0.5 hPG≥8.69 mmol/L的正常糖耐量组;N-preDM组:0.5 hPG<10.79mmol/L的糖尿病前期组;H-preDM组:0.5 hPG≥10.79mmol/L的糖尿病前期组;OGTT:口服葡萄糖耐量试验;0.5 hPG:OGTT 0.5 h血糖;1 hPG:OGTT 1 h血糖;2 hPG:OGTT 2 h血糖;3 hPG:OGTT 3 h血糖;AUCG:OGTT的葡萄糖曲线下面积;与N-NGT组相比,a P<0.05;与H-NGT组相比,b P<0.05;与 N-preDM组相比,c P<0.05;与 H-preDM组相比,d P<0.05
随着糖代谢异常的进展,5组的胰岛素水平及胰岛素曲线下面积逐渐降低(P<0.01),且胰岛素高峰逐渐后延,H-NGT组胰岛素分泌高峰在1 h,N-preDM组则在2 h,且低于H-NGT组。糖尿病组FINS水平低于其他4组(P<0.01),而其他4组间FINS水平相近,差异无统计学意义(P>0.05)。0.5 h胰岛素在N-NGT组与H-NGT组、N-preDM组与H-preDM组间无差异(P>0.05),1 h胰岛素在N-NGT组与N-preDM组、H-NGT组与H-preDM组间无差异(P >0.05),见表2。
表2 OGTT各时点血清胰岛素及胰岛素曲线下面积的比较(±s,m IU/L)

表2 OGTT各时点血清胰岛素及胰岛素曲线下面积的比较(±s,m IU/L)
注:N-NGT组:0.5 hPG<8.69 mmol/L的正常糖耐量组;H-NGT组:0.5 hPG≥8.69 mmol/L的正常糖耐量组;N-preDM组:0.5 hPG<10.79mmol/L的糖尿病前期组;H-preDM组:0.5 hPG≥10.79mmol/L的糖尿病前期组;FINS:空腹胰岛素;0.5 hINS:OGTT 0.5 h胰岛素;1 hINS:OGTT 1 h胰岛素;2 hINS:OGTT 2 h胰岛素;3 hINS:OGTT 3 h胰岛素;AUCINS:OGTT的胰岛素曲线下面积;与N-NGT组相比,a P<0.05;与H-NGT组相比,b P<0.05;与N-preDM组相比,c P<0.05;与H-preDM组相比,d P<0.05
随着糖代谢异常的进展,5组的HOMA-β、胰岛素生成指数、早时相胰岛素分泌指数、总时相胰岛素分泌指数、ISIm以及 DI30、DI120依次降低(P<0.01),而HOMA-IR逐渐升高(P<0.01),见表3。
2.3 0.5hPG与反映糖代谢各参数的相关分析 0.5hPG与HOMA-IR呈正相关,与HOMA-β、早时相胰岛素分泌指数、总时相胰岛素分泌指数、胰岛素敏感指数及 DI30、DI120呈负相关(P均<0.01,表4)。
表3 各组胰岛β细胞功能及胰岛素敏感性各指数的比较(±s)
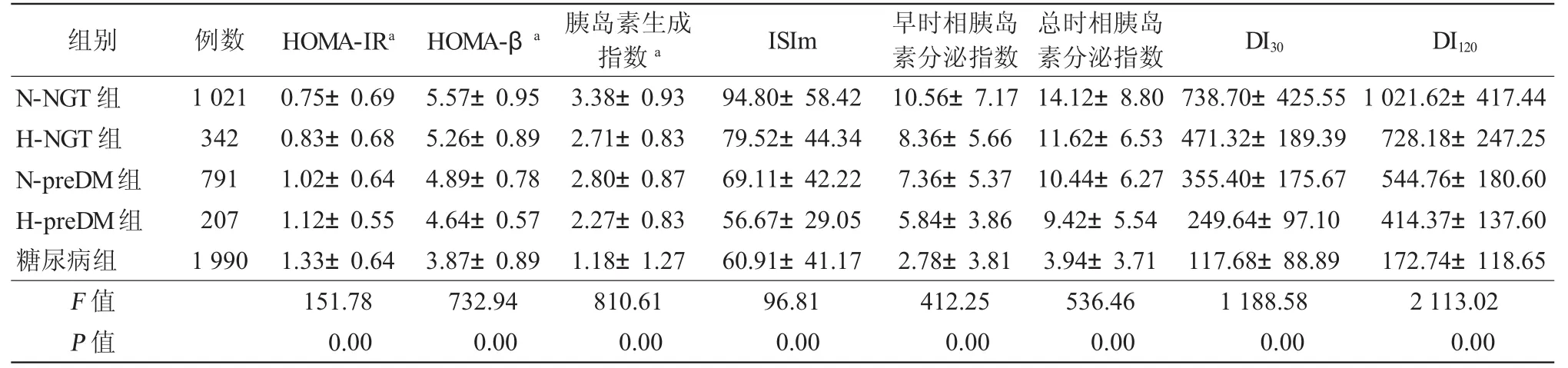
表3 各组胰岛β细胞功能及胰岛素敏感性各指数的比较(±s)
注:N-NGT组:0.5 hPG<8.69 mmol/L的糖耐量正常组;H-NGT组:0.5 hPG≥8.69 mmol/L的糖耐量正常组;N-preDM组:0.5 hPG<10.79mmol/L的糖尿病前期组;H-preDM组:0.5 hPG≥10.79mmol/L的糖尿病前期组;HOMA-IR:稳态模型评估-胰岛素抵抗指数;HOMA-β:稳态模型评估-胰岛β细胞分泌指数;ISIm:Matsuda胰岛素敏感指数;DI30:30min处置指数;DI120:120min处置指数;a:经自然对数转换,LSD法各组间两两比较P均<0.01
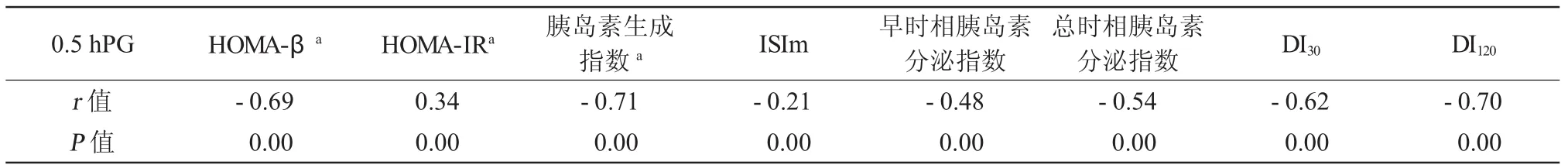
表4 0.5 hPG与胰岛β细胞功能、胰岛素敏感性各指数的相关性分析
3 讨论
OGTT不仅可以反映机体对于葡萄糖负荷后的血糖水平,还能够提供胰岛β细胞分泌功能及胰岛素敏感性等相关信息[3]。OGTT所测得的每个数值都应有其相应的临床意义,空腹及2 hPG已作为糖代谢异常的诊断指标,1 h血糖亦作为妊娠糖尿病的筛查和诊断标准,同时笔者既往研究表明1 h血糖在一定程度上反映了胰岛β细胞的功能及胰岛素抵抗程度[4]。但在临床工作中会遇到0.5 hPG水平较高,但空腹血糖及2 hPG均不能诊断糖代谢异常者,因此确定0.5 hPG诊断糖尿病及preDM的切点值及0.5 hPG与胰岛β细胞功能及胰岛素敏感性的关系就成为亟待解决的问题。
本研究以2008年ADA糖尿病诊断标准作为参考标准,应用ROC得出0.5 hPG诊断糖尿病的切点值为10.79mmol/L,曲线下面积为0.92±0.00,诊断效力较高;诊断preDM的切点值为8.69mmol/L,曲线下面积为0.79±0.01,也具有较好的诊断准确性,此结果表明无论OGTT其他时点血糖数值是否达到诊断标准,可以视0.5 hPG≥10.79mmol/L者为糖尿病,8.69mmol/L≤0.5 hPG<10.79mmol/L者为preDM,这一结论可以充实糖代谢异常的诊断标准。有研究得出0.5 hPG诊断preDM的切点值为9.7mmol/L,70岁以上人群的切点值为10.2mmol/L,0.5 hPG诊断糖尿病的切点值为11.2mmol/L[5-6]。Lin等[7]的横断面研究发现去除其他混杂因素,相对于0.5 hPG<7.8mmol/L的NGT人群来说,0.5 hPG≥7.8mmol/L的NGT人群发生心电图明尼苏达编码异常风险增加 37.1%(优势比 =1.371,95%CI:1.055~1.780),0.5 hPG<11.1 mmol/L 的糖调节异常人群的风险增加 70.3%(优势比 =1.703,95%CI:1.203~2.410),而 0.5 hPG≥11.1mmol/L的糖调节异常人群的风险增加181.8%(优势比=2.818,95%CI:1.717~4.626),提示各组人群中高0.5 hPG者发生心血管疾病的风险增加。另有一项纳入2 457名受试者的横断面流行病学研究也显示,0.5 hPG每增加1.92mmol/L,其发生糖尿病和心血管疾病的风险明显增加,且增加的风险独立于空腹血糖、餐后2 h血糖、年龄、性别、吸烟等危险因素[8]。由此可以看到高0.5 hPG人群发生糖尿病及心血管事件风险均增加,因此应该更加重视对于0.5 h高血糖人群的诊断与治疗。
糖尿病是胰岛β细胞功能减退和胰岛素抵抗共同作用所导致糖、脂代谢紊乱的一种慢性疾病。本研究采用ISIm作为评价胰岛素敏感性的指标,早时相胰岛分泌指数代表早时相胰岛β细胞功能,总时相胰岛分泌指数代表总的胰岛β细胞分泌功能,而处置指数则评价校正胰岛素敏感性后的β细胞功能[9-14]。本研究结果表明随糖代谢异常的发展,胰岛素高峰逐渐后延,HOMA-IR依次增加,ISIm逐渐降低,说明早时相的胰岛素分泌功能逐渐下降,胰岛素敏感性下降,胰岛素抵抗程度逐渐加重。早时相胰岛素分泌指数、DI30及总时相胰岛素分泌指数、DI120、HOMA-β逐渐下降,提示随着糖代谢恶化程度的加剧,β细胞早时相分泌功能及β细胞代偿分泌功能逐渐下降,且在校正胰岛素敏感性后β细胞早时相分泌功能及总分泌功能依然呈现逐渐下降的趋势,提示0.5 h高血糖可能是糖代谢异常进展过程中的一个中间阶段。周文敬等[15]发现在NGT人群中,0.5 hPG或1 h血糖>10mmol/L人群相对于血糖正常者存在胰岛素抵抗和胰岛β细胞功能减退。Bacha等[16]研究也发现,NGT、空腹血糖受损、糖耐量减低、糖尿病人群的第一时相胰岛素分泌和胰岛素敏感性逐渐下降。但本研究发现H-NGT组0.5 hPG、0.5 h胰岛素高于N-preDM组,随后H-NGT组的1 h胰岛素升高使得1 h血糖低于N-preDM组,这一现象可能与H-NGT组的1 h胰岛素分泌较N-preDM组更多有关,提示H-NGT组的胰岛β细胞可能具有更强的代偿能力,处于疾病进程的更早期。在相关分析中发现0.5 hPG与HOMA-β、ISIm、早时相分泌指数、总时相分泌指数及DI30、DI120呈负相关,与HOMA-IR呈正相关,说明0.5hPG随着胰岛素抵抗的加重而升高;相反,随着胰岛素敏感性增强、早时相及总时相胰岛β细胞分泌功能增强,0.5 hPG逐渐降低,进一步在校正胰岛素敏感性后0.5 hPG仍随着早时相及总时相β细胞分泌功能的增强而降低。由此提示胰岛素抵抗及胰岛β细胞早时相分泌功能下降共同作用可能是导致0.5 hPG升高的原因。在相关分析中DI30、DI120与0.5 hPG相关性更密切,提示胰岛β细胞分泌功能下降对于0.5 hPG升高可能起着更为重要的作用。张明亮等[17]应用高糖钳夹技术评价高糖喂养小鼠胰岛细胞功能,也证实小鼠糖耐量减低初期,主要是胰岛β细胞第一时相胰岛素分泌减弱所致,并非外周胰岛素敏感性改变引起。本研究表明0.5 hPG水平在一定程度上可以反映胰岛β细胞早时相分泌功能及胰岛素抵抗程度,高0.5 hPG可能是糖代谢进展过程的中间阶段,在既往认识的NGT→preDM→糖尿病的疾病进程中,0.5 hPG更加细化了对于疾病的认识。
OGTT各时间点的血糖及胰岛素水平均代表其相应的临床意义,虽然目前0.5 hPG不作为糖代谢异常的诊断标准,但其在一定程度上反映了胰岛β细胞的功能及胰岛素抵抗程度,可以作为糖代谢诊断标准的一项重要补充,且本研究表明0.5 h高血糖者的早时相胰岛分泌功能在病程的进展中起到更重要的作用,应提起重视。本研究存在样本例数有限且无长期随访等不足,期待更大规模的长期随访研究进一步证实0.5 hPG在糖代谢异常中的临床意义。
[1]Xu Y,Wang L,He J,et al.Prevalence and control of diabetes in Chinese adults[J].JAMA,2013,310(9):948-959.
[2]American Diabetes Association.Standards of medical care in diabetes-2008[J].Diabetes Care,2008,31(Suppl 1):S12-S54.
[3]Levy JC,Matthews DR,Hermans MP.Correct homeostasismodel assessment(HOMA)evaluation uses the computer program[J].Diabetes Care,1998,21(12):2191-2192.
[4]刘乐,冯凭.OGTT 1小时切点血糖在筛查糖尿病及糖调节受损中的临床意义[J].中国糖尿病杂志,2010,3:204-206.
[5]Zhou W,Gu Y,Li H,et al.Assessing 1-h plasma glucose and shape of the glucose curve during oral glucose tolerance test[J].Eur JEndocrinol,2006,155(1):191-197.
[6]Zhou W,Li H,Gu Y,et al.The ROC analysis for different time points during oral glucose tolerance test[J].Diabetes Res Clin Pract,2006,72(1):88-92.
[7]Lin L,Chen G,Zou X,et al.Diabetes,pre-diabetes and associated risks on Minnesota code-indicated major electrocardiogram abnormality among Chinese:a cross-sectional diabetic study in Fujian province,southeast China[J].Obes Rev,2009,10(4):420-430.
[8]Chen G,Zou X,Yao J,et al.The correlation between the oral glucose tolerance test30-minutesplasma glucose and risk factors for diabetes and cardiovascular diseases:a cross-sectional epidemiological study of diabetes in Fujian Province in the South-East of China[J].JEndocrinol Invest,2011,34(5):e115-e120.
[9]Stancáková A,Javorsky M,Kuulasmaa T,et al.Changes in insulin sensitivity and insulin release in relation to glycemia and glucose tolerance in 6,414 Finnish men[J].Diabetes,2009,58(5):1212-1221.
[10]Matsuda M,DeFronzo RA.Insulin sensitivity indices obtained from oral glucose tolerance testing:comparison with the euglycemic insulin clamp[J].Diabetes Care,1999,22(9):1462-1470.
[11]Snehalatha C,Ramachandran A,Sivasankari S,et al.Insulin secretion and action show differences in impaired fasting glucose and in impaired glucose tolerance in Asian Indians[J].DiabetesMetab Res Rev,2003,19(4):329-332.
[12]Retnakaran R,Shen S,Hanley AJ,et al.Hyperbolic relationship between insulin secretion and sensitivity on oral glucose tolerance test[J].Obesity(Sliver Spring),2008,16(8):1901-1907.
[13]Hanley AJ,Retnakaran R,Qi Y,etal.Association of hematological parameters with insulin resistance and beta-cell dysfunction in nondiabetic subjects[J].JClin Endocrinol Metab,2009,94(10):3824-2832.
[14]Utzschneider KM,Prigeon RL,Faulenbach MV,et al.Oral disposition index predicts the development of future diabetes above and beyond fasting and 2-h glucose levels[J].Diabetes Care,2009,32(2):335-341.
[15]周文敬,金京姬,李素香,等.正常糖耐量胰岛β细胞功能及胰岛素敏感性的观察 [J].现代预防医学,2008,35(5):836-839.
[16]Bacha F,Lee S,Gungor N,et al.From pre-diabetes to type 2 diabetes in obese youth:pathophysiological characteristics along the spectrum of glucose dysregulation[J].Diabetes Care,2010,33(10):2225-2231.
[17]张明亮,朱云霞,尹德超,等.应用高葡萄糖钳夹技术评估高糖喂养小鼠胰岛细胞功能 [J].中华糖尿病杂志,2011,3(6):478-481.
Clinical value of 0.5 h-plasma glucose and its cutoff value during OGTT in diagnosing diabetes mellitus and prediabetes
Liu Le*,Yu Huining,Guo Xiaokun,Zhang Hongmei,Huang Jiaohong,Feng Ping.*The Cadre Sanitarian Division,The Second Hospital Affiliated of Tianjin Medical University,Tianjin 300211,China
Feng Ping,Email:xingxing626@sina.com
Objective To assess the cutoffvalues of plasma glucose at0.5 hour(0.5 hPG)during an oral glucose tolerance test(OGTT) for diagnosing diabetes(DM) and prediabetes(preDM) and the correlation between 0.5 hPG andβcell function as well as insulin sensitivity.M ethods A total of 4 351 subjects were recruited to have an OGTT.Using 2008-American Diabetes Association(ADA)diagnostic criteria of DM and preDM as assumed standard.The cutoff values were analyzed by receiver operating characteristic(ROC)curve.According to 2008-ADA diagnostic criteria,all the subjects were divided into normal tolerance test group (NGT group),preDM group and DM group.In NGT group,the individualwith 0.5 hPG<cutoff value for diagnosing preDM were divided into N-NGT group,and the individual with 0.5 hPG≥cutoff value for diagnosing preDM were divided into H-NGT group.In preDM group,the individual with 0.5 hPG<cutoff value for diagnosing DM were divided into N-preDM group,the individual with 0.5 hPG≥cutoff value for diagnosing DM were divided into H-preDM group.Plasma glucose,insulin,insulin sensitivity,early-phase insulin secretion and total insulin secretion were compared among five groups.The correlations between 0.5 hPG and β cell function,insulin sensitivity were analyzed.Results According to ROC results,using 2008-ADA diagnostic criteria of DM as reference,the optimal cutoff value of 0.5 hPG in diagnosing DM was 10.79 mmol/L;the sensitivitywas 80.6%,the specificitywas86.1%and area under curve(AUC)was 0.92±0.00.Using 2008-ADA diagnostic criteria of preDM as reference,the optimal cutoff value of 0.5 hPG in diagnosing preDM was 8.69 mmol/L;the sensitivity was 74.7%,the specificitywas 70.9%and AUC was 0.79±0.01.Along with the progress of glucose intolerance,the early-phase insulin secretion ability,30 min disposal index(DI30)and total insulin secretion ability,120 min disposal index(DI120) and homeostasis model assessment-islet β cell secretion(HOMA-β)decreased gradually(F=412.25-2113.02,all P<0.01),whereashomeostasis model assessment-insulin resistance(HOMA-IR)increased gradually(F=151.78,P<0.01).There was a negative correlation between 0.5 hPG and HOMA-β(r=-0.69),insulingenic index(r=-0.71),Matsuda insulin sensitivity index(r=-0.21),earlyphase insulin secretion index(r=-0.48),total-phase insulin secretion index(r=-0.54),DI30(r=-0.62)and DI120(r=-0.70,all P<0.01).Therewasa positive correlation between 0.5 hPG and HOMA-IR(r=0.34,P<0.01).Conclusions Patientwith 0.5 hPG≥10.79 mmol/L can be diagnosed as DM,whereas patient with 0.5 hPG≥8.69mmol/L but<10.79 mmol/L can be diagnosed as preDM.0.5 hPG reflects insulin sensitivity and isletβ cell function to some extent.Along with the increase of 0.5 hPG,the abnormal insulin sensitivity and the early phase insulin secretion getworse and this correlation is independentof insulin sensitivity.
Diabetes mellitus;Oral glucose tolerance test;0.5-Hour hyperglycemia;Early-phase insulin secretion;Insulin resistance
(Int JEndocrinolMetab,2015,35:217-221)
10.3760/cma.j.issn.1673-4157.2015.04.001
300211 天津医科大学第二医院干部保健科(刘乐,于会宁,郭晓坤,张红梅,黄姣红);300052 天津医科大学总医院代谢病科(冯凭)
冯凭,Email:xingxing626@sina.com
2015-01-25)

