四川省山羊多头蚴线粒体cox2基因序列测定及种系发育分析
郝桂英,杨应东,杨光友
(1.四川农业大学动物医学院,雅安625014;2.西昌学院,西昌615013;3.四川省攀枝花市农林科学研究院畜牧水产所,攀枝花617061)
·简报·
四川省山羊多头蚴线粒体cox2基因序列测定及种系发育分析
郝桂英1,2,杨应东3,杨光友1
(1.四川农业大学动物医学院,雅安625014;2.西昌学院,西昌615013;3.四川省攀枝花市农林科学研究院畜牧水产所,攀枝花617061)
应用线粒体细胞色素氧化酶第Ⅱ亚基(cox2)基因作为分子标记,对四川省12个山羊源多头蚴样品的cox2基因部分序列(pcox2)进行PCR扩增,分析其种内变异并重建系统进化树。序列分析结果显示所获得的pcox2序列长度为531 bp,共检测到8个变异位点,变异率为0~1.3%。基于pcox2序列构建的系统进化树显示多头蚴四川分离株与已知多头带绦虫位于同一分支,且脑源和肌间多头蚴聚在一起,均为多头带绦虫。结果表明,多头蚴cox2基因种内存在一定的遗传差异,但种内相对保守,与带属其他绦虫种间差异较大,故可作为多头带绦虫种间遗传变异研究的分子标记。这一研究结果也为山羊多头蚴病的分子诊断奠定了基础。
多头蚴;山羊;cox2基因;种系发育关系
脑多头蚴(Coenurus cerebralis)又称脑包虫,是多头带绦虫(Taenia multiceps)的中绦期幼虫,主要寄生于绵羊、山羊、黄牛、牦牛、水牛、骆驼、鹿、羚羊、羚牛等家养及野生有蹄类草食动物的大脑,偶有寄生于脊髓、肌间和腹腔[1-3],引起动物的脑多头蚴病,人也可感染[4]。脑多头蚴呈世界性分布,在中国许多省、市均有报道,尤以西北、华北、东北等广大牧区常见[5]。
目前,绦虫分类主要依据其形态学、生活史、宿主范围、流行病学调查、生态学、分子生物学分析等方面进行鉴定和区分。但传统的形态学鉴定方法对形态相近的虫种难以鉴别。
另外,随着人类活动的干扰,部分绦虫的宿主范围和地理分布呈现扩大趋势,这对根据已有生活史、宿主范围、流行病学调查、生态学资料进行鉴定起到很大的干扰。随着分子生物学以及生物信息学的迅速发展,绦虫种类的鉴定越来越趋向于利用基因间的差异。绦虫的基因组不会因宿主、环境、不同发育阶段以及翻译后修饰等因素的诱导而发生变异[6]。其中线粒体基因由于其具有高突变率、不同种间差异较大等特征,可以从分子水平上对种内和种间的遗传变异进行分析,已成为绦虫种类鉴定的热点[7]。
本研究应用线粒体DNA(mtDNA)中cox2基因作为分子标记,对我国四川省12个多头蚴样品种内变异进行了分析,并探讨了其与其他带属绦虫的系统进化关系,从而明确cox2基因能否成为理想的种间遗传标记,同时为山羊多头蚴病的分子诊断奠定基础。
1 材料与方法
1.1 多头蚴的采集12个多头蚴样品分别采自四川省攀枝花市、雅安市和成都市金堂县。将采集的多头蚴外层结缔组织膜剥离得到原头蚴,用灭菌生理盐水清洗3次,分别编号(见表1),-20℃保存备用。

表1 部分带属绦虫的线粒体cox2基因序列信息Table1 Sequence information of mitochondrial cox2 gene partial Taenia
1.2 基因组DNA的提取用剪刀剪取各样品的原头蚴约20 mg于研钵中研碎,加入DNA裂解液和蛋白酶K消化过夜后,用酚/氯仿法[8]提取多头蚴基因组DNA,于-20℃保存备用。
1.3 pcox2序列的扩增、纯化与序列测定根据GenBank上已收录的多头带绦虫线粒体全基因组(登录号:NC_012894)的cox2基因全序列设计1对引物。pcox2 P1:5′-AAGTTGGTTACTGGGGAGA-3′,pcox2 P2:5′-CCACATCAACAACCTCAAT-3′。引物序列由英潍捷基(上海)贸易有限公司合成。扩增体系为50 μL:2×Taq PCR MasterMix 25 μL,引物P1、P2(10 μmol/L)各2 μL,模板DNA 2 μL,灭菌ddH2O 19 μL。同时,以ddH2O代替模板DNA作空白对照。扩增条件:95℃预变性5 min;95℃变性30 s,42℃复性30 s,72℃延伸45 s,共30个循环;最后72℃延伸5 min。反应结束后取5 μL PCR扩增产物用10 g/L琼脂糖凝胶电泳检测其大小、纯度及亮度。
使用柱式DNA胶回收试剂盒进行DNA的回收纯化,回收产物送英潍捷基(上海)贸易有限公司进行正反双向测序。
1.4 序列分析与系统进化分析从GenBank检索到已收录的7种其他带属绦虫的线粒体全基因组,下载其相应的pcox2基因序列(表1),然后用Clustal X 1.81软件进行序列比对,MEGA 5.0软件分析碱基组成、转换/颠换比率,基于K2P模型计算遗传距离。用DNAStar 中的MegAlign程序进行序列同源性分析。用DNASP 4.0软件计算多态位点数(number of polymorphic sites,S)、单倍型数(haplotypes,H)、核苷酸多样性(nucleotide diversity,Pi)、单倍型多样性(haplotypes diversity,Hd)和平均核苷酸差异(average number of nucleotide differences,K)。
以带科棘球属的细粒棘球绦虫(Echinococcus granulosus)(GenBank登录号:NC_008075)作为系统发育分析的外群,采用K2P模型,用MEGA 5.0软件构建NJ树,并进行重复1000次的自举检验(bootstrap test)。同时以Mrbayes3.1.2软件构建贝叶斯树。
2 结果与讨论
2.1 pcox2序列组成和相似性对12个多头蚴样品的pcox2基因序列进行排序分析后,去掉引物序列,得到531 bp的基因片段(占全长的92%)。pcox2序列没有碱基插入/缺失,其中保守位点523个,变异位点8个(占1.5%),包括7个简约信息位点和1个单变异位点。变异仅发生在密码子的第3位和第1位,其中第3位占87.5%。A、T、C、G碱基的平均含量分别为25.8 %、42.2 %、10.6%、21.4%,表现出明显的AT偏倚,这与贾万忠等[9]报道的结果相似,这可能由序列变异或选择压力造成的。序列中转换多于颠换,转换/颠换(R)为2.382。其中T与C、A与G间的转换均为3个,T与G、C与G间的颠换均为1个。
12个多头蚴样品的pcox2序列的核苷酸相似性为98.7%~100%,共得到4条不同的序列,序列比对结果见图1。测序序列与已知多头带绦虫的同源基因核苷酸相似性为98.1%~98.9%,与其他带属绦虫的cox2同源基因序列相似性低于92.1%。本研究测定的12个多头蚴样品pcox2序列的碱基变异率为0~1.3%,与其他带属绦虫同源基因的变异率大于8.6%,由此可见多头蚴cox2基因片段的种内变异远小于种间变异,其中多头带绦虫与牛带绦虫、亚洲带绦虫、猪带绦虫的相似性高于泡状带绦虫、豆状带绦虫、肥头绦虫和带状带绦虫,与Gasser等[10]报道的结果一致。
2.2 多头蚴地理种群的遗传多样性对12个多头蚴样品的pcox2基因进行单倍型分析,共检测出4个单倍型,即H1~H4,其中雅安样品和攀枝花样品共享单倍型H2,雅安仅有此单倍型。在4个单倍型出现频率最高的是H2,占全部个体的50%。计算12个样品的单倍型多样性(Hd)为0.712,核苷酸多样性(Pi)为0.00551,多态位点数8个,平均核苷酸差异(K)为2.924,遗传距离为0.002~0.008(平均0.002),与已知多头带绦虫的遗传距离为0.017~0.032,与其他带属绦虫的遗传距离大于0.032。脑源、肌肉源种群内单倍型间遗传距离分别为0.002~0.008、0.000~0.004,攀枝花与雅安种群间遗传距离为0.002。各种群的遗传多样性参数见表2。
衡量一个种群线粒体遗传变异有两个重要的指标:单倍型间的平均遗传距离和核苷酸多样性。一般而言,单倍型间的核苷酸多样性(Pi)是衡量群体内遗传多样性的重要指标之一。Pi值越大,表明群体的遗传多样性越丰富[11]。由于核苷酸多样性考虑了各种单倍型在群体中所占的比例,因此反映一个群体的线粒体多态程度是比单纯的平均遗传距离更准确[12]。对于大多数动物来说,Pi值在0.01以上时被认为变异较大[13]。本研究结果显示,多头蚴单倍型间的pcox2序列Pi为0.00551,由此可见基于pcox2序列的多头蚴各种群间的遗传多样性较低。

图1 多头蚴分离株cox2基因片段序列比对及核苷酸变异位点Fig.1 Sequences alignment of cox2 gene fragment and nucleotide variation sites of Coenurus isolates
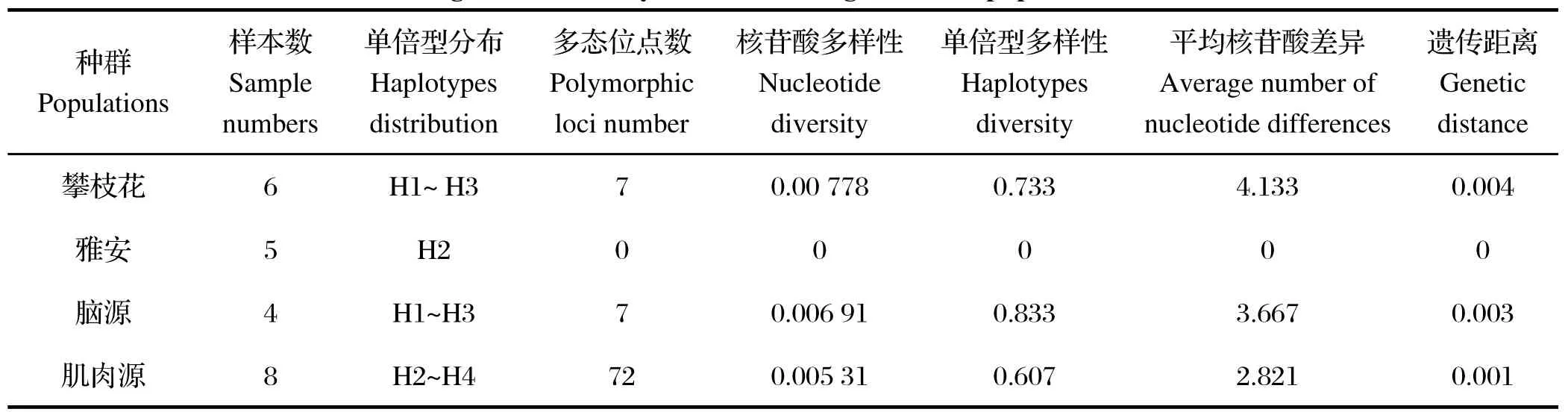
表2 基于cox2基因序列的多头蚴种群遗传多样性Table2 The genetic diversity based on cox2 gene in the populations of Coenurus
不同群体间的遗传距离反映其群体间遗传组成分化的程度。就cox2基因片段而言,攀枝花种群的分化程度(平均遗传距离为0.004)高于雅安种群(平均遗传距离为0)。且雅安样品间cox2基因序列没有任何变异,单倍型多样性和核苷酸多样性均为0,这可能是由于雅安种群的多头蚴均采自一养殖户饲养的同一群山羊体内,而攀枝花种群的多头蚴均采自不同养殖户饲养的羊。另外,绦虫是雌雄同体,可通过有性生殖阶段的自体孤立、自体受精的生殖方式、株间不会杂交等机理维持其同种状态(同株遗传性)[14],它们的后代基因可能完全一致。这个特征对绦虫种群的基因结构具有非常重要的影响。如自体受精可能降低种群内的基因变异,并增加种群间的分化[15]。
2.3 基于pcox2基因序列的系统发育分析构建的贝叶斯树和NJ树的拓扑结构基本一致(仅列出NJ树,见图2)。构建的NJ树显示12个测序株与多头带绦虫已知株构成1个分支,能与猪带绦虫(T.solium)、牛带绦虫(T.saginata)、亚洲带绦虫(T.asiatica)、豆状带绦虫(T.pisiformis)、泡状带绦虫(T.hydatigena)、肥头带绦虫(T.crassiceps)、带状带绦虫(T.taeniaeformis)很好地鉴别,且多头带绦虫与猪带绦虫的亲缘关系最近。

图2 基于pcox2序列NJ法构建的多头蚴系统发育树(支持率标注在分支上)Fig.2 Phylogenetic tree of Coenurus based on pcox2 sequence by using neighbor-joining analysis ( Numbers on the tree represent the supporting value )
通常带科绦虫病的诊断常采用传统形态学鉴定方法和ELISA等免疫学诊断方法,但这些方法都有一定的缺陷。传统形态学鉴定需要采集完整的虫体,并且对头节和不同发育阶段的节片进行固定、染色、封片等繁琐的操作后观察进行种类鉴定。而ELISA等免疫学诊断方法所用抗原局限于来源有限的天然抗原,且常因存在交叉抗原而假阳性高,在临床应用中受到限制[16,17]。近年兴起的分子方法对带科绦虫的鉴别、系统分类学、诊断、流行病学、传播方式、种群分析、耐药性研究和疫苗的发展都有非常重要的影响[18]。
目前用于多头带绦虫的分子标记主要有cox1[19]、nad1[20]、nad4[21]、Cytb[22]、12S rRNA[23]等,但cox2基因能否作为研究多头带绦虫分离株种内变异的分子标记,目前国内外均未见报道。本研究的结果显示多头蚴cox2基因种内存在一定的遗传差异,但相对保守,与带属其他绦虫种间差异较大,故可作为多头带绦虫种间遗传变异研究的分子标记。
[1] 杨光友, 张志和.野生动物寄生虫病学 [M].北京∶ 科学出版社, 2013∶ 386-389.
[2] Sharma D K, Chauhan P P S.Coenurosis status in Afro-Asian region∶ A review [J].Small Ruminant Res, 2006, 64(3)∶ 197-202.
[3] Scala A, Cancedda G M, Varcasia A, et al.A survey of Taenia multiceps coenurosis in Sardinian sheep [J].Vet Parasitol, 2007, 143(3-4)∶ 294-298.
[4] El-On J, Shelef I, Cagnano E, et al.Taenia multiceps∶ a rare human cestode infection in Israel [J].Vet Ital, 2008, 44(4)∶ 621-631.
[5] 李文卉, 付宝权.脑多头蚴病研究进展 [J].动物医学进展, 2010, 31(10)∶ 87-91.
[6] 范彦雷, 娄忠子, 李立, 等.绦虫种的分类鉴定方法研究进展 [J].中国人兽共患病学报, 2014, 30(2)∶ 199-206.
[7] 郝桂英.线粒体基因在带属绦虫分子分类中的研究进展[J].动物医学进展, 2014, 35(1)∶ 94-98.
[8] 萨姆布鲁克 J, 拉塞尔 D W.分子克隆实验指南 [M].3版.黄培堂, 王嘉玺, 朱厚础, 等译.北京∶ 科学出版社, 2002.
[9] 贾万忠, 闫鸿斌, 史万贵, 等.带属绦虫线粒体基因组全序列生物信息学分析 [J].中国兽医学报, 2010, 30 (11)∶1480-1485.
[10] Gasser R B, Zhu X, McManus D P.NADH dehydrogensase subunit 1 and cytochrome c oxidase subunit Ⅰsequences compared for members of the genus Taenia (Cestoda) [J].Int J Parasitol, 1999, 29 (12)∶ 1965-1970.
[11] Smith M A, Woodley N E, Janzen D H, et al.DNA barcodes reveal cryptic host-specificity within the presumed polyphagous members of a genus of parasitoid flies [J].Proc Natl Acad Sci USA, 2006, 103(10)∶ 3657-3662.
[12] 周慧, 李迪强, 张于光, 等.藏羚羊mtDNA D-loop区遗传多样性研究 [J].遗传, 2006, 28(3)∶ 299-305.
[13] Neigel J E, Avise J C.Application of random walk model to geographic distribution of animal mitochondrial DNA variation [J].Genetics, 1993, 135(4)∶ 1209-1220.
[14] Wachira T M, Bowels J, Zeyhle E, et al.Molecular examination of the sympatry and distribution of sheep and camel strains of Echinococcus granulosus in Kenya [J].Am J Trop Med Hyg, 1993, 48(4)∶ 473-479.
[15] Charlesworth B, Morgan M T, Charlesworth D.The effect of deleterious mutations on neutral molecular variation [J].Genetics Soc America, 1993, 134(4)∶ 1289-1303.
[16] 郭宝平, 张壮志, 张文宝, 等.用ELISA方法检测原头节及EgM免疫犬IgG变化情况 [J].地方病通报, 2007, 22(4)∶ 1-4.
[17] 王春仁, 于万才, 仇建华, 等.斑点免疫金渗滤试验检测绵羊脑多头蚴病的研究 [J].中国兽医寄生虫病, 2001, 9(1)∶ 12-14.
[18] Gasser R B.PCR-based technology in veterinary parasitology [J].Vet Parasitol, 1999, 84(3-4)∶ 229-258.
[19] Li W H, Jia W Z, Qu Z G, et al.Molecular characterization of Taenia multiceps isolates from Gansu province, China by sequencing of mitochondrial cytochrome c oxidase subunit 1 [J].Korean J Parasitol, 2013, 51(2)∶ 197-201.
[20] Varcasis A, Jia W Z, Yan H B, et al.Molecular characterization of subcutaneous and muscular coenurosis of goats in United Arab Emirates [J].Vet Parasitol, 2012, 190(3/4)∶ 604-607.
[21] 何德肆, 徐平源, 彭运潮.湖南省山羊脑多头蚴的线粒体nad1和nad4基因的序列测定及种系发育分析 [J].畜牧兽医学报, 2011, 42(12)∶ 1763-1767.
[22] 郝桂英, 杨应东, 周英姿, 等.基于线粒体cox1和Cyt b基因对四川地区多头带绦虫的种群遗传多样性研究[J].畜牧兽医学报, 2014, 45(4)∶ 631-638.
[23] Rostami S, Salavati R, Beech R N, et al.Cytochrome coxidase subunit 1 and 12S ribosomal RNA characterization of Coenurus cerebralis from sheep in Iran [J].Vet Parasitol, 2013, 197(1-2)∶ 141-151.
SEQUENCING AND PHYLOGENETIC ANALYSIS OF MITOCHONDRIAL COX2 GENE OF COENURUS IN GOATS IN SICHUAN PROVINCE
HAO Gui-ying1,2, YANG Ying-dong3, YANG Guang-you1
(1.College of Veterinary Medicine, Sichuan Agricultural University, Ya'an 625014, China; 2.Xichang College, Xichang 615013, China; 3.Animal Science and Fisheries Research Institute, Panzhihua Academy of Agricultural and Forestry Sciences, Panzhihua 617061, China)
The mitochondrial cytochrome coxidase subunit 2 (cox2) gene was used as a molecular marker to identify the intraspecies variation and reconstruct their phylogenetic relationship of 12 Coenurus isolates collected from goats in Sichuan province.Sequence analysis indicated that the cox2 gene fragment was 531 bp containing a total of 8 nucleotide variant sites.The Phylogenetic tree based on the cox2 sequence showed that all Taeina multiceps isolates clustered together while cerebral and intramuscular specimens grouped together, indicating that all isolates were T.multiceps.There was no signifi cant variation in the cox2 gene sequences within Coenurus although interspecies differences were obvious in Taenia.Therefore, cox2 gene was suitable as a molecular marker to study the intraspecifi c variation of T.multiceps.The results of the present study paid a solid foundation for molecular diagnosis of coenurosis.
Coenurus; goats; cox2 gene; phylogenetic relationship
S852.734
:B
:1674-6422(2015)01-0054-06
2014-08-19
教育部长江学者和创新团队发展计划项目(IRT0848)
郝桂英,女,博士,主要从事分子寄生虫学研究
杨光友,E-mail∶guangyou1963@aliyun.com

