羧甲基纤维素钠和壳聚糖对Cu(Ⅱ)螯合能力的比较
冯 颖, 王珏程, 郑龙行, 苏辰长, 张建伟
(沈阳化工大学 能源与动力工程学院, 辽宁 沈阳 110142)
羧甲基纤维素钠和壳聚糖对Cu(Ⅱ)螯合能力的比较
冯 颖, 王珏程, 郑龙行, 苏辰长, 张建伟
(沈阳化工大学 能源与动力工程学院, 辽宁 沈阳 110142)
运用紫外分光光度仪测定羧甲基纤维素钠(CMC)、壳聚糖(CTS)及二者分别与铜离子形成的螯合产物的吸收光谱,结合等摩尔比法进行稳定常数的计算分析,以此为参数来比较两种螯合剂对铜离子的螯合能力.结果表明:这两种物质都能够螯合Cu2+,二者的配位数为2,计算CMC-Cu2+和CTS-Cu2+的稳定常数分别为1.88×1010、1.11×108,CMC对铜离子的螯合能力大于CTS.絮体显微形态实验结果表明:CTS-Cu2+螯合物絮体为淡蓝色片状;CMC-Cu2+螯合物絮团呈深蓝色多孔立体网状结构,这有利于CMC捕集铜离子.
羧甲基纤维素钠; 壳聚糖; 稳定常数; 铜离子
羧甲基纤维素钠(CMC)和壳聚糖(CTS)都是天然高分子聚合物,主要应用于医药[1-2]、食品[3-4]、纺织[5-6]、水处理[7-8]等领域.在以往的研究中,CMC多用作水处理中的助凝剂,CTS则被用作絮凝剂处理废水中的固体颗粒;同时研究还表明CMC分子链上含有—COONa和—OH,CTS分子链上含有—NH2和—OH,所以对重金属离子有较强的螯合能力.HE Feng等[9]的红外光谱实验数据表明,CMC与铁纳米颗粒反应主要通过—COONa单齿配位螯合.Tan Junjun[10]利用CMC分子链上—COONa的强还原性,通过螯合配体交换的方法用CMC与氯金酸合成金纳米颗粒.Wafaa M.Hosny[11]利用部分纤维素衍生物螯合铜和镍,用电子光谱对两种螯合产物进行分析,发现二者均为二齿配位.W.S.Wan Ngah[12]比较了壳聚糖和壳聚糖/PVA复合粒子吸附铜离子的能力,研究了不同pH、搅拌时间、搅拌速率对两种颗粒螯合吸附铜离子的影响,建立了二者吸附动力学方程.M.Rhazi[13]通过紫外光谱研究了不同pH对壳聚糖盐酸溶液螯合二价铜离子的影响,以pH为5.8为临界点,当溶液pH大于5.8时,壳聚糖铜螯合物为{[Cu(—NH2)2]2+,2OH-};当溶液pH值小于5.8时,壳聚糖铜螯合物为[Cu(—NH2)2]2+.张慧敏等人[14]用壳聚糖聚乙烯醇制备纳米纤维膜,以重金属离子吸附量为研究指标,考察了pH、重金属初始浓度、反应温度对螯合吸附的影响.上述文献中多以固态壳聚糖及其衍生物对重金属离子的螯合吸附作用为研究内容,研究指标多为重金属离子吸附量.戴安邦[15]的实验表明螯合物的稳定性与配体和金属离子的配位能力有线性关系,因此,本文引入螯合物稳定常数,结合螯合物絮体形态,比较两种天然高分子螯合剂对铜离子螯合能力的影响,同时选用壳聚糖稀溶液以避免固体壳聚糖螯合重属离子时的空隙吸附行为,为后续比较CMC与CTS对其他重金属离子的螯合能力提供参照,并为工业水处理选择螯合剂提供理论依据,为扩大CMC应用范围实现重金属离子回收再利用提供依据.
1 实验材料和方法
1.1 实验材料及设备
药剂:壳聚糖(脱乙酰度为90 %)、羧甲基纤维素钠(相对分子质量800~1 200)、五水硫酸铜(分析纯)、乙酸(化学纯),实验用水为去离子水.
壳聚糖溶液:精确称量2.0 g壳聚糖,用体积分数为1 %的乙酸溶液配置成浓度为0.124 mol·L-1的溶液,静置24 h备用.
羧甲基纤维素钠溶液:精确称量2.0 g羧甲基纤维素钠,用去离子水配置成浓度为0.08 mol·L-1的溶液,溶胀24 h备用.
铜离子溶液:精确称量6.0 g五水硫酸铜,用去离子水配置成Cu2+浓度为2.34×10-3mol·L-1的溶液.
仪器:U2800紫外-可见分光光度仪、HACH离子浓度检测仪、BK3300数码显微镜及ESJ120-4型精密电子天平.
1.2 实验方法
1.2.1 CMC、CMC-Cu2+、CTS、CTS-Cu2+和铜水络合物的紫外吸收光谱实验
利用紫外分光仪扫描浓度分别为0.08、0.124 mol·L-1的羧甲基纤维素钠和壳聚糖溶液,以去离子水为参比,分别取2 mL浓度为0.08 mol·L-1的羧甲基纤维素钠与2 mL浓度为2.34×10-3mol·L-1的铜离子溶液,在50 mL定容瓶中加水充分混合,反应足够时长,用浓度6.67×10-5mol·L-1的羧甲基纤维素钠为参比扫描紫外光谱.壳聚糖铜螯合物以相同方法测定.
1.2.2 不同铜离子、CMC和CTS浓度对螯合物紫外光谱影响实验
固定—COONa的浓度分别为2.07×10-4、4.13×10-4、6.20×10-4mol·L-1,铜离子与—COONa 摩尔比按0.1~1.0变化反应,测CMC-Cu2+最大吸光处的ABS.固定—NH2的浓度分别为1.4×10-3、2.8×10-3、3.35×10-3mol·L-1,以相同方法反应,测CTS-Cu2+最大吸光处的ABS值.
1.2.3 稳定常数β的计算方法
采用等摩尔比法计算稳定常数,计算公式如下[16]:
(1)
式中c(Cu2+)、c(—R)为铜离子和配体的初始浓度(mol·L-1),A为螯合物吸光度,ε为螯合物的摩尔吸光系数,n为配位比.当铜离子浓度远远大于配体浓度时,存在如下关系:
A=ε·c(—R)/n
(2)
因此,通过实验数据作图可以得出n值,代入公式(2),求出螯合物的摩尔吸光系数ε.将n、ε和不同c(Cu2+)/c(—R)比下的A值带入,计算β.
2 实验结果与讨论
2.1 CMC、CMC-Cu2+、CTS、CTS-Cu2+和铜水络合物的紫外吸收光谱
如1.2.1节所示的方法,分别测得CMC、CMC-Cu2+、CTS、CTS-Cu2+和铜水络合物的紫外吸收光谱,如图1所示.
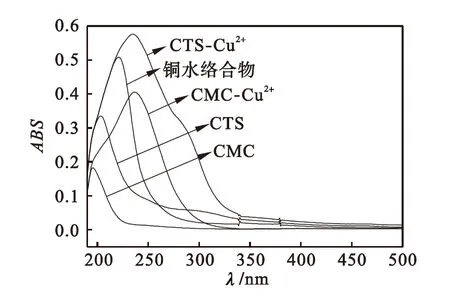
图1 CTS、CTS-Cu2+、CMC、CMC-Cu2+和铜水络合物的紫外吸收光谱
Fig.1 Ultraviolet absorption spectra of CTS,CTS-Cu2+,CMC,CMC-Cu2+and copper water complex
由图1可知:壳聚糖(CTS)的吸光度ABS为0.33,最大吸收波长λmax在203 nm处;羧甲基纤维素钠(CMC)的吸光度ABS为0.18,最大吸收波长λmax在197 nm处.说明在壳聚糖和羧甲基纤维素钠分子内不存在不饱和键,无法产生π→π*跃迁的生色团,在波长200~400 nm段内没有明显的强吸收峰.铜因在水中氢键的作用下与水分子形成铜水络合物,故在紫外光区域发生荷移吸收产生吸收峰,壳聚糖铜(CTS-Cu2+)和羧甲基纤维素铜(CMC-Cu2+)分别在235 nm和237 nm处产生吸收峰,二者吸收峰宽且强,表明壳聚糖和羧甲基纤维素钠能与Cu2+发生螯合反应,且螯合能力较强.
2.2 不同铜离子浓度对螯合物紫外吸收曲线的影响
为了探讨铜离子浓度大小对螯合物吸收曲线的影响,在不同铜离子与配体浓度比下分别扫描两种螯合物的紫外光谱,结果如图2所示.
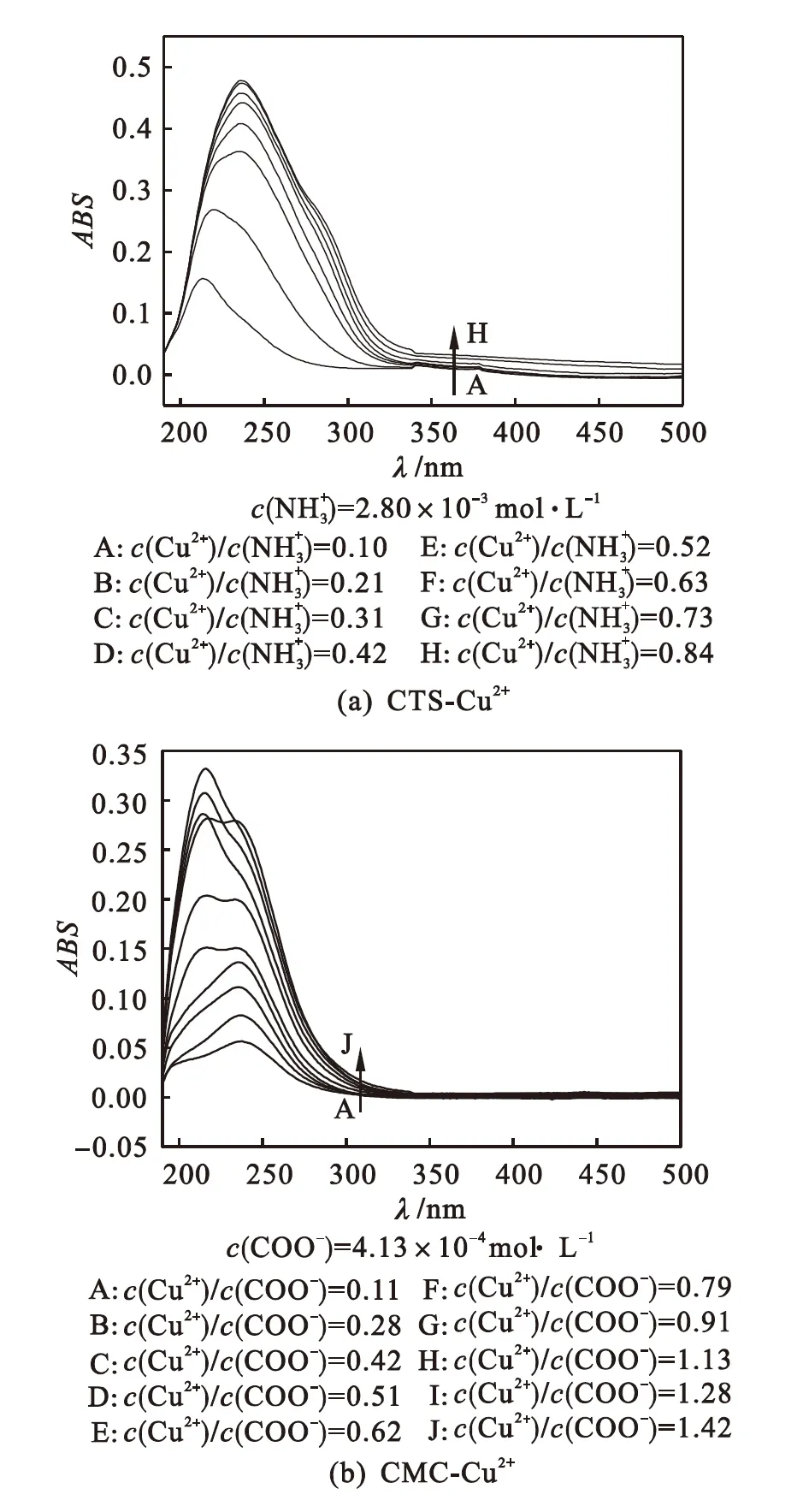
图2 不同配体浓度下CTS-Cu2+及CMC-Cu2+螯合物的紫外吸收光谱
Fig.2 Ultraviolet absorption spectra of CTS-Cu2+and CMC-Cu2+under different concentrations of ligand

2.3 两种螯合物配位比的确定
为了计算螯合物的稳定常数,通过摩尔比法做CTS-Cu2+及CMC-Cu2+两种螯合物的ABS-c(Cu2+)/c(—R)曲线,研究两种螯合物的组成,如图3所示.
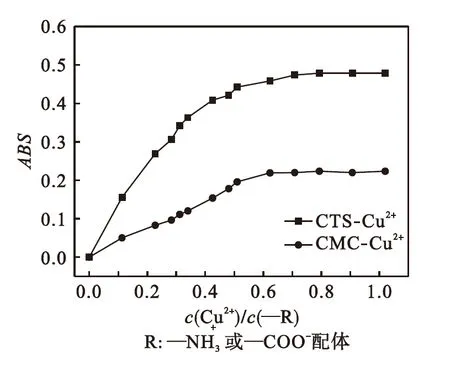
图3 CTS-Cu2+、CMC-Cu2+的ABS-c(Cu2+)/c(—R)曲线
Fig.3ABS-c(Cu2+)/c(—R) graphs forCTS-Cu2+and CMC-Cu2+

2.4 CTS-Cu2+和CMC-Cu2+稳定常数的计算
由2.3节可知CTS-Cu2+和CMC-Cu2+的配位比为n=2.取2.3节中各c(Cu2+)/c(—R)对应的ABS依照刘立华等[16]人的方法计算螯合物的稳定常数β,计算结果见表1.由表1可知:在c(Cu2+)/c(—R)为0.1~0.5之间,各组稳定常数计算值较为接近;当c(Cu2+)/c(—R)大于0.5时,稳定常数值计算值β开始出现偏差,随着c(Cu2+)/c(—R)的增加,稳定常数计算值偏差越大,这是由于溶液中过多的铜水络合物也吸收了紫外光给予的能量,致使吸光度过高.故选择c(Cu2+)/c(—R)为0.1~0.5时的稳定常数计算值求平均值,则壳聚糖铜(CTS-Cu2+)和羧甲基纤维素铜(CMC-Cu2+)的稳定常数分别为1.11×108和1.88×1010.比较二者的稳定常数发现,壳聚糖铜的β值小于羧甲基纤维素铜的β值,表明羧甲基纤维素钠(CMC)螯合Cu2+的能力大于壳聚糖(CTS).

表1 CTS-Cu2+和CMC-Cu2+螯合物的稳定常数β的计算
2.5 CTS-Cu2+和CMC-Cu2+螯合物絮体形态的比较
图4为CTS-Cu2+和CMC-Cu2+螯合物的絮体显微结构.由图4(a)可知:铜离子溶液中加入壳聚糖形成的絮体为片状结构,且絮体颜色为淡蓝色.由图4b可知:投加羧甲基纤维素钠形成的絮体呈现多孔立体网状形态,且絮体为深蓝色.过滤絮体,测量投加CTS和CMC后的上清液中铜离子质量浓度,其分别为10.4 mg·L-1和1.5 mg·L-1.这是因为网状的空间结构给羧甲基纤维素钠碳链上的羧基更多的空间去捕集铜离子,使其与之螯合,故投放羧甲基纤维素钠的上清液中铜离子浓度更低,CMC的螯合能力总体强于CTS.

图4 CTS-Cu2+和CMC-Cu2+螯合物絮体形态显微图像
Fig.4 Floc shape micrographs of CTS-Cu2+and CMC-Cu2+chelates
3 结 论
(1) 壳聚糖和羧甲基纤维素钠分子内无共轭结构,其最大吸收波长分别在203 nm和197 nm处.壳聚糖铜、羧甲基纤维素铜螯合物的最大吸收波长分别为235 nm、237 nm,表明壳聚糖和羧甲基纤维素对铜离子均有螯合作用.

(3) 由ABS-c(Cu2+)/c(—R)曲线图得CTS-Cu2+及CMC-Cu2+螯合物的配位比均为2,即两个配体螯合一个铜离子.
(4) 壳聚糖铜螯合物的絮体为蓝色片状;羧甲基纤维素铜螯合物的絮体为多孔立体网状结构,这有利于羧甲基纤维素钠捕集溶液中的铜离子.
[1] LEE D S,JE J Y.Gallic Acid-grafted-chitosan Inhibits Foodborne Pathogens by a Membrane Damage Mechanism[J].J Agric Food Chem,2013,61(26):6574-6579
[2] 吴迪,刘辉,浦金辉,等.羧甲基壳聚糖的生物特性及其在医药领域的应用[J].食品与药品,2013,15(3):210-213.
[3] 詹志萍.羧甲基纤维素钠的内在质量及其对酸性食品质量的影响[J].中国食品添加剂,1997(4):38-39.
[4] WAN A,XU Q,SUN Y,et al.Antioxidant Activity of High Molecular Weight Chitosan and N,O-quaternized Chitosans[J].J Agric Food Chem,2013,61(28):6921-6928.
[5] 钱国坻,桂玉梅.表面活性剂复配原理及其在纺织印染工业中的应用[J].日用化学工业,1999(2):19-25.
[6] 王鸿博,高卫东.甲壳素及壳聚糖在纺织工业中的应用[J].纺织导报,2003(1):26-28.
[7] 于洸,徐文国,周贵忠,等.新型高分子絮凝剂处理含油废水的研究[J].北京理工大学学报,2003,23(2):260-264.
[8] 孙姣,秦莉,李桂水,等.壳聚糖对小儿咳喘灵原药提取液絮凝除杂效果研究[J].中草药,2013,44(2):174-179.
[9] HE F,ZHAO D Y,LIU J C,et al.Stabilization of Fe-Pd Nanoparticles with Sodium Carboxymethyl Cellulose for Enhanced Transport and Dechlorination of Trichloroethylene in Soil and Groundwater[J].Ind Eng Chem Res,2007,46(1):29-34.
[10]TAN J,LIU R,WANG W,et al.Controllable Aggregation and Reversible pH Sensitivity of AuNPs Regulated by Carboxymethyl Cellulose[J].Langmuir the Acs Journal of Surfaces & Colloids,2010,26(3):2093-2098.
[11]HOSNY W M,HADI A K A,EI-SAIED H,et al.Metal Chelates with Some Cellulose Derivatives.Part Ⅲ.Synthesis and Structural Chemistry of Nickel(Ⅱ) and Copper(Ⅱ) Complexes with Carboxymethyl Cellulose[J].Polymer International,1995,37(2):93-96.
[12]WAN NGAH W S,KAMARI A,KOAY Y J.Equilibrium and Kinetics Studies of Adsorption of Copper(Ⅱ) on Chitosan and Chitosan/PVA Beads[J].International Journal of Biological Macromolecules,2004,34(3):155-161.
[13]RHAZI M,DESBRIERES J,TOLAIMATE A,et al.Contribution to the Study of the Complexation of Copper by Chitosan and Oligomers[J].Polymer,2002,43(4):1267-1276.
[14]张慧敏,阮弦,胡勇有,等.静电纺壳聚糖/聚乙烯醇纳米纤维膜对Cu2+、Ni2+及Cd2+的吸附特性[J].环境科学学报,2015,35(1):184-193.
[15]戴安邦.酸碱的软硬度的势标度及其相亲强度和络合物的稳定程度[J].化学通报,1978(1):26-31,25.
[16]刘立华,周智华,吴俊,等.两性高分子螯合絮凝剂与Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)的螯合稳定性[J].环境科学学报,2013,33(1):79-87.
Comparision of the Chelating Ability of Sodium Carboxymethyl Cellulose and Chitosan on Cu(Ⅱ)
FENG Ying, WANG Jue-cheng, ZHENG Long-xing, SU Chen-chang, ZHANG Jian-wei
(Shenyang University of Chemical Technology, Shenyang 110142, China)
The UV absorption spectrums of two complexes which produced by CMC,CTS chelating copper ion were mensurated via ultraviolet spectrophotometry.In order to compare the chelating ability of the two chelating agents on Cu2+,the stability constants were calculated and analysed by molar ratio method.The results show that these two materials were able to chelate Cu2+,the coordination number of two chelates is 2,the calculated stability constants of CMC-Cu2+and CTS-Cu2+chelates were 1.88×1010and 1.11×108,the chelating ability of CMC on copper ion was greater than CTS′s.The floc morphology experiment show that the flocs of CTS-Cu2+chelate was pale blue flake structure,the flocs of CMC-Cu2+chelate was deep blue porous three dimensional network structure,which was convenient for CMC trapping copper ion.
sodium carboxymethyl cellulose; chitosan; stability constant; copper ion
2015-05-11
国家自然科学基金项目(21406142;21476141)
冯颖(1975-),女,辽宁义县人,副教授,博士,主要从事非均相分离的研究.
2095-2198(2016)04-0310-06
10. 3969 /j. issn. 2095 - 2198. 2016. 04. 006
TQ028
A

