“超级全能生”2016高考全国卷26省联考(乙卷)
“超级全能生”2016高考全国卷26省联考(乙卷)
(本卷适用于使用全国卷Ⅰ地区)
[编者按]本次考试由新东方优能中学、《教学考试》杂志社共同发起组织,全国26个省市的数十万考生参加,试题创新度较高,吻合高考命题趋势,本刊特刊发以供广大读者考前模拟检测,希望对大家备考有所帮助。
可能用到的相对原子质量:H—1 B—11 C—12 N—14 O—16 Na—23 Mg—24 Fe—56
第Ⅰ卷(选择题 共42分)
一、选择题(本大题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
7.化学与科学、技术、社会、环境密切相关。下列有关说法正确的是( )
A.汽油、柴油、植物油都是碳氢化合物
B.利用潮汐发电是将化学能转变为电能
C.维勒合成尿素,突破了无机物和有机物的界限
D.食品保鲜膜、保鲜袋的主要成分是聚氯乙烯
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.滴加甲基橙显红色的溶液:K+、NH、Cl-、SO
B.加铝粉能放出氢气的溶液:Na+、NO、Cl-、Ba2+
C.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
D.c(H+)/c(OH-)=1013的溶液:Fe2+、Cl-、MnO、SO
9.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L
B.7.8g Na2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA
C.某温度下,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA
D.标准状况下,2.24L的CCl4中含有C—Cl键数为0.4NA
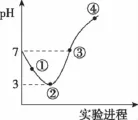
10.常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是( )
A.①处c(H+)约为②处c(H+)的两倍
B.可依据②处数据计算所溶解的n(Cl2)
C.③处表示氯气与氢氧化钠溶液恰好反应完全
11.分子式为C10H14的芳香烃中,苯环上一溴代物有两种结构的物质共有( )
A.3种B.4种
C.5种D.6种
12.下列根据实验操作和现象所得出的结论不正确的是( )
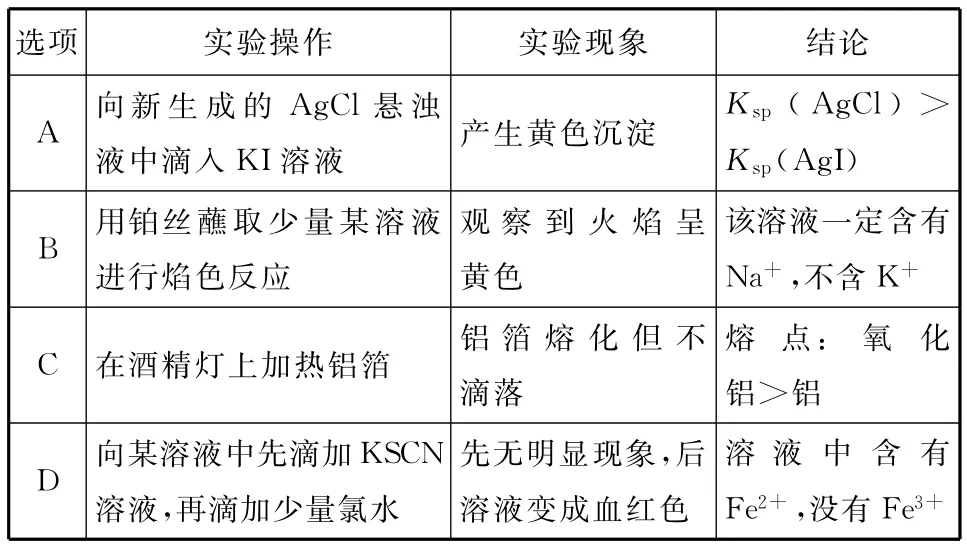
选项________实验操作实验现象结论A向新生成的AgCl悬浊_____液中滴入KI溶液产生黄色沉淀Ksp(AgCl)>Ksp(AgI)B用铂丝蘸取少量某溶液_____进行焰色反应观察到火焰呈黄色_____________该溶液一定含有Na+,不含K+C在酒精灯上加热铝箔铝箔熔化但不_____________________________ _滴落熔点:氧化铝>铝_________ D向某溶液中先滴加KSCN _____溶液,再滴加少量氯水先无明显现象,后溶液变成血红色_溶液中含有Fe2+,没有Fe3+
13.常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后溶液的pH如下表:

__实验编号c(HX)c(NaOH)_ __混合溶液的pH _____甲0.2 0.2____ ______pH=a_____乙c1_______________0.2 pH=7_____丙0.2 0.1____ ______pH>7 H=10丁______ ____c2________________c2p
下列说法不正确的是( )
A.从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸
B.在乙组混合溶液中,离子浓度c(X-)=c(Na+)
C.从丙组实验结果分析,HX是弱酸
D.丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10mol/L
第Ⅱ卷(非选择题 共58分)
二、非选择题(包括必考题和选考题两部分。第26~28题为必考题,每个试题考生都必须作答。第36~38题为选考题,考生根据要求作答)
(一)必考题(共43分)
26.(14分)为研究影响化学反应速率的有关因素,进行如下探究实验。(1)向一定量的NaHSO3溶液(已加入少量淀粉溶液)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。已知NaHSO3与过量KIO3反应分两步进行,且其反应速率主要由笫一步反应决定,第一步反应的离子方程式为IO+3HSO3SO+I-+3H+,则第二步反应的离子方程式为_______________________________。(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下:

编号0.01mol/L NaHSO3_____ __溶液/mL 0.01mol/L KIO3溶液/mL__ __________ ___________ _ H2O/mL反应温度/℃溶液变蓝所用时间t/s _①_ ____6.0 10.0 4.0 15t1_______②_ ____6.0 14.0 0 15t2_______③_ ____6.0ab25t3______
实验①②是探究_____________对反应速率的影响,表中t1______________(填“>”“=”或“<”)t2;
实验①③是探究温度对反应速率的影响,表中a=____________,b=____________。
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO24-对反应起催化作用;
假设二:________________________________。
(4)请你设计实验验证上述假设一,完成下表中内容。
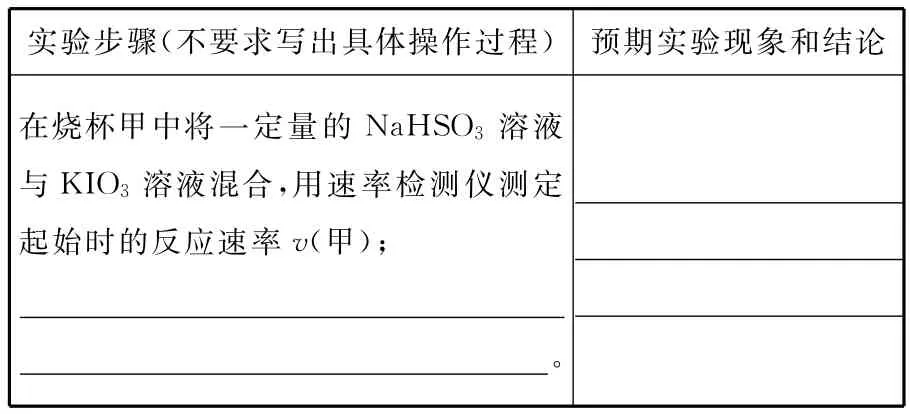
实验步骤(不要求写出具体操作过程)预期实验现象和结论在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定_____________________起始时的反应速率v(甲);___________________________________。
27.(14分)硫酸亚锡(SnSO4)溶于水,广泛应用于镀锡工业。以SnCl2为原料,SnSO4的制备路线如下。
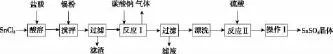
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)操作1的步骤为_____________、冷却结晶、过滤、洗涤、干燥。洗涤沉淀的方法是_______________________。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因:___________________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②_____________________。
(4)SnSO4在酸性条件下用作双氧水的去除剂,反应的离子方程式为____________________________________。
(5)为测定所使用锡粉的纯度,取质量为m的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c的K2Cr2O7标准溶液滴定生成的Fe2+(酸性环境下Cr2O可被还原为Cr3+),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是____________(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)。
28.(15分)减少污染、保护环境是全世界最热门的课题。
(1)将煤转化为清洁气体燃料,减少空气中SO2的排放,通常将煤气化。
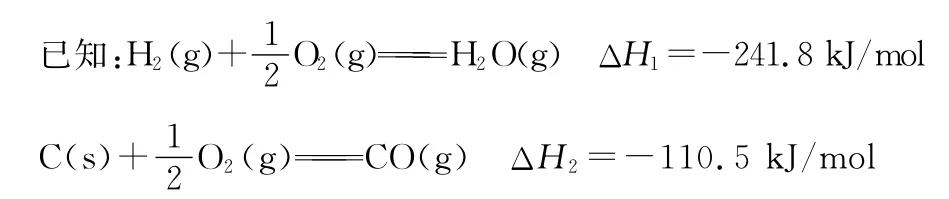
则焦炭与水蒸气反应生成CO的热化学方程式为_____。
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)幑幐CH3OH(g)。在密闭容器中充有10mol CO与20mol H2,CO的平衡转化率与温度、压强的关系如图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为n(M)总∶n(N)总=_____________。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为________________。
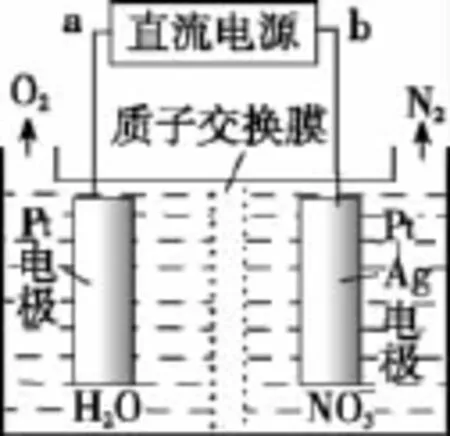
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为___________________________________________________。
(4)已知常温下,Ksp[Fe(OH)2]=1×10-15、Ksp[Fe(OH)3]=1×10-38、Ksp[Cr(OH)3]=1×10-23,欲降低废水中重金属元素铬的毒性,可将Cr2O27-转化为Cr(OH)3沉淀除去。
①在某含Cr2O27-废水中加入适量的绿矾(FeSO4· 7H2O),加入绿矾的目的是__________________________ ____________________________(用离子方程式表示)。
②浓度为0.1mol/L Fe2+与10.0mol/L Cr3+共沉淀的pH范围是_________________。
(二)选考题(共15分。请考生从给出的3道题中任选一题作答。如果多做,则按所做的第一题计分)
36.[化学—化学与技术](15分)
工业上冶炼铝过程如下图所示。

注:铝土矿的主要成分为Al2O3,另含有少量的Fe2O3和SiO2。
试回答下列问题:
(1)实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2)操作Ⅱ中生成不溶物C的离子方程式是__________。
(3)氧化铝的熔点高达2 050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是_____________________。(4)电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是______________ _______________________________。
(5)为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如图所示:
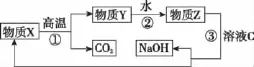
①上述转化中未涉及四种基本反应类型中的_____________反应;
②写出过程③的化学方程式:_______________________。(6)科学研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:_________________、_________________。
37.[化学—物质结构与性质](15分)
硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼原子的价电子排布式为_____________;硼元素许多性质与_____________元素最相似,由此预测自然界________(填“有”或“没有”)游离态的硼。
(2)硼元素具有缺电子性,其化合物往往具有加合性,在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构,则分子中B原子杂化轨道的类型是____________,其同层分子间的主要作用力是_____________________。
(3)已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-B(OH)4-,写出硼酸的电离方程式:______________________________________________。
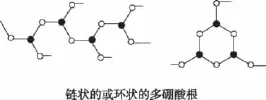
(4)H3BO3在加热过程中首先转变为HBO2(偏硼酸),继而其中的BO3结构单元通过氧原子以B—O—B键形成链状的或环状的多硼酸根(如图所示),其组成可表示为______________________。
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为_____________________。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是_____________g/cm3(只要求列算式)。
38.[化学—有机化学基础](15分)
下图是以基本化工原料制备防腐剂对羟基苯甲酸丁酯
的合成路线。
已知以下信息:
①D可与银氨溶液反应生成银镜;
②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。
回答下列问题:
(1)B 的化学名称为____________。
(2)由C生成D的化学反应方程式为________________。
(3)F 的化学式为_____________。
(4)G的同分异构体中含有苯环且能发生银镜反应的共有________种,其中核磁共振氢谱有四种不同化学环境的氢,且峰面积比为2∶2∶1∶1的是_____________(写出一种结构简式)。

参考答案
7.C 8.A 9.B 10.D 11.C 12.B 13.D
26.(14分)
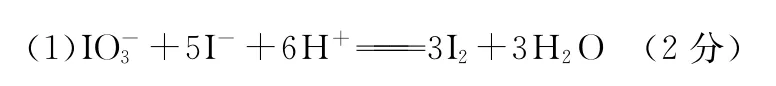
(2)KIO3溶液的浓度(或浓度) (2分) > (1分)
10.0 (1分) 4.0 (1分)
(3)生成的I-(或H+)对反应起催化作用 (2分)
(4)

实验步骤(不要求写出具体操作过程)预期实验现象和结论__在烧杯乙中先加入少量Na2SO4粉末(1分),其他条件与甲完全相同(1分),用速率检测仪测定起始时的反应速率v(乙)(1分)若v(甲)=v(乙),则假设一不成立(1分)若v(甲)<v(乙),则假设一成立(1分)
27.(14分)
(1)蒸发浓缩 (2分)
沿玻璃棒将蒸馏水注入漏斗中,直到淹没沉淀待滤尽后重复2~3次 (2分)
(2)因SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使平衡向左移动,抑制Sn2+水解 (3分)
(3)防止Sn2+被氧化 (2分)
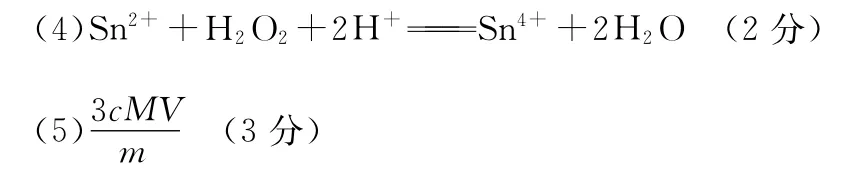
28.(15分)
(1)C(s)+H2O(g)CO(g)+H2(g) ΔH1=+131.3kJ/mol (2分)
(2)①5∶4 (2分) ②KM=KN>KQ(2分)

(2分)

②7.0~8.0 (2分)
36.(15分)
(1)漏斗 玻璃棒 (共2分)

(3)加入冰晶石(Na3AlF6)降低氧化铝的熔点 (2分)
(4)阳极产生的氧气与碳发生反应生成二氧化碳 (2分)
(5)①置换 (1分)
②NaHCO3+Ca(OH)2CaCO3↓+NaOH+H2O(2分)
(6)不用铝制品作炊具或不用铝箔包装食品(或其他合理答案即可) (2分)
37.(15分)
(1)2s22p1(1分) Si (1分) 没有 (1分)
(2)sp2(2分) 氢键 (2分)
(3)H3BO3+H2OH++B(OH)-4(2分)
(4)(BO2)n-n(2分)
(5)分子间作用力(或范德华力) (1分)

38.(15分)
(1)对氯甲苯(4-氯甲苯) (2分)
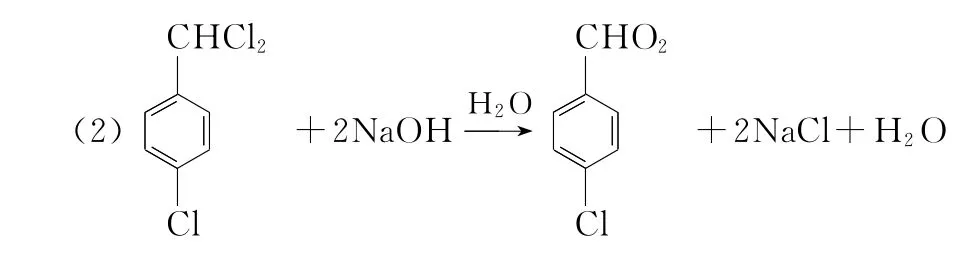
(3分)
(3)C7H4O3Na2(2分)


