系统性红斑狼疮患者血清白细胞介素-1家族及白细胞介素-34水平
邬秀娣,汤亚微,孙晓彤,王 冰,王苗苗,李 霞
(大连医科大学基础医学院免疫学系,辽宁大连 116044)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是体液和细胞免疫功能异常所造成的多器官受累的自身免疫性疾病,其主要特征为淋巴细胞异常活化,免疫调节功能紊乱及多种自身抗体产生[1]。其发病机制尚不明确,但大量研究表明,细胞因子在SLE发病过程中起着重要作用。
白细胞介素(interleukin,IL)-1家族主要包括IL-α、IL-β、IL-Ra(receptor antagonist,受体拮抗剂)、IL-18、IL-36Ra、IL-36α、IL-37、IL-36β、IL-36γ、IL-38、IL-33,其中致炎性细胞因子有IL-1α、IL-1β、IL-18、IL-33、IL-36α、IL-36β、IL-36γ,抑炎性细胞因子有IL-Ra、IL-36Ra、IL-37、IL-38。IL-34是一类新发现的细胞因子,可促进破骨细胞分化,也可促进人全血细胞分泌IL- 6以及趋化因子[2]。本研究通过检测SLE患者与正常对照者血清IL-1家族成员及IL-34水平,初步探讨细胞因子异常分泌对SLE疾病的影响。
对象与方法
对象
选取2014年2月至8月大连医科大学附属第二医院及宁波市第二医院就诊的SLE患者,诊断均符合1997年美国风湿病协会(American College of Rheumatology,ACR)制定的SLE分类标准[1],排除感染、肿瘤及其他自身免疫性疾病。正常对照组均来自医院体检中心的健康人群,无风湿病史和风湿病家族史。
方法
所有受检者晨起抽取静脉血4 ml,离心后取上清,标本放置-20 ℃保存待测。采用蛋白芯片AAH-CYT G1000试剂盒(美国Raybiotech公司)检测SLE组及正常对照组血清IL-1家族成员水平,具体操作按说明书进行。用激光扫描仪InnoScan300 Microarray Scanner(31390Carbonne-France)进行信号扫描,并采用AAH-CYT-G6,AAH-CYT-G7数据分析软件进行数据分析。应用双抗体夹心酶联免疫吸附试验(ELISA)检测血清IL-34水平(美国Bio-Legend公司,试剂盒灵敏度为33.4 pg/ml),酶标分析仪为BioTek ELX-800。具体操作按说明书进行。
统计学处理
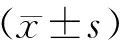
结 果
一般资料
选取6例女性SLE患者均为初发或复发患者,年龄23~42岁,平均年龄(31.67±6.53)岁;所有患者近3个月内使用糖皮质激素剂量均≤10 mg/d,除2例患者使用硫酸羟氯喹0.2 g/d,余均未使用其他免疫抑制类药物(表1)。同时选取6名女性正常对照组,年龄20~38岁,平均年龄(28.25±6.23)岁,进行血清IL-1家族成员水平检测,两组年龄、性别比较差异均无统计学意义(均P>0.05)。选取67例SLE患者,其中女61例,男6例;年龄14~52岁,平均年龄(35.1±10.6)岁;病程1~241个月,平均42.3个月。正常对照组86名,女78名,男8名,年龄20~57岁,平均年龄(39.8±13.2)岁;进行血清IL-34水平的检测,两组年龄、性别比较差异均无统计学意义(均P>0.05)。本研究得到大连医科大学附属第二医院及宁波市第二医院伦理委员会支持,所有参与者均签订知情同意书。
SLE组血清IL-1家族成员水平
利用蛋白芯片技术检测6例SLE患者和6名正常对照者血清IL-1家族成员水平,结果发现与正常对照组相比,SLE组血清IL-18、IL-36β水平明显增高,IL-36Ra水平降低,两组比较差异均有统计学意义(均P<0.05)(表2,图1)。
SLE组血清IL-34水平
采用ELISA方法测定67例SLE患者和86名正常对照者血清IL-34水平,结果显示SLE组血清IL-34水平明显高于正常对照组,两组比较差异有统计学意义[(100.36±70.38) pg/mlvs.(41.90±6.89) pg/ml,t=6.774,P<0.000 1](图2)。
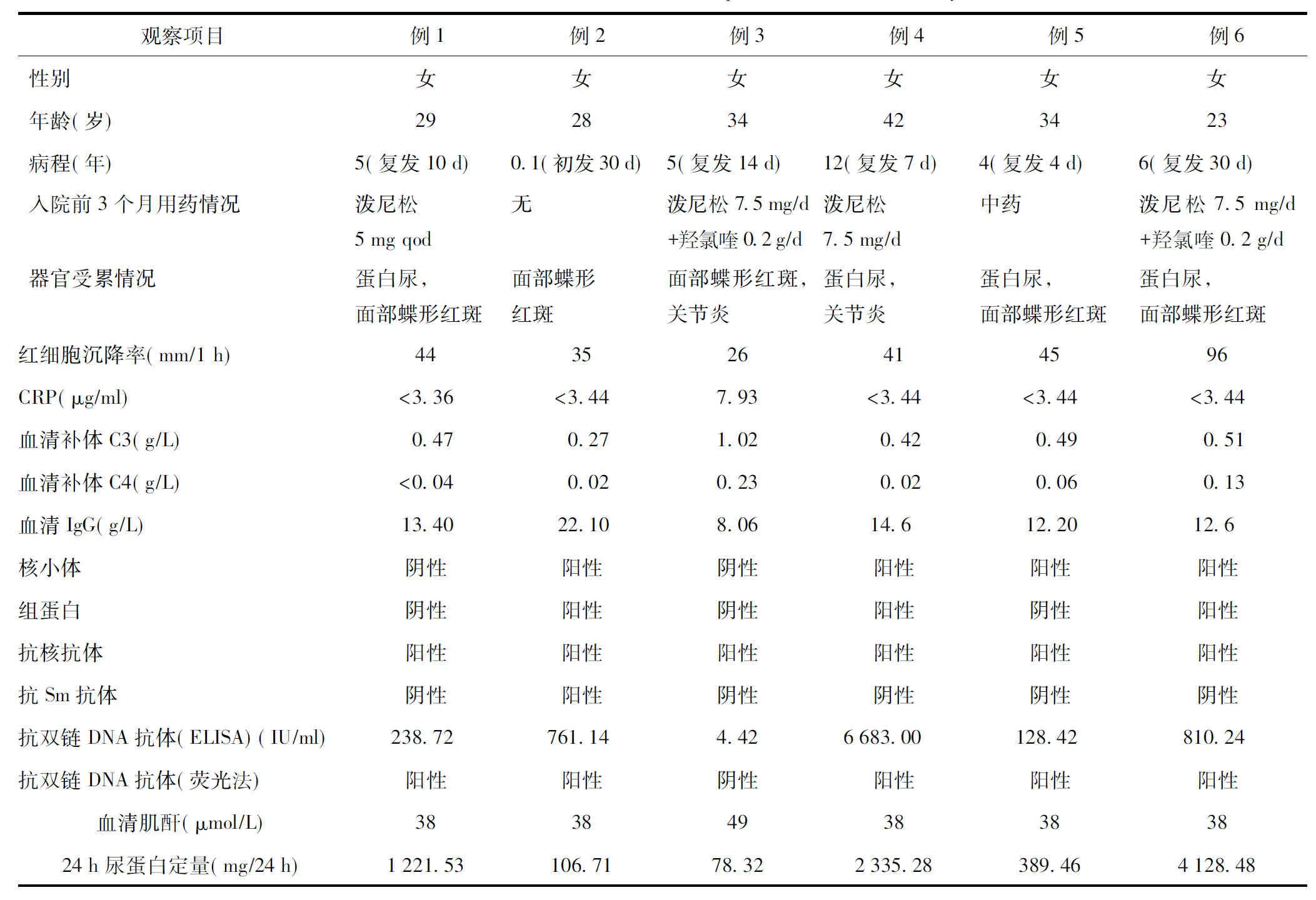
表1 6例检测IL-1家族细胞因子的SLE患者临床资料Table 1 Baseline characteristics of the 6SLE patients with IL-1 family deteetion
SLE:系统性红斑狼疮; CRP:C反应蛋白

表2 SLE组与正常对照组血清IL-1家族成员水平比较Table 2 Comparison of the serum IL-1 level between SLE group and control group ml)
SLE:系统性红斑狼疮; *与正常对照组相比,P<0.05
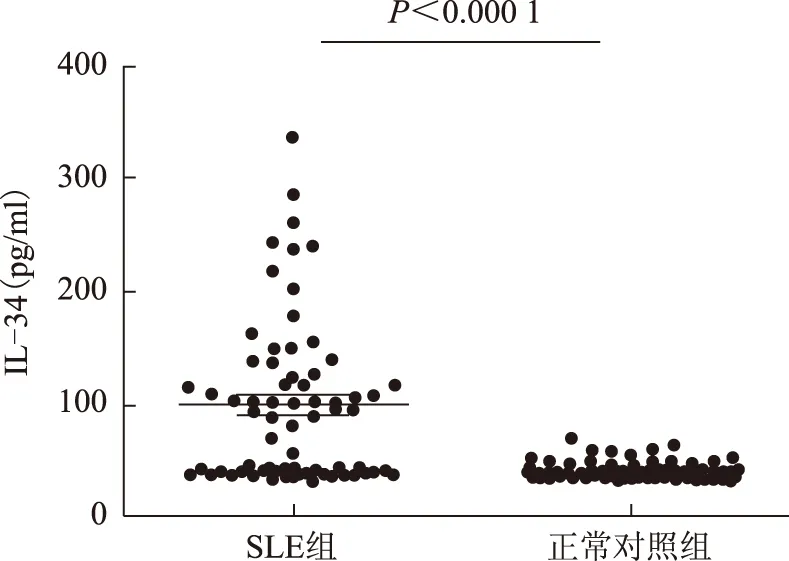
图2SLE组与正常对照组血清IL-34水平分析
Fig2Compavsion of the serum IL-34 level betwrrn SLE group and control group
SLE:系统性红斑狼疮;IL-34:白细胞介素-34
讨 论
细胞因子具有多种免疫调节功能,当其分泌异常时,导致机体免疫功能失调,诱发自身免疫性疾病。近年来大量研究表明,SLE发病过程中可能有复杂的细胞因子网络参与其中,很多细胞因子促进自身反应性T、B细胞活化、产生大量的自身抗体,使免疫稳态遭到破坏,最终导致细胞和组织损伤[1]。
IL-1家族包括IL-1、IL-18和IL-36三个亚家族,IL-1α、IL-1β、IL-Ra是IL-1家族中最早发现的细胞因子。IL-1α、IL-1β主要由活化的单核-巨噬细胞分泌,对炎性部位的持续性细胞浸润和诱导组织破坏起着直接的作用,是骨质吸收和骨质破坏的主要细胞因子[3]。IL-Ra是IL-1受体拮抗剂,主要由单核细胞产生,通过竞争性与IL-1受体结合抑制IL-1功能[4]。IL-18是IL-1家族另一细胞因子,主要由巨噬细胞、T、B淋巴细胞及树突状细胞产生。可诱导IFN-γ分泌,选择性刺激Th1细胞的分化[5]。Novick等[6]发现,SLE患者血清结合IL-18和游离IL-18水平均升高;与本研究结果相一致。然而本研究没有检测到SLE患者血清IL-1α、IL-1β、IL-Ra水平变化。
IL-36是IL-1家族新发现的细胞因子,包括IL-36α、IL-36β、IL-36γ,可由单核细胞、T淋巴细胞、角质细胞等多种细胞产生。IL-36通过与其受体相互结合,促进树突状细胞与辅助性T细胞的活化及促炎因子的分泌等。Debets等[7]研究显示,在银屑病受损的皮肤中,IL-36α、IL-36β、IL-36γ mRNA表达增加;类风湿关节炎(rheumatoid arthritis,RA)滑膜成纤维细胞和软骨细胞均表达IL-36受体,IL-36β通过与IL-36受体结合诱导炎性分子产生,参与类风湿关节炎发病[8]。本研究,发现SLE组血清IL-36β水平明显增加,进一步证实IL-36在自身免疫性疾病中发挥重要作用。IL-36Ra是IL-36受体拮抗剂,可由单核细胞、B淋巴细胞、树突状细胞等产生,能够与IL-36受体结合,抑制IL-36功能[9]。本试验检测到SLE组血清IL-36Ra水平下降,提示其在SLE中可能发挥抑炎作用。
IL-33、IL-37、IL-38是IL-1家族中另外三个细胞因子。IL-33表达于上皮细胞、内皮细胞和嗜酸粒细胞,在炎症因子刺激下表达增多[10]。有研究发现,IL-33能使肥大细胞表达IL-1、IL- 6、IL-11等炎性因子,促进胶原诱导性关节炎小鼠的滑膜炎症[11]。IL-37主要由中性粒细胞、淋巴细胞、巨噬细胞等表达,是一种具有抑制炎症作用的细胞因子[12]。研究表明,SLE患者血清IL-37水平升高,IL-37作为炎症反应的抑制剂,可能通过负反馈机制抑制SLE患者炎症的过度表达[13]。IL-38主要表达于B细胞,与IL-36Ra相似,通过特异性结合细胞表面特定的IL-36受体而抑制IL-17和IL-22的产生,从而在炎症反应过程中发挥抑制性作用[9]。然而,本试验结果未显示SLE患者血清IL-33、IL-37、IL-38这三种细胞因子水平的变化。
IL-34是2008年发现的细胞因子,主要表达于单核巨噬细胞、成纤维细胞、小神经胶质细胞[14]。IL-34能促进单核-巨噬细胞增殖与分化,诱导多种细胞因子和趋化因子表达,具有促炎、促进破骨细胞形成以及神经保护的作用[15-16]。有研究表明,RA患者滑膜成纤维细胞可表达IL-34,并与滑膜炎的严重程度相关,而TNF-α和IL-1β可通过NF-κB和JNK通路进一步上调IL-34基因表达水平,提示IL-34在RA发病中起到一定的作用,并与免疫炎症反应相关[17]。本研究发现,SLE组血清IL-34水平明显升高,进一步提示与免疫炎症反应有关。
综上,本研究初步分析了SLE患者血清IL-1家族成员和IL-34的水平变化,但本研究存在不足:(1)由于用于IL-1家族细胞因子检测的标本数量较少,试验数据有限,部分结果未测出差异或者与文献不一致,今后需要大样本数据的验证。(2)用于检测IL-34的SLE患者并非都是初发患者,患者病情变化和用药情况可能会影响试验结果,在后续研究中,应详细分析SLE血清IL-34水平与临床和实验室指标的关系。另外,对这些细胞因子在SLE发病中的具体作用机制仍需更深入的研究与探讨。
(本文图1见插页Ⅱ)
[1]Yorasov S,Wardemann H,Hammersen J,et al.Defective B cell tolerance checkpoints in systemic lupus erythematosus[J].J Exp Med,2005,201:703-711.
[2]Moon SJ,Hong YS,Ju JH,et al.Increased levels of interleukin 34 in serum and synovial fluid are associated with rheumatoid factor and anticyclic citrullinated peptide antibody titers in patients with rheumatoid Arthritis[J].J Rheumatol,2013,40:1842-1849.
[3]Rider P,Carmi Y,Cuttman O,et al.IL-1 alpha and IL-1 beta recruit different myeloid cells and promote different stages of sterile inflammation[J].J Immunol,2011,187:4834- 4843.
[4]Abbate A,Salloum FN,Vecile E,et al.Anakinra,a recombinant human interleukin-1 receptor antagonist,inhibits apoposis in experimental acute myocardial infarction[J].Circulation,2008,117:2670-2683.
[5]Tomita T,Jackson AM,Hida N,et al.Expression of interleukin-18,a Th1 cytokine,in human gastric mucosa is increased inHelicobacterpyloriinfection[J].J Infect Dis,2011,183:620- 627.
[6]Novick D,Elbirt D,Miller G,et al.High circulating levels of free interleukin-18 in patients with active SLE in the presence of elevated levels interleukin-18 binding protein[J].J Autoimmun,2009,34:121-126.
[7]Debets R,Timans JC,Homey B,et al.Two novel IL-1 family members,IL-1 delta and IL-1 epsilon,function as an antagonist and agonist of NF-kappa B activation through the orphan IL-1 receptor protein 2[J].J Immunol,2001,167:1440-1446.
[8]Magne D,Palmer G,Barton JL,et al.The new IL-1 family member IL-1F8 stimulates production of inflammatory mediators by synovial fibroblasts and articular chondrocytes[J].Arthritis Res Ther,2006,8:R80.
[9]Van de Veerdonk FL,Stoeckman AK,Wu GP,et al.IL-38 binds to the IL-36 receptor and has biological effects on immune cells similar to IL-36 receptor antagonist[J].Proc Natl Acad Sci U S A,2012,109:3001-3005.
[10] Schmitz J,Owyang A,Oldham E,et al.IL-33,an interleukin-1-like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J].Immunity,2005,23:479- 490.
[11] Xu Da,Jiang HR,Kewin P,et al.IL-33 exacerbates antigen-induced arthritis by activating mast cells[J].Proc Natl Acad Sci U S A,2008,105:109132-109180.
[12] Imaeda H,Takahashi K,Fujimoto T,et al.Epithelial expression of interleukin-37b in inflammatory bowel disease[J].Clin Exp Immunol,2013,172:410- 416.
[13] Ye L,Ji L,Wen Z,et al.IL-37 inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus:its correlation with disease activity[J].Transl Med,2014,12:69.
[14] Wang Y,Colonna M.Interkeukin-34,a cytokine crucial for the differentiation and maintenance of tissue resident macrophages and Langerhans cells[J].Eur J Immunol,2014,44:1575-1581.
[15] Chen Z,Buki K,Vääräniemi J,et al.The critical role of IL-34 inosteoclastogenesis[J].PLoS One,2011,6:e18689.
[16] Wei S,Nandi S,Chitu V,et al.Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells[J].J Leuko Biol,2010,88:495-505.
[17] Chemel M,Le Goff B,Brion R,et al.Interleukin 34 expression is associated with synovitis severity in rheumatoid arthritis patients[J].Ann Rheum Dis,2012,71:150-154.

