支气管哮喘并发过敏性鼻炎患儿外周血Th17细胞及其相关细胞因子表达
苗 青,许 巍,皇惠杰,侯晓玲,朱 康,刘永革,关 辉,王 燕,李 珍,任亦欣,向 莉
(首都医科大学附属北京儿童医院过敏反应科, 北京 100045)
ChinJAllergyClinImmunol,2016,10(4):313- 319
过敏性鼻炎和支气管哮喘均为儿童常见的气道过敏性疾病,其病理损伤为气道慢性炎症反应[1],虽然这两种疾病的病理损伤解剖部位分属上下气道,但由于气道管腔黏膜相连并延展组成了一个结构相似的“连续体”,致使上下气道成为一个统一功能体,故使两种疾病在发病机制、临床表型、治疗管理方面密不可分[2]。我国城市儿童哮喘流行病学调查结果显示:在确诊的哮喘患儿中50.1%伴有过敏性鼻炎[3]。
以往认为,过敏性鼻炎、支气管哮喘等气道过敏性疾病的发生与机体辅助性T细胞(T helper cell,Th)1/Th2免疫应答失衡相关[4]。随着近年来对疾病表型和内表型的深入研究,发现体内存在另一类不同于Th1、Th2的新型辅助性T细胞亚群——Th17细胞,后者通过分泌大量的白细胞介素(interleukin,IL)- 17家族细胞因子,在启动并维持气道炎症过程中发挥着重要的调节作用[5]。已证实哮喘患者支气管肺泡灌洗液、痰、血浆中Th17细胞及其IL- 17水平显著升高,且与哮喘控制水平呈负相关关系[6- 7]。此外,已证实Th17细胞还可以刺激气道上皮细胞分泌大量IL- 8,IL- 8是强效的中性粒细胞趋化因子,可导致以中性粒细胞募集和活化为特点的气道炎症发生。由于Th17细胞与经典Th2细胞介导嗜酸粒细胞增多为特点的气道炎症差异较大[8],故导致这两类患者临床表型也存在较大差异[9- 10]。
虽然Th17细胞亚群的发现对于阐述气道过敏性疾病的免疫病理学机制起到了一定的补充作用,但相较于单纯哮喘患儿、单纯过敏性鼻炎患儿,临床常见的大部分哮喘并发鼻炎患儿是否存在Th17细胞及其相关细胞因子介导的免疫应答差异目前尚不十分清楚。本研究通过比较哮喘、鼻炎、哮喘并发鼻炎患儿及健康儿童间外周血Th17细胞免疫应答差异,希望能够对深入了解Th17细胞在儿童气道过敏性疾病中的免疫调节作用起到一定帮助作用。
资料和方法
对象和分组
本研究共设哮喘组、哮喘并发过敏性鼻炎组、鼻炎组和健康对照组4组。患者入组标准:(1)所有支气管哮喘患者诊断均符合中华医学会呼吸病学分会哮喘学组制订的诊断标准,过敏性鼻炎诊断标准参考中华医学会耳鼻咽喉头颈外科学分会鼻科学组制定的诊断和治疗指南[11- 12];(2)所有入组患儿经体外过敏原半定量筛查方法(Mediwiss,德国)判定为粉尘螨或户尘螨过敏原阳性反应(包括多重阳性致敏患儿,但其他过敏原致敏级别均低于尘螨致敏级别)。排除标准:(1)近4周内有呼吸道感染者;(2)近3个月内使用过口服或静脉应用糖皮质激素和其他免疫抑制剂者;(3)并发其他心肺疾病者或患有呼吸系统其他疾病;(4)正在进行或近3年接受过特异性免疫治疗者。存在上述任一情况者均排除。
健康对照组儿童为同期在本院保健中心查体的年龄、性别匹配的健康体检儿童。入组标准:(1)无过敏性鼻炎、过敏性哮喘、食物过敏等过敏性疾病史;(2)皮肤点刺试验和体外过敏原半定量筛查方法(Mediwiss,德国)判定为粉尘螨或户尘螨过敏原阴性反应。
本研究经医院医学伦理委员会批准,家长均知情同意。
试剂与仪器
FITC标记大鼠抗人CD4单克隆抗体、PE标记小鼠抗人IL- 17单克隆抗体及其匹配的同型对照抗体,细胞固定破膜剂(Fixation/Permeabilization Solution)均购自美国ebioscience公司。佛波酯(phorbol ester,PMA)、离子霉素(Ionomycin)、莫能菌素(Monensin)均购自美国Sigma公司。人淋巴细胞分离液(Ficoll)购自上海博蕴生物科技有限公司,RPMI 1640培养液、胎牛血清购自美国Gibco公司。重组屋尘螨抗原蛋白1(dermatophagoides pteronyssinus1,Der p1)购自Indoor公司。人细胞因子IL- 17、γ-干扰素(interferon-γ,IFN-γ)酶联免疫吸附检测试剂盒购自R&D公司。所有实验操作方法严格按产品说明书进行。FACS Calibur型流式细胞仪为美国贝克曼公司产品。
临床资料和实验室指标检测
呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)检测:采用瑞典Aerocrine公司耐尔斯(NIOX)FeNO检测系统,采用化学发光法进行检测。受试者保持安静状态10 min以上,检测前尽可能将肺内气体呼出至功能残气位,用口含紧NIOX滤器,快速吸气至肺总量位置,然后以均匀气流将气体呼出,维持10 s左右,通过气流限速嘴使呼气流速恒定在50 ml/s,使呼出气达到一个稳定的平台期,保证流速的平台持续时间至少3 s,流速稳定在仪器限定的上下限范围内。系统自动完成测定和分析计算,测定结果以×10-9表示。
肺功能参数测定:采用德国耶格公司生产的儿童肺功能仪。每次启动肺量计时经容量定标器定标。每次开机均采用体温(37 ℃)、标准大气压(101.08 kPa)、饱和水蒸气的气体状态(BTPS)进行校正。测试参考美国胸科学会(American Thoracic Society,ATS)标准,由操作熟练的技师完成。要求受试者取坐位并坐直,双脚着地,头保持自然水平。上鼻夹,用唇紧密包绕咬口器,舌头不能堵塞咬口器,保证口鼻不漏气,避免过紧的腰带、胸带和衣服等。测试前先让受试者练习1~2次。至少测定3次,最佳两次间误差少于5%,且流速容量曲线无异常,时间容量曲线示呼气相出现平台。取最佳值作为记录参数。
外周血嗜酸粒细胞计数:常规采集无名指端血,采用五分类血细胞全自动分析计数仪检测嗜酸粒细胞。
外周血单个核细胞分离
抽取入选研究对象的外周肝素抗凝静脉血2 ml,全血离心后收集血浆于-80 ℃冻存待测,剩余标本经人淋巴细胞分离液(Ficoll)密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),调整PBMC密度至2×106个/ml,悬浮于RPMI 1640培养液中(含10%胎牛血清、100 U/ml青霉素、0.1 mg/ml链霉素)。
外周血Th1及Th17细胞及相关细胞因子检测
取PBMC悬液(2×106个/ml)加入96孔培养板内,将每例患儿的PBMC细胞悬液分为3孔,每孔0.2 ml,分别给予重组Der p1(20 μg/ml)置培养箱中培养48 h(37 ℃、5% CO2),培养最后5 h加入PMA(50 ng/ml)、离子霉素(1 μg/ml)以及高尔基体阻断剂莫能霉素(4 μmol/L)后继续培养。收集细胞后分为同型对照管和实验管,加入异硫氰酸荧光素(fluorescein isothiocyanate, FITC)-CD4荧光标记抗体0.5 μl,避光室温孵育30 min后洗涤弃上清。严格按照试剂盒说明书对细胞进行固定和破膜步骤破膜,加入PE-IFN-γ或PE-IL- 17A抗体,各组均设同型对照,室温避光孵育60 min。洗涤后重悬细胞于300 μl缓冲液中待上机检测。用标准微球校正仪器后,打开CellQuest软件,利用CD4/侧向角散射光(slide scatter, SSC)设门,分别以CD4+IFN-γ+和CD4+IL- 17A+表示Th1细胞和Th17细胞,计算CD4+细胞中Th1细胞亚群和Th17细胞亚群所占比例(%),所有流式数据应用FlowJo软件进行分析。
收取上述冻存血浆和PBMC培养上清液,应用酶联免疫吸附双抗体夹心法检测细胞因子IL- 17A、IL- 17E、IL- 17F水平,按照试剂盒说明书进行操作,每个样本和标准品均设3个复孔。
统计学处理
结 果
研究对象一般资料
本研究共入组罹患气道过敏性疾病患者133例,其中哮喘组患儿41例:男20例,女21例,平均年龄(12.4±4.4)岁;鼻炎组患儿40例:男19例,女21例,平均年龄(14.0±5.2)岁;哮喘并发鼻炎组患儿52例:男32例,女20例,平均年龄(13.5±6.1)岁。另外设立健康对照儿童45例:男27例,女18例,平均年龄(12.7±4.5)岁。四组研究对象年龄、性别和体质量指数等差异无统计学意义(均P>0.05)。肺功能参数、嗜酸粒细胞以及FeNO等临床指标四组间差异有统计学意义(均P<0.05),进一步就上述三项指标在哮喘组、哮喘并发鼻炎组、鼻炎组患儿间进行组间比较,差异无统计学意义(均P>0.05)(表1)。
外周血Th1和Th17细胞亚群所占比例比较
采用流式细胞术检测外周血Th1细胞、Th17细胞所占比例(图1)。外周血Th1细胞亚群在哮喘并发鼻炎组、鼻炎组和哮喘组中所占比例分别为13.2%±5.3%、12.2%±6.7%和12.1%±4.1%,均低于健康对照组(17.0%±5.1%),四组间Th1细胞亚群比例差异有统计学意义(P<0.05)。未观察到哮喘组、鼻炎组、哮喘并发鼻炎组三组患儿间Th1细胞亚群存在组间统计学差异(均P>0.05)。外周血Th17细胞比例分别为哮喘并发鼻炎组1.8%±0.7%、哮喘组1.2%±0.5%、鼻炎组1.1%±0.6%以及健康对照组0.5%±0.4%,四组间差异有统计学意义(P<0.05)。哮喘组、鼻炎组、哮喘并发鼻炎组三组患儿间Th17细胞亚群差异有统计学意义(均P<0.05)(表2)。
外周血及PBMC培养上清中Th17细胞相关细胞因子水平比较
健康对照组相比,三组患儿外周血IL- 17A、IL- 17E水平均显著升高,差异具有统计学意义(均P<0.01)。仅观察到IL- 17E水平在哮喘组、哮喘并发鼻炎组、鼻炎组三组患儿间存在差异,其中哮喘并发鼻炎患儿最高[(19.2±10.4)pg/ml],其次为鼻炎组[(18.1±9.2)pg/ml]、哮喘组[(17.4±9.1)pg/ml],差异具有统计学意义(P<0.05)(表3)。体外水平经尘螨蛋白抗原刺激后,哮喘并发鼻炎组、哮喘组、鼻炎组患儿PBMC培养上清中IL- 17E水平较刺激前均显著升高(均P<0.05),而对健康对照组未造成影响(表4)。
外周血Th17细胞及IL-17E水平与嗜酸粒细胞、FeNO指标间相关性分析
相关性分析发现,仅哮喘并发鼻炎组患儿外周血Th17细胞比例与FeNO水平、外周血嗜酸粒细胞胞计数呈正相关关系(P<0.05)。哮喘并发鼻炎组、哮喘组、鼻炎组患儿外周血血浆IL- 17E水平与FeNO水平、外周血嗜酸粒细胞计数亦存在正相关关系(均P<0.05)(表5)。
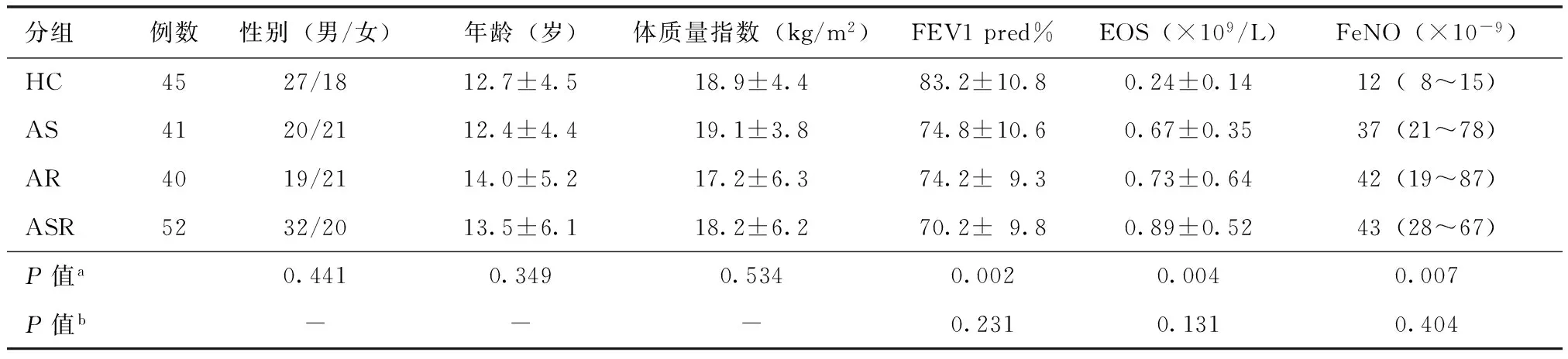
表1 研究对象一般资料比较Table 1 Comparison of demographic and clinical characteristics among enrolled subjects
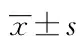
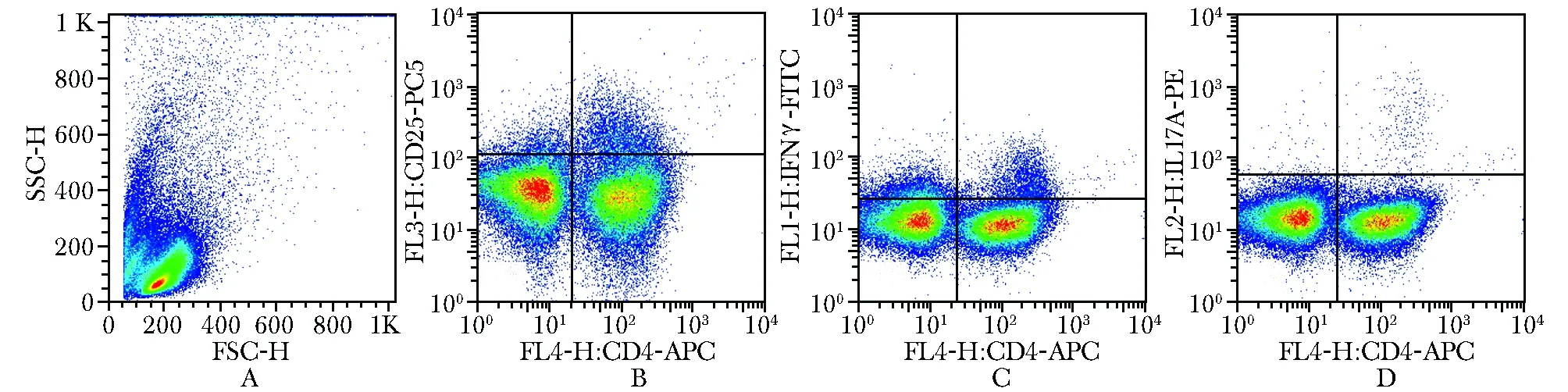
图1流式细胞术检测PBMC中Th1及Th17细胞在CD4+T细胞所占比例
Fig1Detection the percentage of Th1 cells(CD4+IFN-γ+T) and Th17 cells(CD4+IL17-A+T) of CD4+T in peripheral blood by FCM
A:PBMC分析设门;B:PBMC经PMA/ionomycin刺激培养4 h后,CD4+细胞膜表面CD25表达水平;C:胞内表达IFN-γ的CD4+细胞比例(%);D:胞内表达IL- 17A的CD4+细胞比例(%)
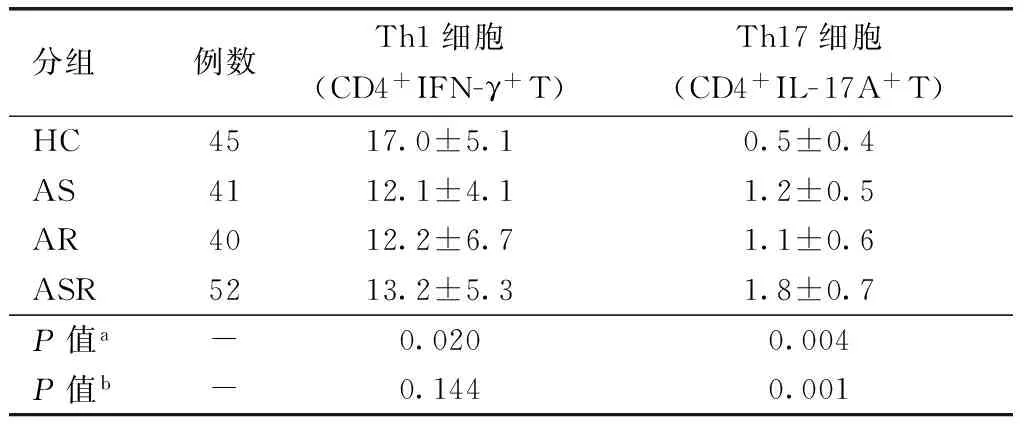
表2 外周血Th1及Th17细胞所占比例比较Table 2 Comparison of percentage of Th1 cells and Th17 cells in CD4+T cells among four groups (x±s,%)
HC:健康对照组; AS:哮喘组;AR:鼻炎组;ASR:哮喘并发鼻炎组;a四组研究对象间(HC组、ASR组、AS组、AR组)比较;b三组患儿间(ASR组、AS组、AR组)比较
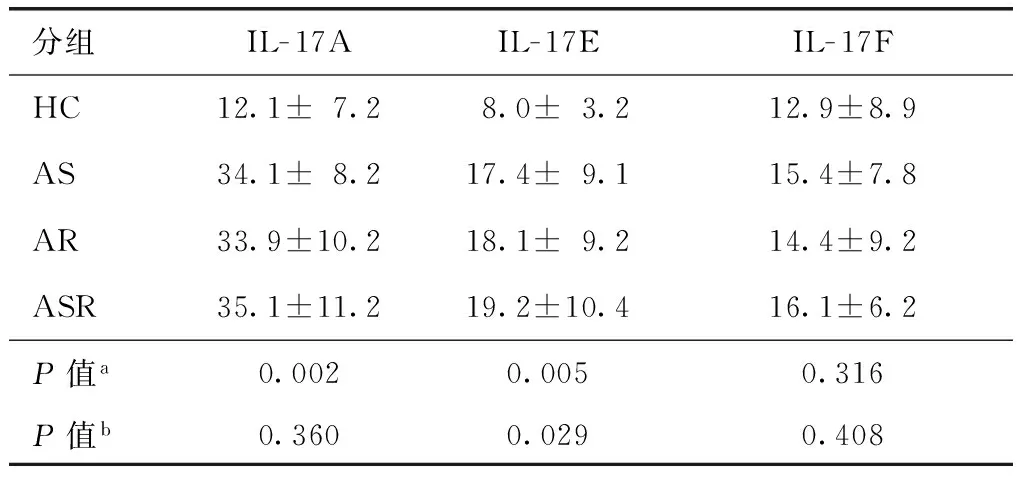
表3 外周血血浆中Th17细胞相关细胞因子水平比较Table 3 Level of Th17 cell related cytokine in plasma (x±s,pg/ml)
HC:健康对照组; AS:哮喘组;AR:鼻炎组;ASR:哮喘并发鼻炎组;a四组研究对象间(HC组、ASR组、AS组、AR组)比较;b三组患儿间(ASR组、AS组、AR组)比较
表4PBMC培养上清中Th17细胞相关细胞因子水平比较
Table4Level of Th17 cell related cytokine in HDM activated PBMC supernants
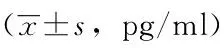
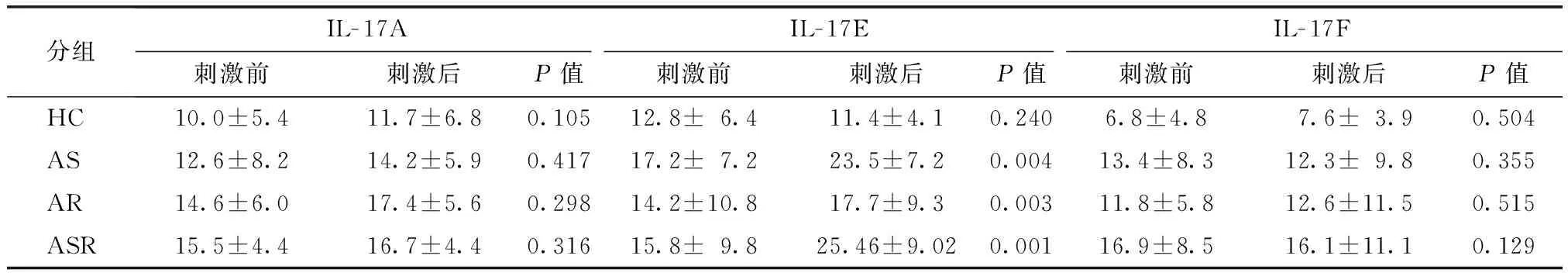
分组IL-17AIL-17EIL-17F刺激前刺激后P值刺激前刺激后P值刺激前刺激后P值HC10.0±5.411.7±6.80.10512.8±6.411.4±4.10.2406.8±4.87.6±3.90.504AS12.6±8.214.2±5.90.41717.2±7.223.5±7.20.00413.4±8.312.3±9.80.355AR14.6±6.017.4±5.60.29814.2±10.817.7±9.30.00311.8±5.812.6±11.50.515ASR15.5±4.416.7±4.40.31615.8±9.825.46±9.020.00116.9±8.516.1±11.10.129
HC:健康对照组; AS:哮喘组;AR:鼻炎组;ASR:哮喘并发鼻炎组
讨 论
过敏性鼻炎和支气管哮喘均属于儿童期常见的气道过敏性疾病,由于两种疾病在病因学、发病机制和病理改变等方面具有很多相似之处,不仅可并发于同一患者,两种疾病还互为风险因素相互影响,病情具有一定关联性。早在2001年世界卫生组织公布了“过敏性鼻炎及其对哮喘的影响”(allergic rhinitis and its impact for asthma,ARIA)指南后,明确提出过敏性鼻炎和哮喘是“同一个气道,同一疾病”的观念,提出了两种疾病同时存在情况下的处理原则,并强调了两者在许多方面均存在相关性[13]。
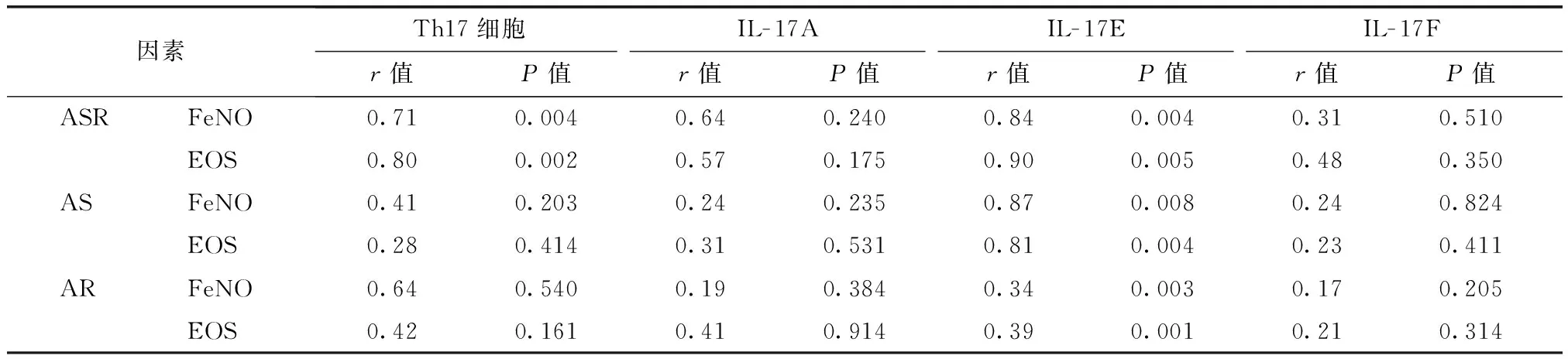
表5 外周血Th17细胞及IL- 17E水平与EOS、FeNO指标间相关性分析Table 5 Correlation analysis among Th17 cell and its cytokine, FeNO level and peripheral EOS
ASR:哮喘并发鼻炎组;AS:哮喘组;AR:鼻炎组;FeNO:呼出气一氧化氮水平;EOS:外周血嗜酸粒细胞
“Th1/Th2”免疫失衡理论的提出,揭示了Th在气道过敏性疾病免疫病理学机制中发挥了重要的调节作用,不同效应T细胞亚群间相互联系、相互牵制所组成的动态平衡网络,对于维持机体的免疫自稳状态起到了积极意义[14]。Th17细胞是近年来发现的一类CD4+T细胞亚群,可通过分泌IL- 17家族细胞因子参与自身免疫性疾病、慢性炎症性疾病及病理过程。已证实:Th17细胞可作用于气道不同靶组织细胞(如气道上皮细胞、平滑肌细胞等)进而分泌大量中性粒细胞趋化因子(如IL- 8等),最终形成以中性粒细胞募集为主的哮喘气道炎症表型[15- 16]。更为值得注意的是,与其他CD4+T细胞亚群相比,Th17细胞具有更高的分化可塑性特点(differential plastic),即在特殊条件下,已分化成熟的Th17细胞可再次向其他谱系分化[17- 18]。Lee等[19]对患有幼年特发性关节炎的患儿关节滑液中各种CD4+T细胞亚群组成进行分析,发现存在一部分高表达CD161分子的非经典型Th1细胞,CD161分子是Th17细胞的特征性分子标志,分析产生此种“Th1/Th17细胞”的原因是在Th17细胞分化后期,其表面表达IL- 12Rβ2分子,能够应答炎症局部Th1型极化因子IL- 12信号,驱动细胞核内Th1型转录因子T-bet的表达。张海龙等[20]研究对强直性脊柱炎患者机体Th1/Th17细胞比例进行分析,发现Th1/Th17平衡关系不仅与病情严重程度相关,且Th1与Th17细胞亚群之间存在相互拮抗的现象。本研究发现,与健康对照组相比,哮喘并发鼻炎组、鼻炎组和哮喘组患儿外周血Th1细胞亚群比例均显著降低;而Th17细胞在哮喘组、鼻炎组、哮喘并发鼻炎组患儿均显著升高,其中哮喘并发鼻炎组患儿外周血Th17细胞比例升高最为明显,提示较单纯罹患哮喘或过敏性鼻炎患儿,临床上常见的哮喘并发鼻炎患儿群体,亦存在由Th17细胞介导的免疫应答反应,且Th17细胞与其他T细胞亚群(如Th1细胞亚群)之间的动态平衡关系,可能对于启动和维持气道炎症反应起到了重要的调节作用。
本研究还对患儿外周血中Th17细胞相关细胞因子水平进行了比较,结果发现与健康对照组相比,哮喘组、鼻炎组以及哮喘并发鼻炎组患儿组外周血IL- 17A、IL- 17E水平均显著性升高。体外水平给予尘螨过敏原蛋白刺激后,可以有效刺激哮喘组、鼻炎组以及哮喘并发鼻炎组三组患儿PBMC分泌IL- 17E因子的能力,而对健康对照组儿童未造成影响,上述结果均提示:Th17细胞及其分泌的前炎症因子IL- 17E在哮喘、过敏性鼻炎等气道过敏性疾病中发挥了重要的免疫调节作用。IL- 17E,又名IL- 25,虽然同属于IL- 17细胞因子超家族,但是由于与其他成员因子同源性较低,决定其生物学功能较其他家族成员也具有明显差异。Fort等[21]在哮喘小鼠动物实验模型中证实,静注IL- 17E可以有效诱导IL- 4、IL- 5和IL- 13基因表达,促进小鼠外周血中IgE、IgG水平升高,血液中嗜酸粒细胞数量增加,使得肺和消化道中均表现出嗜酸粒细胞浸润、黏液分泌、上皮细胞化生等一系列Th2型炎症免疫反应特点的出现,因此有学者提出:IL- 17E在启动和维持放大Th2型气道炎症反应过程中起到了重要的调节作用。本研究通过进行相关性分析发现:哮喘组、鼻炎组和哮喘并发鼻炎组患儿外周血IL- 17E水平升高与Th2型炎症反映指标(FeNO水平、外周血嗜酸细胞数目)之间存在的正相关关系,在一定程度上证实了IL- 17E在Th2型气道炎症反应中可能发挥重要的作用。此外,相关性分析结果还显示仅哮喘并发鼻炎组患儿外周血Th17细胞数量升高与FeNO水平、外周血嗜酸粒细胞计数呈正相关,而在哮喘组、鼻炎组中未观察到上述关系的存在,提示与单纯哮喘组、单纯鼻炎组相比,哮喘并发鼻炎组患儿存在着由Th17细胞介导的免疫应答差异,其发挥的免疫调节作用机制尚有待进一步深入探讨。
综上所述,本研究通过比较哮喘、鼻炎、哮喘并发鼻炎患儿间Th17细胞介导的免疫应答差异,初步探究Th17细胞在气道过敏性疾病中所发挥的免疫调节作用。由于本研究设计为回顾性研究且入组例数较少,未来应继续设计前瞻性研究,进一步明确Th17细胞在儿童气道过敏性疾病病情发展、转归过程中所发挥的免疫调节作用。
[1]Lambrecht BN, Hammad H. The immunology of asthma[J]. Nat Immunol, 2015, 16:45- 56.
[2]全国儿科哮喘协作组,中国疾病预防控制中心环境与健康相关产品安全所.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51:729- 735.
[3]赵京,柏娟,申昆玲, 等.北京、重庆、广州三城市中心城区0~14岁儿童过敏性疾病问卷调查[J].中华儿科杂志,2011,49:740- 744.
[4]Zhu J, Yamane H, Paul WE. Differentiation of effector CD4T cell populations[J]. Annu Rev Immunol,2010,28:445- 489.
[5]Pawankar R, Zemotti ME. Rhinosinuitis in children and asthma severity[J]. Curr Opin Allergy Clin Immunol,2009,9:151- 153.
[6]CoSmi L, Liotta F, Maggi E, et al. Th17 cell: new players in asthma pathogenesis[J]. J Allergy Clin Immunol, 2011,66:989- 998.
[7]Zhao Y, Yang J, Gao YD,et al.Th17 immunity in patients with allergic asthma[J].Int Arch Allergy Immunol,2010,151:297- 307.
[8]Kanagaratham C, Radzioch D. Allergic Asthma: A summary from genetic basis, mouse studies, to diagnosis and treatment[J]. Curr Pharm Des, 2016.
[9]Korn T, Bettelli E, Oukka M, et al. IL- 17 and Th17 Cells[J]. Annu Rev Immunol, 2009,27:485- 517.
[10] Cosmi L, Liotta F, Annunziato F. Th17 regulating lower airway disease[J]. Curr Opin Allergy Clin Immunol, 2016,16:1- 6.
[11] 中华医学会儿科学分会呼吸学组,《中华儿科杂志》编辑委员会.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,54:167- 181.
[12] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组,中华医学会耳鼻咽喉头颈外科学分会鼻科学组.变应性鼻炎诊断和治疗指南(2015年,天津)[J].中华耳鼻咽喉头颈外科杂志,2016,51:6- 24.
[13] Provost D, Iwatsubo Y, Riviere S, et al. The impact of allergic rhinitis on the management of asthma in a working population[J]. BMC Pulm Med, 2015, 15:142.
[14] Lloyd CM, Saglani S. T cells in asthma: influences of genetics, environment, and T-cell plasticity[J]. J Allergy Clin Immunol, 2013,131:1267- 1274.
[15] Newcomb DC. Th17-mediated inflammation in asthma [J]. Curr Opin Immunol, 2013, 25:755- 760.
[16] Vroman H. Mode of dendritic cell activation: the decisive hand in Th2/Th17 cell differentiation. Implications in asthma severity? [J]. Immunobiology, 2015, 220:254- 261.
[17] Maggi L, Santarlasci V, Capone M, et al. Distinctive features of classic and non classic(Th17 derived) human Th1 cells[J]. Eur J Immunol, 2012, 42:3180- 3188.
[18] Annunziato F, Cosmi L, Liotta F, et al. The phenotype of human Th17 cells and their precursors, the cytokines that mediate their differentiation and the role of Th17 cells in inflammation[J]. Int Immunol,2008,20:1361- 1368.
[19] Lee YK, Turner H, Maynard CL, et al. Late developmental plasticity in the T helper17 lineage[J].Immunity,2009,30:92- 107.
[20] 张海龙, 张俊英, 晋学英, 等. Th17细胞、调节性T细胞、Th1细胞平衡失调与AS病情活动度的关系[J]. 医学综述, 2014, 24:4547- 4548,4557.
[21] Fort MM, Cheung J, Yen D, et al. IL- 25 induces IL- 4, IL- 5, and IL- 13 and Th2-associated pathologies in vivo[J]. Immunity,2001,15:985- 995.