扩散加权成像对非手术喉癌和下咽癌患者同步放化疗前后的疗效评价
李依霞,崔园园,崔豹,马露,陈思,杨娜,张爱莲,蔡剑鸣, 2*
扩散加权成像对非手术喉癌和下咽癌患者同步放化疗前后的疗效评价
李依霞1,崔园园1,崔豹1,马露1,陈思1,杨娜1,张爱莲1,蔡剑鸣1, 2*
[摘要]目的 探讨磁共振扩散加权成像联合常规MRI检查评价非手术喉癌下咽癌同步放化疗疗效的应用价值。材料与方法 搜集喉癌下咽癌患者(仅接受放化疗,未行手术治疗)共25例,全部病例均于患病局部活检或手术病理证实。所有患者治疗前均行常规MRI及扩散加权成像(DWI)扫描,分析患者MRI特点、测量肿瘤最大横截面积及表观扩散系数(ADC)值(包括平均ADC值、最低和最高ADC值);治疗后(放化疗结束后1个月内)再次行MRI检查,测残留肿瘤面积及ADC值,并计算肿瘤缓解率。分析治疗前及治疗后肿瘤ADC值与肿瘤缓解率相关性;分析治疗后完全缓解患者(CR组)与非完全缓解患者(非CR组)治疗前、后ADC值及变化的差异。结果 25例喉癌下咽癌患者治疗前肿瘤面积4.81 (0.83~14.12) cm2,治疗后肿瘤面积2.42 (0~7.92) cm2,肿瘤缓解率为74.8% (6.0%~100%),其中有11 (11/25,44.0%)例患者治疗后肿瘤消失。治疗前肿瘤平均ADC值及最高ADC值与治疗后肿瘤缓解率呈负相关(r=–0.922、–0.691,P<0.05),治疗后平均ADC值与缓解率呈正相关(r=0.678,P<0.05);非CR组治疗前肿瘤平均、最高ADC值高于CR组,CR组治疗后平均ADC值及治疗前后平均ADC值的变化高于非CR组,差异有统计学意义(P值均<0.05)。结论 治疗前肿瘤ADC值以及治疗前后肿瘤ADC值的变化对评价非手术喉癌下咽癌放化疗后早期缓解率有一定意义。
[关键词]喉肿瘤;下咽肿瘤;弥散磁共振成像;放射疗法;化学疗法,辅助
作者单位:
1. 中国人民解放军总医院放射诊断科,北京 100853
2. 解放军总医院第一附属医院放射科,北京 100048
蔡剑鸣,E-mail: beili12345@sina.cn
接受日期:2016-01-25
李依霞, 崔园园, 崔豹, 等. 扩散加权成像对非手术喉癌和下咽癌患者同步放化疗前后的疗效评价. 磁共振成像, 2016, 7(3): 185-190.
喉癌和下咽癌是头颈部常见的恶性肿瘤之一,以鳞癌为主,发病率近年呈逐渐上升趋势[1]。头颈部肿瘤的治疗需要综合考虑两方面因素,一是尽可能提高局部控制率,二是尽可能保留器官的功能,故喉部和下咽部中、晚期鳞癌的治疗方法已从常规手术切除加放疗方式逐步转变为联合放化疗治疗方案。因此,如何早期预测、评估肿瘤对放化疗的反应,对于制定个体化治疗方案具有重要临床意义。目前多项研究表明,扩散加权成像(diffusion weighted imaging,DWI)在肿瘤诊断、鉴别诊断、肿瘤治疗后改变、肿瘤复发或残留等方面发挥重要作用[2-4]。笔者旨在探讨表观扩散系数(apparent diffusion coefficient,ADC)值在预测及评价喉癌和下咽癌患者放化疗后早期治疗效果方面的作用。
1 材料与方法
1.1 一般资料
选取2014年1月至2015年8月在我院(中国人民解放军总医院)耳鼻咽喉科就诊的25例喉癌下咽癌患者为研究对象,其中男21例,女4例;年龄42~77岁,平均58.8岁;下咽癌16例,喉癌9例。肿瘤分期:T1期0例,T2期3例(患者拒绝手术),T3期9例,T4期13例。全部病例均经鼻咽镜或喉镜下活检证实为鳞状细胞癌,且均接受放化疗综合治疗,未行手术治疗。本研究经我院伦理委员会批准,所有患者在检查前均了解检查内容,并签署了知情同意书。
1.2 治疗方法
25例患者先行诱导化疗,采用TP方案,TP方案即多西他赛(Docetaxel,T) 70 mg/m2,第1天,顺铂(Cisplatine,P) 40 mg/m2,第1~2天,每21 d为1个周期,共2周期。诱导化疗结束后,行同步放化疗。同步放化疗期间化疗采用TP方案,在放疗期间同步进行。采用调强放射治疗。放疗总剂量70 Gy,每次2.12 Gy,每周5次,共30~33次,近7周。
1.3 检查方法
25例患者均采用GE MR360 1.5 T超导型MR扫描仪进行检查,采用8通道头颈专用联合线圈。患者取仰卧位,平静呼吸,检查中尽量避免咳嗽、吞咽等动作。所有患者于治疗前、治疗后(1个月内)行常规MRI平扫、增强扫描、DWI检查。
常规MRI平扫加增强扫描:横轴面、矢状面、冠状面脂肪抑制序列FSE T2WI (TR 6220 ms, TE 55 ms),横轴面脂肪抑制序列T1WI (TR 529 ms,TE 20 ms) ,增强扫描横轴面、冠状面、矢状面脂肪抑制T1WI,注射对比剂Gd-DTPA (马根维显,德国拜尔公司) ,剂量为0.2 ml/kg。层厚7 mm,层距1 mm,横轴面视野(FOV) 220 mm×220 mm,矩阵256×256,信号平均次数(NEX) 2次;扫描范围从颅底至颈根部。
DWI检查:采用单次激发SE-EPI序列行横轴面扫描。TR 4500 ms,TE 80.5 ms,b=0及600 s/mm2,FOV 220 mm×220 mm,矩阵256×256,层厚7 mm,层距1 mm。
1.4 图像分析
MRI图像分析所有MRI图像均由2名具有丰富MRI诊断经验的放射科医师在不知其病理及疗效的情况下共同阅片诊断、评估及测量,以2名医师共同意见为诊断结果。主要观测病变区域治疗前、后的MRI表现。
感兴趣区选择及数据测量以平扫T2WI及DWI序列为参照,在横轴面增强T1WI图像上测量治疗前、治疗后肿瘤最大横截面积。于GE AW 4.5工作站采用Functool软件勾画治疗前肿瘤最大横截面作为ROI治疗前,获取平均ADC值;依据肿瘤最大横截面ADC图,于扩散受限最轻及最重处分别勾画ROI最高及ROI最低(面积10~30 mm2,注意避开出血或坏死区域),获取最高ADC值及最低ADC值。勾画治疗后CR组原肿瘤区域解剖结构(如:治疗前声门型喉癌累及声门旁间隙,治疗后未见明显肿块,则勾画原肿瘤区域声带、声门旁间隙解剖结构作为ROI);非CR组残存肿瘤最大横截面积为ROI治疗后,获取该区域平均ADC值。
1.5 疗效评价标准
2名有经验放射诊断科医生分别在治疗末(治疗结束1个月内)未知疗效的情况下评价肿瘤的缓解情况。按照实体肿瘤疗效评价标准 RECIST (response evaluation criteria in solid tumors)[5]对病灶区域肿瘤缓解情况评价疗效:(1)完全缓解(complete response,CR):肿瘤完全消失,肿瘤缓解率为100%;(2)部分缓解(partial response,PR):肿瘤部分缓解,未完全消失,但肿瘤缓解率大于等于30%;(3)病变稳定(stable disease,SD):肿瘤稳定进展,肿瘤缓解率小于30%。肿瘤缓解率=(治疗前面积-治疗后面积)/治疗前面积×100%。
1.6 统计方法
所有统计分析采用SPSS22.0 统计软件完成。采用Kolmogorov-Smirnov Z检验进行正态性检验,经正态性检验显示,所有相关测量项目的结果均服从正态分布(P>0.05)。以Pearson线性相关分析分析不同分期肿瘤ADC值与肿瘤缓解率的相关性。采用两独立样本t检验进行CR组与非CR组肿瘤治疗前、后平均ADC值、最高及最低ADC值的差异比较。P<0.05为差异有统计学意义。

图1 男,61岁,下咽癌(T4bN2M0)。治疗前(A~D):T2WI (A)示病灶位于左侧下咽部,累及左侧喉旁间隙;左侧颈内静脉旁淋巴结明显肿大;增强扫描(B),病灶呈不均匀强化,轴面最大横截面积为4.43 cm2(A、B);DWI (C)示病灶呈明显高信号;ADC图(D)测病灶平均ADC值为0.97×10–3mm2/s,最高ADC值为1.05×10–3mm2/s,最低ADC值为0.86×10–3mm2/s。治疗后(E~H):T2WI (E)和增强扫描(F)示治疗后未见明显肿块,原肿大淋巴结明显缩小,未见确切显示;肿瘤缓解率为100%;DWI (G)未见明显异常高信号;ADC图(H)测得原肿瘤区域解剖结构平均ADC值为2.21×10–3mm2/s。评价治疗疗效为CRFig. 1 Male, 61 years old, hypopharyngeal carcinoma (T4bN2M0). Pre-Tx (A—D): There was a lesion located in the left side of the hypopharynx, involving the left laryngeal space, which showed hyperintensity on T2WI and obvious inhomogeneousenhancement. The lymph node near the left internal jugular vein was significantly enlarged. The axial maximum cross sectional area was 4.43 cm2(A,B). The lesion showed hyperintensity on DWI (C). ADC map (D) showed ADCmean=0.97×10–3mm2/s, ADChigh=1.05×10–3mm2/s, and ADClow=0.86×10–3mm2/s. Post-Tx (E—H): No tumor mass and enlarged lymph nodes were detected on the matched T2WI (E) and post-T1WI (F) The remission rate of the tumor was 100%. There was no obviously high signal on DWI (G). The ADCmeanof the corresponding regional anatomical structure was 2.21×10–3mm2/s on ADC map (H). The curative effect was CR.
2 结果
2.1 病变治疗前、后MRI表现
不同部位肿瘤治疗前均侵犯周围邻近组织结构(如治疗前肿瘤可累及咽后壁、环后区、梨状窝、左右室带、声带、杓会厌皱襞以及周围各间隙等,黏膜明显增厚),T1WI上呈不均匀等、低信号,T2WI上呈均匀或不均匀稍高、高信号,增强后病变呈不同程度明显强化,DWI呈稍高或高信号。治疗后,肿瘤均明显减小或消失,病变区域T1WI等或稍低信号,T2WI呈稍高或高信号,增强后呈均匀或不均匀强化,DWI呈等或稍高信号(图1,2)。
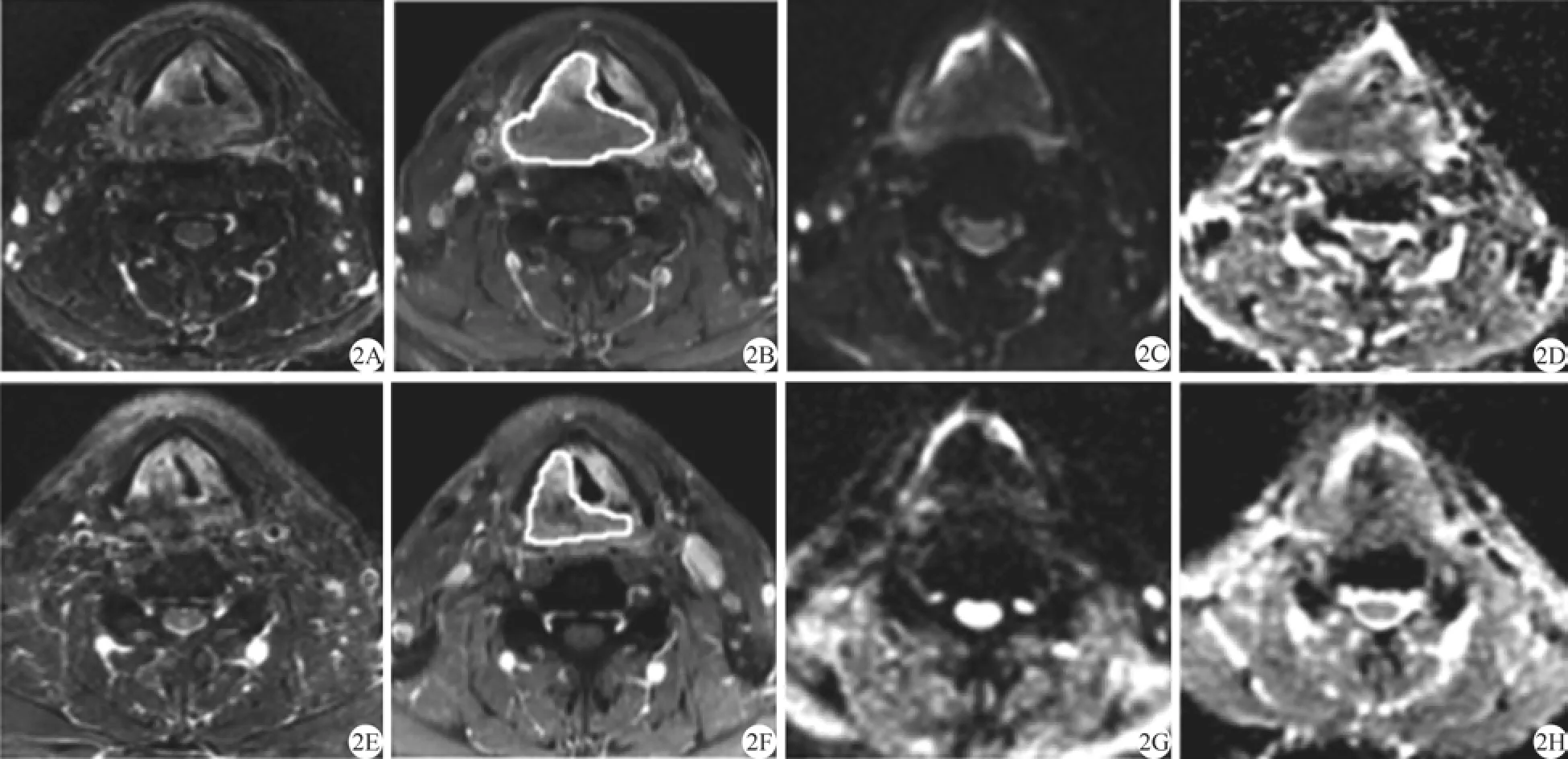
图2 男,60岁,下咽癌(T4N2M0)。治疗前(A~D): T2WI (A)示病灶位于右侧下咽部,累及右侧喉旁间隙、室带及声带;增强扫描(B),病灶呈明显不均匀强化,轴面最大横截面积为8.01 cm2;DWI (C)示病灶呈稍高信号;ADC图(D)测病灶平均ADC值为1.22×10–3mm2/s,最高ADC值为1.37×10–3mm2/s,最低ADC值为0.91×10–3mm2/s。治疗后(2E-2H): T2WI (E)和增强扫描(F)示治疗后仍见肿块,残存肿瘤最大横截面积为4.89 cm2,肿瘤缓解率为38.9%;DWI (G)病灶呈稍高信号;ADC图(H)测得残存肿瘤平均ADC值为1.56×10–3mm2/s。评价治疗疗效为非CRFig. 2 Male, 60 years old, hypopharyngeal carcinoma (T4N2M0). Pre-Tx(A—D): There was a lesion located in the right side of the hypopharynx, involving the right of laryngeal space, the right ventricular fold and vocal cord. The lesion showed obviously inhomogeneous enhancement. The axial maximum cross sectional area was 8.01 cm2(A, B). The lesion shows hyperintensity on DWI (C). ADC map showed ADCmean=1.22×10–3mm2/s, ADChigh=1.37×10–3mm2/s, and ADClow=0.91×10–3mm2/s. Post-Tx (E—H): The size of the mass was decreased on T2WI (E) and post T1wi (F) after the treatment. The maximum cross-sectional area was 4.89 cm2and the remission rate of the tumor was 38.9%. The residual lesion showed slight hyperintensity on DWI (G). The ADCmeanof the residual tumor was 1.56×10–3mm2/s on ADC map (H). The curative effect was non-CR.
2.2 病变面积变化及疗效评价
25例患者治疗前肿瘤最大横截面积平均为4.81 (0.83~14.12) cm2,治疗后肿瘤最大横截面积平均为2.42 (0~7.92) cm2。11例患者于治疗后1个月内复查肿瘤完全消失。CR组患者11例(11/25,44.0%),非CR组患者14例(14/25,56.0%)。缓解率为74.8% (6.0%~100%)。
2.3 不同分期肿瘤ADC值与肿瘤缓解率相关性分析
T3期患者治疗前肿瘤平均ADC值与缓解率呈负相关。T4期患者治疗前肿瘤平均、最高、最低ADC值与缓解率呈负相关。所有患者治疗前肿瘤平均和最高ADC值与缓解率呈负相关,治疗后平均ADC值与缓解率呈正相关(表1)。
2.4 CR组及非CR组肿瘤ADC值比较
非CR组治疗前肿瘤平均、最高ADC值均高于CR组,CR组治疗后肿瘤平均ADC值及治疗前后肿瘤平均ADC值变化高于非CR组,差异有统计学意义(P<0.001;表2)。
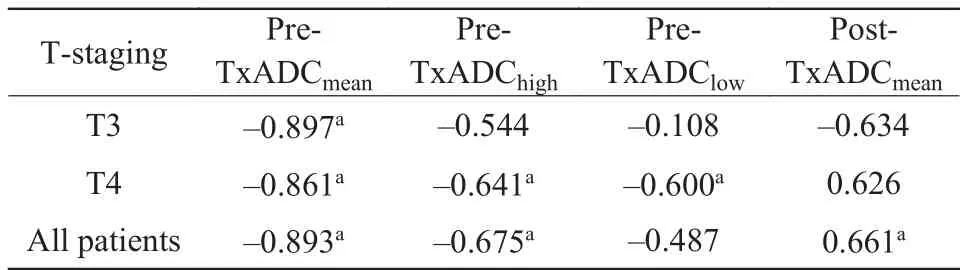
表1 各时期ADC值与肿瘤缓解率的相关系数Tab. 1 Correlation between ADC value and the remission rate of the tumor

表2 CR组和非CR组治疗前后ADC值比较Tab. 2 Comparison of Pre-Tx and Post-TxADCmeanbetween the CR group and the Non-CR group
3 讨论
MRI成像可清楚显示软组织结构,目前已成为头颈部肿瘤治疗后随访检查的重要方法,可以准确地观测病灶于治疗前、治疗后的变化情况。DWI以施加扩散敏感梯度场测量组织信号强度的变化,反映活体组织在生理和病理生理状态下水分子微观运动的情况,提供肿瘤细胞密度、细胞膜完整性的组织病理学信息,对肿瘤治疗前后的微环境变化较为敏感,并能监测肿瘤治疗过程中组织成分的变化和病理学改变[6-7]。DWI采用表观扩散系数对活体内水分子扩散运动状态进行定量描述。恶性肿瘤细胞往往呈堆积生长,细胞密度升高,细胞外间隙减少,水分子扩散受限程度较重,因此常表现为DWI高信号、ADC值减低的特点[8]。
研究证实DWI在肿瘤诊断及鉴别诊断中有显著作用,并发现DWI成像更适用于肿瘤的疗效监测及评估。治疗前肿瘤的ADC值越小,治疗效果越好;ADC值越大,疗效越差[3, 9]。Kim等[9]通过对40例头颈部鳞癌患者研究,完全缓解者与部分缓解者治疗前的ADC值分别为1.04 ± 0.19×l0–3mm2/s 及1.35 ± 0.30×l0–3mm2/s,完全缓解者明显低于部分缓解者,两者有统计学意义(P<0.05),同时发现同步放化疗第1周时ADC值就有所上升,完全缓解者比部分缓解者有更大的升幅。说明治疗前ADC值的测定及治疗后ADC值变化的幅度可以预测头颈部恶性肿瘤放化疗的效果。Vandecaveye等[10]通过监测30例头颈部鳞癌患者治疗前、同步放化疗后第2周及第4周ADC值的变化,发现完全缓解患者较复发患者治疗早期的ADC值变化更为显著(P<0.01)。Lambrecht等[11]利用多b值平估治疗前头颈部鳞状细胞癌患者的治疗疗效,单变量分析发现,ADChigh、ADCavg越高,病变复发可能性越大;而多变量分析发现,ADChigh越高、肿瘤体积越大,则病变预后越差。研究表明,ADChigh是评价头颈部鳞状细胞癌预后的独立影响因素。林蒙等[12]应用DWI成像对65例鼻咽癌同步放化疗患者进行研究,研究结果显示治疗前ADC值预测鼻咽癌疗效价值较高,治疗前肿瘤平均和最高ADC值与肿瘤消退率均呈负相关(P<0.001),以肿瘤治疗前平均ADC值1.09×10-3mm2/s为界值预测肿瘤CR,其敏感度、特异度和准确性分别为82.5%、76.0%和80.0%,AUC为0.816,显示DWI及ADC值能够较好地预测鼻咽癌治疗疗效,可为鼻咽癌个体化治疗提供客观依据。不过,也有研究[13-14]显示治疗前肿瘤ADC值对区分治疗有效组和无效组无意义。
我们希望寻求一种无创、快速、高效的检查手段来准确评判、预测非手术喉癌下咽癌患者同步放化疗的治疗效果,从而为肿瘤治疗策略的制定、修改提供依据。本次研究结果显示,治疗前肿瘤平均及最高ADC值与缓解率呈负相关,治疗后肿瘤平均ADC值与缓解率呈正相关(P<0.05)。非CR组治疗前肿瘤平均、最高ADC值均高于CR组,CR组治疗后肿瘤平均ADC值及治疗前后肿瘤平均ADC值变化高于非CR组,差异有统计学意义(P<0.001),表明放化疗造成肿瘤细胞变性、坏死,细胞外间隙变大,水分子扩散受限降低,ADC值升高,肿瘤内部出现乏氧区域、放化疗不敏感区域,治疗前后ADC的变化可作为治疗效果监测指标。但是本次研究尚有诸多不足:(1)仅研究治疗前及治疗后1个月内的肿瘤变化情况,为短期随访;(2)ROI的选择方面,人为因素较大,位置上的偏差及区域勾画都会对结果产生影响;(3)病例数较少,并缺乏对PR、SD患者的单独分析;(4)治疗后部分患者会存在局部水肿、急性放射损伤等会造成治疗后ADC值偏高,可能会夸大ADC值变化对疗效判断的作用。今后会进一步改进,扩大病例数,以获得更准确的结果为临床提供治疗依据。
综上所述,治疗前肿瘤ADC值以及治疗前后肿瘤ADC值的变化对评价非手术喉癌下咽癌患者放化疗后早期缓解率有一定意义。
参考文献[References]
[1]Jaseviciene L, Gurevicius R, Obelenis V, et a1. Trends in laryngeal cancer incidence in Lithuania: a future perspective. Int J Occup Med Environ Health, 2004, 17(4): 473-477.
[2]Chen X, Xian J, Wang X, et al. Role of periodicaly rotated overlapping parallel lines with enhanced reconstruction diffusion-weighted imaging in correcting distortion and evaluating head and neck masses using 3 T MRI. Clin Radiol, 2014, 69(4): 403-409.
[3]Thoeny HC, De Keyzer F, King AD. Diffusion-weighted MR imaging in the head and neck. Radiology, 2012, 263(1): 19-32.
[4]Razek AA, Sadek AG, Kombar OR, et al. Role of apparent diffusion coefficient values in diferentiationbetwen malignant and benign solitary thyroid nodules. Am J Neuroradiol, 2008, 29(3): 563-568.
[5]Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumors: revised recistguideline (version 1.1). Eur J Cancer, 2009, 45(2): 228-247.
[6]Chen JY, Lin Q, Tang LL, et al. Clinical value of apparent diffusion coeffcient and quantitative parameters of MR dynamic enhancement of rectal cancer. Chin J Magn Reson Imaging, 2015, 6(9): 673-676.陈金银, 林祺, 汤琅琅, 等. 直肠癌表观扩散系数与MR动态增强定量参数的临床价值. 磁共振成像, 2015, 6(9): 673-676.
[7]Liu SG, Ren RM. The application and development of diffusion-weighted imaging in the tumor response of anticancer treatments. Chin J Clinicians (Elect Ed), 2015, 9(2): 325-329.柳善刚, 任瑞美. 弥散加权成像在肿瘤疗效监测和评估中的应用及进展. 中华临床医师杂志, 2015, 9(2): 325-329.
[8]Luo DH, Lin M, Su DK. Imaging progress of head and neck carcinoma. Chin J of Oncol Prev Treat, 2015, 7(3): 154-156.罗德红, 林蒙, 苏丹柯. 头颈部肿瘤影像进展. 中国癌症防治杂志, 2015, 7(3): 154-156.
[9]Kim S, Loevner L, Quon H, et al. Diffusion weighted magnetic resonance imaging for predicting and detecting early response to chemoradiation therapy of squamous cell carcinomas of the head and neck. Clin Cancer Res, 2009, 15(3): 986-994.
[10]Vandecaveye V, Dirix P, De Keyzer F, et al. Predictive value of diffusion-weighted magnetic resonance imaging during chemoradiotherapy for head and neck squamous cell carcinoma. Eur Radiol, 2012, 20(7): 1703-1714.
[11]Lambrecht M, Van Calster B, Vandecaveye V, et al. Integrating pretreatment diffusion weighted MRI into a multivariable prognostic model for head and neck squamous cell carcinoma. Radiother Oncol, 2014, 110(3): 429-34.
[12]Lin M, Yu XD, Zhao YF, et al. Diffusion-weighted imaging for predicting therapeutic effect of chemoradiotherapy in nasopharyngeal carcinoma. Chin J Med Imaging Technol, 2014, 30(7): 986-990.林蒙, 余小多, 赵燕风, 等. 扩散加权成像表观扩散系数预测鼻咽癌同步放化疗疗效. 中国医学影像技术, 2014, 30(7): 986-990.
[13]King AD, Chow KK, Yu KH, et al. Head and neck squamous cell carcinoma: diagnostic performance of diffusion-weighted MR imaging for the prediction of treatment response. Radiology, 2013, 26(2): 531-538.
[14]Chawla S, Kim S, Dougherty L, et al. Pretreatment diffusionweighted and dynamic contrast-enhanced MRI for prediction of local treatment response in squamouse cell carcinomas of the head and neck. AJR Am J Roentgenol, 2013, 200(1): 35-43.
The value of diffusion-weighted imaging for clinical evaluation of chemoradiatiotherapy of non-surgical laryngeal and hypopharyngeal carcinoma patients
LI Yi-xia1, CUI Yuan-yuan1, CUI Bao1, MA Lu1, CHEN Si1, YANG Na1, ZHANG Ailian1, CAI Jian-ming1, 2*1Department of Radiology, Chinese PLA General Hospital, Beijing 100853, China
2Department of Radiology, the First Affiliated Hospital of Chinese PLA General Hospital, Beijing 100048, China
*Correspondence to: Cai JM, E-mail: beili12345@sina.cn
Received 2 Dec 2015, Accepted 25 Jan 2016
AbstractObjective: To investigate the value of the magnetic resonance diffusion weighted imaging combined with conventional MRI for predicting clinical effect of chemoradiotherapyin non-surgical laryngeal and hypopharyngeal carcinoma. Materials and Methods: A total of 25 cases of patients with non-surgical laryngeal and hypopharyngeal carcinoma, which was confirmed by biopsy or surgical pathology, were included. All patients underwent conventional MRI and DWI scan for pre- and post-treatment. The maximum cross sectional area and apparent diffusion coefficient (ADC) value (the mean, the highest and lowest ADC value) of the tumor were measured before treatment. The residual tumor size and ADC values were measured after treatment, and tumor regression rate was calculated. The differences of ADC values with complete response (CR) and non-CR before and after treatment were analyzed. Results: The maximum cross sectional area [2.42 (0—7.92) cm2] of the tumor after treatment was significantly reduced (P<0.05) than that from pre-treatment [4.81 (0.83—14.12) cm2]. The total tumor remission rate was 74.8% (6.0%—100%) and CR was in 11 (11/25, 44.0%) patients. Pre-treatment ADC(mean)and the highest ADC value were negatively correlated with the rate of tumor regression (r=-0.922, -0.691, P<0.05), and post-treatment ADC(mean)value was positively correlated with thebook=186,ebook=33regression rate (P<0.05, r=0.678). Pre-treatment ADC(mean)and ADC(high)values in non CR group were higher than those in the CR group. Post-treatment ADC(mean)value and differences of the ADC value between pre- and post-treatment of CR group were significantly higher than those of non CR group (P<0.05). Conclusions: The pre-treatment ADC values and the differences of the ADC value between pre- and post-treatment might be useful to predict and evaluate the response of radiotherapy and chemotherapy in the non-surgical laryngeal and hypopharyngeal carcinoma patients.
Key wordsLaryngeal neoplasms; Hypopharyngeal neoplasms; Diffusion magnetic resonance imaging; Radiotherapy; Chemotherapy, adjuvant
DOI:10.12015/issn.1674-8034.2016.03.005
文献标识码:A
中图分类号:R445.2;R739.65
收稿日期:2015-12-02
通讯作者:

