CSMD1基因rs1613815基因型与肝细胞肝癌临床病理特征的关系
陈万勇 张文韬 周晨浩 沈英皓 刘彬彬 任 宁
(复旦大学附属中山医院肝外科 上海 200032)
CSMD1基因rs1613815基因型与肝细胞肝癌临床病理特征的关系
陈万勇▲张文韬▲周晨浩沈英皓刘彬彬任宁△
(复旦大学附属中山医院肝外科上海200032)
【摘要】目的 探讨肝细胞肝癌患者中CSMD1基因rs1613815基因型与临床病理特征的关系。 方法选取2009年1—7月复旦大学附属中山医院肝外科收治的经病理确诊的肝细胞癌(hepatocellular carcinoma,HCC)患者146例,收集患者的临床和病理资料。根据我们前期预实验研究结果,采用美国Sequenom公司建立的MassARRAY检测平台分析CSMD1基因rs1613815位点的各种基因型,回顾性分析其与HCC患者临床病理资料的关系。Kaplan-Meier法和COX回归模型用于评估其预后价值。 结果在146例HCC标本中,rs1613815位点AA、AC和CC基因型分别有33例、49例和64例。其中在中晚期HCC患者中,携带AC/CC基因型的患者其癌栓(含肉眼癌栓和镜下癌栓)发生率明显高于携带AA基因型的患者(70.6%vs.36.4%),差异具有统计学意义(P=0.039);携带AC/CC基因型的患者处于T2-4N0M0期的比例明显高于携带AA基因型的患者(59.8%vs.31.2%),差异同样具有统计学意义(P=0.004)。而在年龄、性别、HbsAg、肿瘤直径和数目及血清甲胎蛋白(alpha-fetoprotion,AFP)水平等分组中,AC/CC基因型和AA基因型所占的比例之间差异无统计学意义(P>0.05)。在肿瘤直径≥5 cm的患者中,携带AA基因型的患者术后总生存率和无瘤生存率明显高于携带AC/CC基因型的患者(P值分别为0.023和0.005)。 结论CSMD1基因rs1613815 多态性与肝细胞肝癌患者的癌栓形成和TNM分期较晚密切相关,提示其具有较高的转移潜能和不良预后。
【关键词】肝细胞肝癌;CSMD1基因;单核苷酸多态性;转移
肝细胞肝癌(hepatocellular carcinoma,HCC)是人类最常见且预后差的恶性肿瘤之一,严重威胁着人类的生存,即使外科手术切除,其术后转移和复发率依然很高。根据最新发布的全球癌症统计数据显示,2012年全球肝癌新发病例数超过78万人,而死亡病例数则接近75万人[1]。尽管人们已明确HCC的发生与慢性肝炎、肝硬化、长期酗酒等因素有关,但其分子发病机制尚不明确[2]。
单核苷酸多态性(single nucleotide polymorphism,SNP)是不同个体DNA序列上单个碱基的差异,是人类可遗传变异中最常见的一种,人类染色体上平均每1000个碱基对中就会出现1个SNP。最新的研究显示SNP不仅与肿瘤的遗传易感性、肿瘤的预后有关[3],甚至还与化疗药物作用的个体敏感性和耐药性密切相关[4-5]。而在肝癌研究中也有相关报道[6-7]。我们前期研究发现位于OPN启动子区域的-433等位基因及其相关的单体型(Ht2,Ht3)SNP能够作为HCC的特异性预测指标。其Ht2以及-443TT基因型通过增加OPN启动子活性并促进表达,从而加速HCC肿瘤细胞的生长和肺部转移[8]。同样,位于HTPAP启动子区域的SNP中,启动子I单体型启动子较启动子Ⅱ和启动子Ⅲ单体型启动子转录活性显著增强,可导致不同水平的基因转录,统计学分析显示启动子Ⅱ+启动子Ⅲ单体型是HCC术后复发的独立相关因子[9]。这些研究均证实关键基因的SNP及其单体型可影响HCC转移和复发。因此,揭示SNP与肿瘤发生和发展的关系、探索与肿瘤临床表型相关的基因型(genotype)并将其作为分子标志应用于肿瘤防治是研究热点。
CSMD1 (CUB and Sushi multiple domains 1) 基因是2001年被发现的候选抑癌基因,位于8p23.2,大小超过2 Mb,含有72个外显子,编码一种含14个CUB结构域和28个Sushi结构域的跨膜蛋白(即CSMD1蛋白)。其中CUB结构域位于细胞外,由氨基酸残基组成,其结构与免疫球蛋白的β-桶状结构相似,参与机体的发育过程;Sushi结构域又称补体调控蛋白功能结构域或短的共有序列重复(short consensus repeats,SCR),广泛存在于补体和黏着蛋白中。现已证实,CSMD1基因在脑、视网膜、睾丸及胎儿肝脏和脾脏等人体组织和器官均有不同程度的表达。目前,CSMD1基因异常与多种疾病的发生存在着密切的关系,如精神分裂症、自闭症、高血压、结直肠癌等[10-13]。
根据前期预实验的结果,本研究拟采用美国Sequenom公司建立的Massarray检测平台分析收集的HCC样本检测候选抑癌基因CSMD1基因rs1613815位点的不同基因型,回顾性分析各基因型在不同临床表型之间分布频率的差异,进而探讨该位点多态性作为预测HCC疾病进展的可能性。
材 料 和 方 法
研究对象及筛选标准选取2009年1月至2009年7月复旦大学附属中山医院肝外科收治的经病理确诊的HCC患者146例,收集患者的临床资料和随访资料用于本研究的回顾性分析。TNM分期采用2010年国际抗癌联盟(UICC)/美国癌症联合委员会(AJCC)制定的TNM分期标准。本研究经复旦大学附属中山医院伦理委员会的批准,所有研究对象均签署知情同意书。
入选标准:原发性肝癌患者;术前肝功能Child A级或Child B级且并未接受任何治疗;肿瘤均由根治性手术切除,切缘阴性无残癌;术后病理证实为HCC。
排除标准:转移性肝癌患者;术前肝功能Child C级或术前接受TACE、射频、PEI等治疗;术后病理提示胆管细胞癌、混合细胞癌等非肝细胞肝癌。
主要试剂和仪器QIAamp DNA mini kit试剂盒(德国Qiagen公司),GeneAmp P9700型PCR仪(美国ABI公司),iPLEXTMReagent Kit(美国Sequenom 公司),PCR 扩增引物、单碱基延伸引物由深圳华大基因公司合成,芯片点样采用韩国三星公司提供的MassARRAYTMNanodispenser点样仪,MassARRAY 时间飞行质谱生物芯片系统(美国Sequenom 公司),HotStarTaq DNA聚合酶(1000 U)(包括4×250 units HotStarTaq DNA聚合酶,10×PCR缓冲液,25 mmol/L MgCl2,德国Qiagen公司),dNTP混合物(TaKaRa公司)。
DNA提取严格按照QIAamp DNA mini kit试剂盒说明书提取癌组织DNA。在提取 DNA 后,取 DNA 样品1 μL,用NanoDrop 2000(Thermo公司,美国)检测 DNA 浓度和纯度。若吸光度D260/D280达到1.8~2.0,则认为该DNA 纯度合格。随后将合格的DNA提取物置于-80 ℃冰箱备用。
引物设计和合成应用Sequenom公司Genotyping Tools及MassARRAY Assay Design 软件设计CSMD1基因rs1613815位点的PCR扩增引物及单碱基延伸引物。其中,正向引物:5′-ACGTTGGATGCACAGCTACACATGAAGACC-3′;反向引物:5′-ACGTTGGATGCACTCTTA-TTTTCCAGGAAG-3′;单碱基延伸引物:5′-CGTTTGATTCTAATCCTGGACC-3′,正反引物和单碱基延伸引物均由深圳华大基因公司合成和纯化。
PCR 扩增和SAP纯化PCR扩增反应按照5.0 μL体系进行,其中包含模板DNA1.0 μL,上下游引物1.0 μL,2.5 mmol/L dNTP 1μL,5 U/μL Hotstar Taq 0.1 μL,10×PCR缓冲液0.625 μL,25 mmol/L MgCl20.325 μL,剩余体积用纯化水补足。反应条件严格按照说明书进行。反应产物4 ℃保存备用。
PCR反应产物用SAP处理,以便去除体系中剩余的dNTP。反应体系总体积为7 μL,其中包括PCR扩增反应的产物5 μL,10 × SAP缓冲液0.17 μL,1 U/μL SAP酶0.3 μL,剩余体积纯化水补足。反应条件严格按照说明书进行。反应产物4 ℃保存备用。
单碱基延伸反应反应体系包含经SAP处理后的PCR产物7 μL,各延伸反应的引物混合物0.804 μL,iPLEX酶0.041 μL,延伸终止混合物0.2 μL,10×iPLEX 缓冲液0.2 μL以及纯化水0.755 μL,使得总体积达到9 μL。反应条件严格按照说明书进行。反应产物4 ℃保存。
芯片点样、质谱检测及结果输出每个延伸反应产物用6 mg Clean Resin纯化,随后将纯化后的产物转移到表面覆盖基质的SpectroCHIP 芯片上,采用 MassARRAY 时间飞行质谱生物芯片系统对CSMD1基因 SNP 位点进行检测,通过TYPER 4.0 软件分型并输出结果。
统计学分析采用SPSS 19.0软件进行分析,各基因型在癌栓和无癌栓组之间、T1N0M0期和T2-4N0M0期之间和其他临床病理资料之间的频率分布比较利用χ2检验,必要时采用Fisher′s精确检验,并计算比值比(odds ratios,OR)及其95%CI来表示该基因型与该因素的关联强度。采用Kaplan-Meier法和Log-rank检验绘制生存曲线,计算并比较两组生存率差异。COX回归模型用于评估各临床病理资料、rs1613815基因型与HCC预后的关系。所有统计分析均为双侧检验,P<0.05为差异具有统计学意义。
结果
HCC患者临床病理资料本研究按照筛选标准共收集146例HCC患者,包括男性125例(85.6%)和女性21例(14.4%),平均年龄为(52.9±11.0)岁。82.2%的患者乙肝阳性。平均最大肿瘤直径为(5.54±3.49)cm,血清AFP平均值为4743.8 ng/mL(平均AFP值对数值为2.04±1.39)。仅2例患者存在肝门淋巴结转移,其余均为N0M0。按照UICC制定的分期标准,肿瘤I期67例(45.9%),Ⅱ期31例(21.2%),Ⅲa和Ⅲb期共46例(31.5%),Ⅳ期2例(1.4%)。130例(89.0%)有肝硬化,105例为单发病例。
CSMD1基因rs1613815位点基因分型结果采用美国Sequenom公司建立的Massarray检测平台分析,根据本次研究的146例HCC样本基因分型的结果显示(图1),CSMD1基因rs1613815位点存在AA、AC和CC 3种基因型,其中AA基因型有33例、AC基因型有49例、CC基因型有64例。
Using the MassARRAY system,3 genetypes were detected in rs1613815,which included AA genetype (A),AC genetype (B) and CC genetype (C).
图1rs1613815位点MassARRAY检测结果
Fig 1Results of MassARRAY detection for rs1613815
CSMD1基因rs1613815基因型与HCC癌栓的关联分析在146例HCC标本中,52例有癌栓(包括肉眼癌栓和镜下癌栓),94例无癌栓。由于处于I期的67例患者无癌栓分布,为排除肿瘤分期对癌栓分布的影响,本研究拟分析中晚期(Ⅱ~Ⅳ期)肝癌中rs1613815多态性与肿瘤癌栓的关系,其中CSMD1基因rs1613815各基因型分布及其频率如表1所示。结果发现,若以AA基因型为参照,在68例携带非AA基因型的患者中,48例有癌栓,其癌栓发生率为70.6%,而在11例携带AA基因型的患者中,仅4例发生癌栓(36.4%),差异具有统计学意义(P=0.039)。这提示携带非AA基因型的患者,其癌栓发生率要明显高于携带AA基因型的患者。

表1 rs1613815不同基因型与中晚期HCC患者癌栓
aFisher′s exact test.
CSMD1基因rs1613815基因型与HCC TNM分期的关联分析根据2010年UICC制定的HCC TNM分期标准,处于T1N0M0期的患者有67例,处于T2-4N0M0期的患者有77例,另有2例存在肝门淋巴结转移,为T3N1M0。若同样以AA基因型为参照,结果发现非AA基因型在T2-4N0M0组中的频率显著高于T1N0M0组中的频率(59.8%vs.31.2%,P=0.004)。进一步的比值比(OR)显示,携带非AA基因型的患者其出现病灶分期较晚的风险是携带AA基因型患者的3.276倍,95%CI为1.418~7.569,表明该基因型与TNM分期、尤其是T分期密切相关(表2)。
CSMD1基因rs1613815基因型与肿瘤直径、数目等临床病理资料的关联分析若按年龄(<50岁或≥50岁)、性别(男性或女性)、HbsAg感染(阴性或阳性)、术前甲胎蛋白(alpha-fetoprotein,AFP)水平(<20 ng/mL或≥20 ng/mL)、肝硬化(无或有)、肿瘤数目(单个或多个)、大小(<5 cm或≥5 cm)和分化(I+Ⅱ或Ⅲ+Ⅳ)等可能影响HCC预后的因素进行分组,分别比较不同分组之间AA基因型和非AA基因型之间分布频率差异。结果发现差异并无统计学意义(P>0.05)(表3)。这提示CSMD1基因rs1613815基因型与年龄、性别、HbsAg感染、AFP水平、肝硬化、肿瘤数目、大小和分化等临床病理特征无统计学相关性。

表2 rs1613815不同基因型与HCC患者TNM分期的关联分析

表3 rs1613815不同基因型与其他临床病理资料的关联分析
CSMD1基因rs1613815基因型与HCC预后的关系随访到2015年4月,在纳入研究的146例HCC患者中,17例患者失访,失访率为11.6%。在剩余129例中,AA、AC和CC基因型分别有29例、43例和57例。Kaplan-Meier生存曲线分析显示,携带AA基因型的患者术后中位总生存期(overall survival,OS)为46.4个月,稍低于携带AC/CC基因型的患者(中位OS为47.9个月),差异无统计学意义(P=0.921)(图2A);同样,携带AA基因型患者与携带AC/CC基因型患者之间无复发中位无瘤生存期(recurrence free survival,RFS)亦无统计学意义(中位RFS分别为42.9和36.8个月,P=0.310)(图2B),提示CSMD1基因rs1613815位点多态性与HCC患者生存期无相关性。
多因素COX回归分析显示HBV感染、肿瘤大小和癌栓是影响患者OS的独立预测指标;而AFP水平、肿瘤数目和大小、癌栓是影响患者RFS的独立预测指标(表4)。随后,为明确rs1613815多态性与临床复发的关系,并排除其他相关因素(AFP水平、肿瘤数目和大小)造成的干扰。我们在统一这些因素的情况下做进一步的结合分析(joint analysis)。结果如表5所示,在肿瘤≥5 cm的HCC患者中,AA基因型和AC/CC基因型之间OS或RFS差异显著,并在Kaplan-Meier分析中也得到相似的结果(图3)。
No significant differences was found in OS (A) or RFS (B) between the AA group (n=29) and the AC/CC group (n=100).
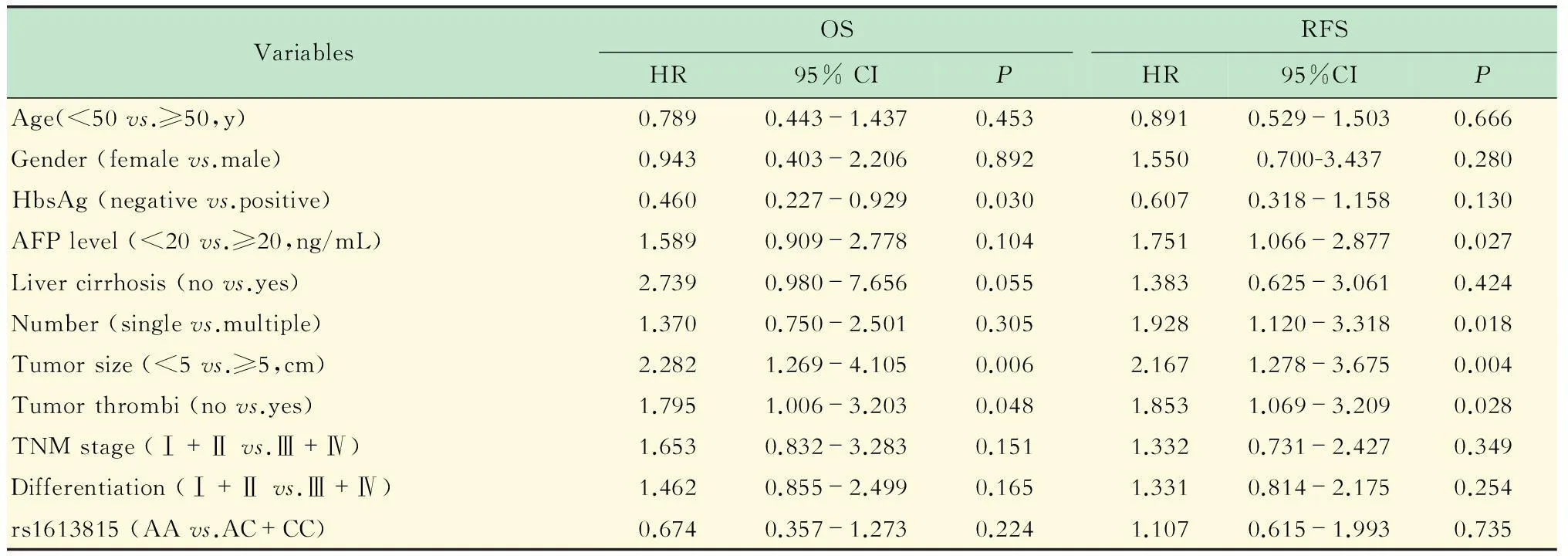
图2 携带AA基因型和携带AC/CC基因型患者Kaplan-Meier生存曲线分析
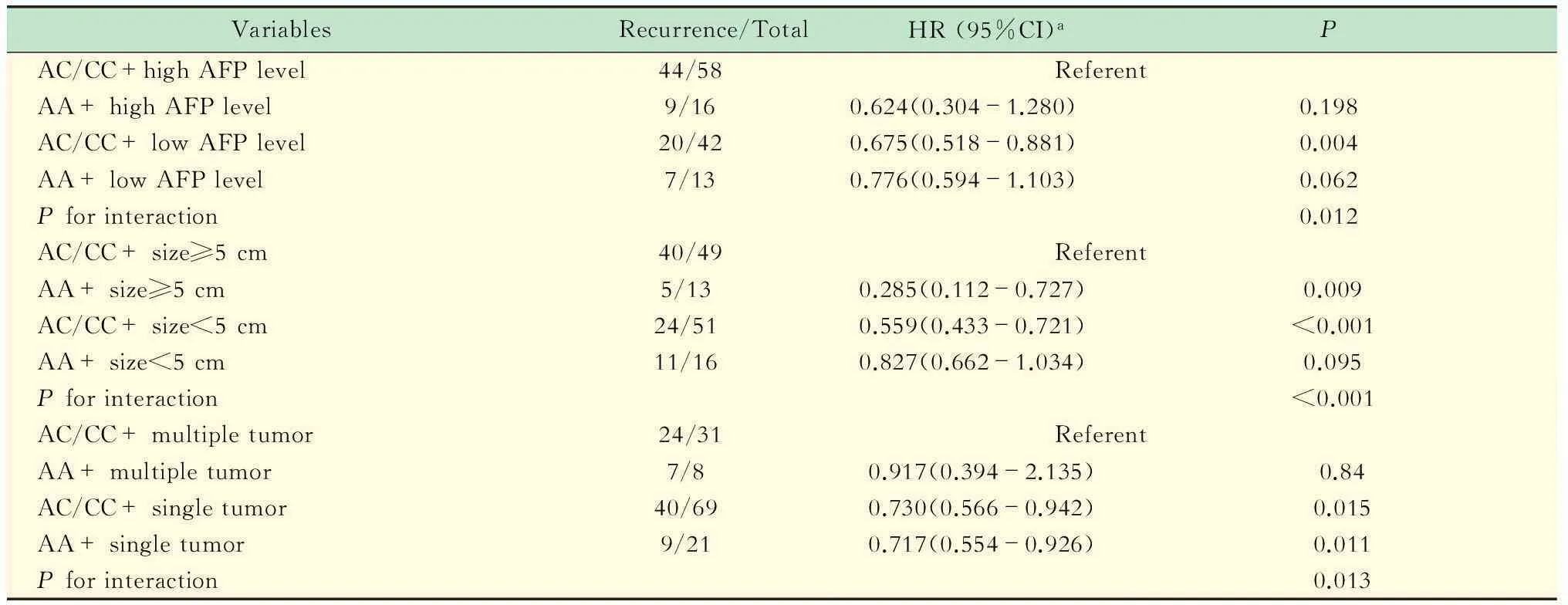
表5 rs1613815基因型与HCC患者AFP水平、肿瘤大小和数目的交互作用分析
HR:Hazard ratio.aAdjusted by age,gender,HBV,AFP level,cirrhosis,tumor number,tumor size,thrombi status,TNM stage or differentiation,where appropriate.
The AA group (n=13) had a significantly higher overall survival rate(A) or recurrence-free survival rate(B) than the AC/CC (n=49) group (thePwas 0.023 and 0.005,respectively).
图3肿瘤直径≥ 5 cm患者携带AA基因型和携带AC/CC基因型的Kaplan-Meier生存曲线分析
Fig 3The Kaplan-Meier analysis of carrying AA and AC/CC genotypes in patients with tumor size ≥ 5 cm
讨论
在HCC发生、发展的过程中,遗传因素起着极其重要的作用。随着基因组学及分子生物学技术的不断深入和改进,人们已从宏观的疾病发生发展过程逐步转变为在微观与分子水平上研究疾病的进展,逐渐把目光转向与肝癌转移复发相关分子的研究。目前研究显示肝癌的遗传因素主要由SNP等所导致,这些多态性广泛存在于抑癌基因、转录因子、生长因子,甚至于细胞代谢通路中。缺氧诱导因子 (hypoxia-inducible factor,HIF-1) 是介导细胞对缺氧微环境产生适应性反应的关键转录调控因子,其活性或表达对维持肿瘤细胞物质代谢、增殖和转移具有重要意义。Guo等[14]在研究HIF1α基因的3个SNP位点时发现,rs2057482 CC基因型的患者较CT+TT基因型的患者复发风险高、预后差。功能学实验表明,携带CC基因型的患者,其HIF1A表达明显高于CT+TT基因型的患者(P=0.014)。这提示CC基因型通过改变HIF1A的表达水平,增强其活性,促进肿瘤细胞增殖和转移,加剧HCC患者的预后。而Yoshiya等[15]则在研究上皮生长因子(epidermal growth factor,EGF)基因5′UTR区单核苷酸多态性(rs4444903)在HCV感染所致的HCC作用时发现,AA组中血清EGF显著低于携带AG+GG组(P=0.02),预后分析则提示AA组患者术后RFS明显高于AG+GG组。三羧酸循环(TCA循环)是细胞三大物质(糖类、脂肪和蛋白质)代谢的最终通路,也是能量代谢的重要途径,而该通路关键位点的编码基因突变将引起TCA循环功能障碍。如Wan等[16]在研究三羧酸循环中3个关键酶(SDH、FH、IDH)基因的SNP时,成功筛选出7个SNPs与HCC的预后(尤其是RFS)密切相关,且进一步推测SDHD基因rs10789859位点是HCC总体复发的起始危险因素,SDHD基因rs3935401位点是HCC总体生存的起始危险因素。总之,这些研究表明SNP在HCC中普遍存在,通过引起目的基因突变或致其表达缺失,降低其活性或作用,最终影响HCC转移和复发。
我们前期研究发现肝癌转移灶中染色体8p缺失率明显高于其相应的原发瘤,提示染色体8p缺失与肝癌转移有关[17-18]。而在临床上发现,外周血DNA 染色体8p上D8S258位点的等位基因失衡(allelic imbalance,AI)与HCC肿瘤分化、TNM分期、血管侵犯、3年无瘤生存率和3年总体生存率密切相关[19]。我们推测8p可能含有一个或多个在肝癌进展尤其是在肿瘤转移中起重要作用的肿瘤抑制基因。随后在对HCC进行全基因组检测时发现,位于8p区域上的新抑癌基因CSMD1基因上共有8个位点存在SNP(rs1613815、rs10092638、rs2049304、rs8180892、rs1523259、rs10107710、rs17515、rs4875793)。通过对比癌栓组和无癌栓组中各个SNP不同基因型之间是否存在差异时发现,仅rs1613815 AA基因型和非AA基因型(包括AC和CC基因型)在癌栓组和无癌栓组之间存在显著差异,显示其具有较高的转移潜能。为验证这一点,我们通过MassARRAY质谱SNP分型技术检测选取的HCC标本中CSMD1基因rs1613815基因型,回顾性分析不同基因型与癌栓的关系。结果显示携带非AA基因型的患者,其癌栓发生几率明显高于携带AA基因型的患者,这与前期预实验结果一致。随后的生存分析并未提示其与肿瘤预后的密切相关性。而进一步的结合分析显示仅在≥5 cm的肿瘤中,非AA基因型患者术后中位RFS和OS(分别为22.5和33.3个月)显著低于AA基因型患者(分别为50.8和53.3个月),差异具有统计学意义(P值分别为0.005和0.023)。这提示,该位点多态性尚不能准确用于预测HCC患者术后情况。而通过多基因多位点的联合检测或许才能够弥补单基因单位点在肿瘤预后预测中的不足。
目前关于CSMD1基因在癌症中的研究已有诸多报道。Ma等[20]等发现CSMD1基因的缺失在头颈部鳞状细胞癌(head and neck squamous cell carcinom,HNSCC)、乳腺癌、肺癌中是一种常见的现象。而早在20世纪90年代,学者们就已经注意到HNSCC中染色体8p23易发生等位基因的缺失和纯合性缺失,且该缺失与HNSCC的发生和预后有着密切的关系[21-22]。Richter等[23]则进一步通过对20个HNSCC细胞系中CSMD1基因的表达水平的检测发现,只有1个细胞系中存在CSMD1基因结构正常的转录子,其余细胞系均发生外显子缺失、转录启动或终止异常,从而导致其功能异常。而Kamal等[24]揭示CSMD1在细胞膜和细胞质中表达,且在乳腺癌中的表达低于正常组织。追溯到Tang 等[25]也发现CSMD1基因在A375细胞的细胞质中有表达,而且与正常的皮肤细胞相比,在黑色素瘤细胞中较低,这可能与选择性剪接CSMD1基因编码分泌蛋白有关。但同时他指出CSMD1基因在正常组织中的表达比肿瘤组织更高,表明CSMD1基因与肿瘤的分级和预后相关。此外,Zhang等[26]通过结直肠癌研究CSMD家族的3个基因CSMD1、CSMD2和CSMD3的表达产物时发现,与配对的正常组织相比,这3个基因的表达产物均明显降低,且低表达的CSMD2和CSMD3蛋白与肿瘤分化、淋巴结转移和肿瘤大小密切相关。而CSMD1和CSMD2则与临床预后相关。这些研究均表明,CSMD1基因在癌症的发生、发展、淋巴结侵袭、肿瘤分化,甚至预后等多个癌症进程中起着非常重要的作用。而有关CSMD1基因多态性的研究则相对少见,且主要集中在非肿瘤疾病中。如Donohoe等[10]通过研究CSMD1 rs10503253多态性对精神分裂症的神经性认知反应时发现,携带A等位基因的患者在语言智商、语言情景记忆能力和空间工作记忆能力方面均较携带其他等位基因的患者表现差。这说明携带A等位基因可能恶化患者的神经性认知反应,进而加重精神分裂症的症状。Koiliari等[27]则进一步指出认知反应的程度与A等位基因呈剂量效应,其中携带AA基因型患者的认知反应程度最差,相反携带CC基因型患者的认知反应最好。
目前并未见CSMD1基因诸如rs1613815等任何位点的多态性与HCC易感性及进展预后等方面的报道,而且有关CSMD1基因突变或表达异常在HCC中的研究亦不多。目前的研究仅指出肿瘤组织CSMD1基因的表达要明显低于正常肝组织。Zhu等[28]通过免疫组化染色发现,HCC组织中CSMD1的阳性率仅为27.3%,远低于癌前病变增生结节(dysplastic nodules,DN)和肿瘤周围肝组织(阳性率分别为75%和82%)。Midorikawa等[29]则利用GIM分析观察到在68例显性HCC中有3例存在8p23.2缺失,他指出8p23.2杂合性丢失只发生于晚期肝细胞肝癌,且CSMD1基因的表达与第一个外显子的甲基化无关,反映出CSMD1基因促进了肝癌的发展。但CSMD1基因如何导致HCC发生发展的确切机制尚不清楚。目前研究主要倾向于通过激活Smad通路发挥其抑癌活性。一方面,CSMD1与Smad3相互作用导致其磷酸化。而磷酸化后的p-Smad3则促进Smad2的磷酸化以及Smad2/3/4复合物的形成。另一方面,CSMD1基因也可直接引起Smad1/5/8复合物磷酸化。随后,磷酸化后的产物p-Smad1/5/8与Smad4相互作用并被激活。最终,通过两条途径将信号转移至细胞核内,进而调节目的基因的转录[25]。
尽管已经充分认识到SNP在基因组结构和肿瘤中的作用,但在肿瘤复发与转移中的作用研究依然很少。目前SNP分析主要用于检验某种疾病和某个特定SNP等位位点在一定群体中的出现频率是否存在相关性,而这种相关可能是风险位点与临近的多态性标记间存在连锁不平衡的结果。由于目前的研究大多局限于一个或几个多态性位点,不可避免地带有盲目性和偶然性。因而这种局限性、盲目性的视角难以窥探肿瘤进展的全部面貌。而且由于肿瘤异质性的存在,局部的肿块研究同样难以反映整体的全部特性,这也就解释了为什么大多数研究结果依然停留在实验阶段,而不能被应用于临床实践中。
综上所述,本研究首次探讨CSMD1基因rs1613815基因型的SNP与HCC临床病理特征的关系,结果表明,该位点AC/CC基因型与HCC的癌栓发生和TNM分期密切相关,提示其具有较高的侵袭转移能力和较差的肿瘤分期,这或许为临床上判断HCC患者癌栓形成及其疾病进展带来一定的价值和意义。然而本研究也同时注意到该位点多态性并不能准确用于HCC预后的评价,仅对肿瘤直径≥5 cm的HCC患者有一定的预测价值。因此我们期望通过后续研究寻找多基因多位点的联合检测模式以用于肝癌转移复发的临床预测,促进肝癌的发生、发展机制研究及个体化治疗。
参考文献
[1]TORRE LA,BRAY F,SIEGEL RL,etal.Global cancer statistics,2012[J].CACancerJClin,2015,65(2):87-108.
[2]WANG XW,HUSSAIN SP,HUO TI,etal.Molecular pathogenesis of human hepatocellular carcinoma[J].Toxicology,2002,181-182:43-47.
[3]ZINS K,FRECH B,TAUBENSCHUSS E,etal.Association of the rs1346044 polymorphism of the Werner Syndrome gene RECQL2 with increased risk and premature onset of breast cancer[J].IntJMolSci,2015,16(12):29643-29653.
[4]ARGALACSOVA S,SLANAR O,VITEK P,etal.Contribution of ABCB1 and CYP2D6 genotypes to the outcome of tamoxifen adjuvant treatment in premenopausal women with breast cancer[J].PhysolRes,2015,64(4):S539-S547.
[5]BONIN S,DONADA M,BUSSOLATI G,etal.A synonymous EGFR polymorphism predicting responsiveness to anti-EGFR therapy in metastatic colorectal cancer patients[J/OL].TumourBiol[2016-01-10]http:∥link.springer.com/article/10.1007%2Fs 13277-015-4543-3.DOI 10.1007/s13277-015-4543-3.
[6]KO E,SEO HW,JUNG ES,etal.The TERT promoter SNP rs2853669 decreases E2F1 transcription factor binding and increases mortality and recurrence risks in liver cancer[J].Oncotarget,2016,7 (1):684-699.
[7]Hodo Y,Honda M,Tanaka A ,etal.Association of interleukin-28B genotype and hepatocellular carcinoma recurrence in patients with chronic hepatitis C[J].ClinCancerRes,2013,19 (7):1827-1837.
[8]DONG QZ,ZHANG XF,ZHAO Y,etal.Osteopontin promoter polymorphisms at locus-443 significantly affect the metastasis and prognosis of human hepatocellular carcinoma[J].Hepatology,2013,57(3):1024-1034.
[9]REN N,WU JC,DONG QZ,etal.Association of specific genotypes in metastatic suppressor HTPAP with tumor metastasis and clinical prognosis in hepatocellular carcinoma[J].CancerRes,2011,71(9):3278-3286.
[10]DONOHOE G,WALTERS J,HARGREAVES A,etal.Neuropsychological effects of the CSMD1 genome-wide associated schizophrenia risk variant rs10503253[J].GenesBrainBehav,2013,12(2):203-209.
[11]LIU X,SHIMADA T,OTOWA T,etal.Genome-wide association study of autism spectrum disorder in the east asian populations[J].AutismRes,2016,9 (3):340-349.
[12]HONG KW,GO MJ,JIN HS,etal.Genetic variations in ATP2B1,CSK,ARSG and CSMD1 loci are related to blood pressure and/or hypertension in two Korean cohorts[J].JHumHypertens,2010,24(6):367-372.
[13]SHULL AY,CLENDENNING ML,GHOSHAL-GUPTA S,etal.Somatic mutations,allele loss,and DNA methylation of the Cub and Sushi Multiple Domains 1 (CSMD1) gene reveals association with early age of diagnosis in colorectal cancer patients[J].PLoSOne,2013,8(3):e58731.
[14]GUO X,LI D,CHEN Y,etal.SNP rs2057482 in HIF1A gene predicts clinical outcome of aggressive hepatocellular carcinoma patients after surgery[J].SciRep,2015,26(5):11846.
[15]YOSHIYA S,FUJIMOTO Y,BEKKI Y,etal.Impact of epidermal growth factor single-nucleotide polymorphism on recurrence of hepatocellular carcinoma after hepatectomy in patients with chronic hepatitis C virus infection[J].CancerSci,2014,105(6):646-650.
[16]WAN S,WU Y,ZHOU X,etal.Polymorphisms in genes of tricarboxylic acid cycle key enzymes are associated with early recurrence of hepatocellular carcinoma[J].PLoSOne,2015,10(4):e0124471.
[17]QIN LX,TANG ZY,SHAM JS,etal.The association of chromosome 8p deletion and tumor metastasis in human hepatocellular carcinoma[J].CancerRes,1999,59 (22):5662-5665.
[18]QIN LX,TANG ZY,YE SL,etal.Chromosome 8p deletion is associated with metastasis of human hepatocellular carcinoma when high and low metastatic models are compared[J].JCancerResClinOncol,2001,127 (8):482-488.
[19]REN N,QIN LX,TU H,etal.The prognostic value of circulating plasma DNA level and its allelic imbalance on chromosome 8p in patients with hepatocellular carcinoma[J].JCancerResClinOncol,2006,132 (6):399-407.
[20]MA C,QUESNELLE KM,SPRARNO A,etal.Characterization CSMDl in a large set of primary lung,head and neck,breast and skin cancer tissues[J].CancerBiolTher,2009,8(10):907-916.
[21]SUMWOO JB,SUN PC,GUPTA VK,etal.Localization of a putative tumor suppressor gene in the sub-telomeric region of chromosome 8p[J].Oncogene,1999,18(16):2651-2655.
[22]SCHOLNICK SB,HAUGHEY BH,SUNWOO JB,etal.Chromosome 8 allelic loss and the outcome of patients with squamous cell carcinoma of the supraglottic larynx[J].JNatlCancerInst,1996,88(22):1676-1682.
[23]RICHTER TM,TONG BD,SCHOLNICK SB.Epigenetic inactivation and aberrant transcription of CSMD1 in squamous cell carcinoma cell lines[J].CancerCellInt,2005,5:29.
[24]KAMAL M,SHAABAN AM,ZHANG L,etal.Loss of CSMDl expression is associated with high tumour grade and poor survival in invasive ductal breast carcinoma[J],BreastCancerResTreat,2010,121(3):555-563.
[25]TANG MR,WANG YX,GUO S,etal.CSMDl exhibits antitumor activity in A375 melanoma cells through activation of the Smad pathway[J].Apoptosis,2012,17(9):927-937.
[26]ZHANG R,SONG C.Loss of CSMD1 or 2 may contribute to the poor prognosis of colorectal cancer patients[J].TumourBiol,2014,35(5):4419-4423.
[27]KOILIARI E,ROUSSOS P,PASPARAKIS E,etal.The CSMD1 genome-wide associated schizophrenia risk variant rs10503253 affects general cognitive ability and executive function in healthy males[J].SchizophrRes,2014,154(1-3):42-47.
[28]ZHU Q,GONG L,LIU XY,etal.Loss of heterozygosity at D8S262:an early genetic event of hepatocarcinogenesis[J].DiagnPathol,2015,10:70.
[29]MIDORIKAWA Y,YAMAMOTO S,TSUJI S,etal.Allelic imbalances and homozygous deletion on 8p23.2 for stepwise progression of hepatocarcinogenesis[J].Hepatology,2009,49(2):513-522.
Association of rs1613815 genotypes in CSMD1 gene with clinicopathological parameters of hepatocellular carcinoma
CHEN Wan-yong▲, ZHANG Wen-tao▲, ZHOU Chen-hao, SHEN Ying-hao, LIU Bin-bin, REN Ning△
(DepartmentofLiverSurgery,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
【Abstract】ObjectiveTo investigate the relationship between rs1613815 genotypes in CSMD1 gene with clinicopathological parameters of hepatocellular carcinoma (HCC) patients.MethodsFrom Jan.to Jul. in 2009,146 pathologically confirmed HCC patients were enrolled from Department of Liver Surgery,Zhongshan Hospital,Fudan University.We collected the clinical and pathological data.The polymorphism of CSMD1 gene (rs1613815) was detected by USA Sequenom MassARRAY.According to the results of our previous pre-experiment,the relationship between different genotypes of rs1613815 and clinicopathological parameters of those HCC patients was analyzed retrospectively.Kaplan-Meier method and Cox regression model were used to estimate clinical outcomes.ResultsIn the 146 cases of HCC,we found 33 cases carrying AA genotype,49 carrying AC genotype and 64 carrying CC genotype in rs1613815.In mid-advanced HCC patients,the incidence rate of tumor thrombi (including macroscopic and microscopic thrombi) in those patients carrying AC/CC genotype was apparently higher than those carrying AA genotype (70.6%vs.36.4%),and the difference was statistically significant (P=0.039).Meanwhile,the ratio of carring AC/CC genotype patients in T2-4N0M0 was also significantly higher than those carrying AA genotype (59.8%vs.31.2%,P=0.004).No significant difference was found between AC/CC and AA genotype in age,gender,HbsAg,tumor size and number,serum alpha-fetoprotein(AFP) level and other clinicopathological parameters (P>0.05).In patients with tumor size ≥5 cm,the AA group had a significantly higher overall survival rate or recurrence-free survival rate than the AC/CC group (the P value was 0.023 and 0.005,respectively).ConclusionsCSMD1 rs1613815 polymorphisms were positively correlated with tumor thrombi status and advanced TNM-stage of HCC,which indicated that it had a high potential of metastasis and poor prognosis.
【Key words】hepatocellular carcinoma;CSMD1 gene;single nucleotide polymorphism;metastasis
【中图分类号】R735.7
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.03.001
(收稿日期:2016-01-13;编辑:张秀峰)
国家自然科学基金(81472672);上海市科技启明星跟踪计划(13QH1401000)
▲Co-first authors
△Corresponding authorE-mail:renning@fudan.edu.cn
*This work was supported by the National Natural Science Foundation of China (81472672) and Shanghai Municipal Science and Technology Star Tracking Program (13QH1401000) .

