crtE、crtY、crtI、crtB基因共调控提高β-胡萝卜素产量
叶 立 军, 毕 昌 昊, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国科学院 天津工业生物技术研究所, 天津 300308 )
crtE、crtY、crtI、crtB基因共调控提高β-胡萝卜素产量
叶 立 军1,2,毕 昌 昊2,张 春 枝1
( 1.大连工业大学 生物工程学院, 辽宁 大连116034;2.中国科学院 天津工业生物技术研究所, 天津300308 )
摘要:代谢合成途径优化的关键在于途径中多个基因表达的调控,本研究使用不同强度启动子对代谢通路中多个相关基因同时调控以提高大肠杆菌β-胡萝卜素产量。将来源于P. agglomerans的4个基因crtE、crtY、crtI、crtB,通过Golden Gate DNA方法与不同强度启动子组合得到质粒库,并转化到底盘细胞中进行颜色筛选。筛选得到crtE、crtY、crtI、crtB启动子组合各不相同的菌株,β-胡萝卜素产量在0.64~8.82 mg/g,最高产量比对照提高了65.2%。本研究验证了通过Golden Gate组装建库对代谢通路多个基因同时调控以提高目的产物产量的可行性。
关键词:代谢通量优化;Golden Gate DNA 组装;β-胡萝卜素
网络出版地址: http://www.cnki.net/kcms/detail/21.1560.TS.20160429.1428.004.html.
0引言
生物系统中蛋白表达水平的不当可能会导致营养浪费并限制细胞生长[1],或是出现中间产物的大量积累,对细胞产生毒害作用[2]。初次将一个异源表达代谢通路引入微生物时,都会出现这类问题,所以需要调整各类相关蛋白质的表达水平[3]。
目前对多个蛋白的表达进行调节的方式有两种。一种是多轮调节,每次只调节一个基因,并确定该基因的最优表达水平,在此基础上进行下一轮调节[4]。这种方式虽然可以分别对每一个基因进行精细的调节,但其最大的不足是分别得到的各个基因的最优表达水平组合在一起不一定是真正的最优组合。第二种方式就是将需要调节的多个基因与不同强度的启动子或者核糖体结合位点(RBS)组合,构建出所有的质粒,分别导入目的菌株进行性状筛选[5]。这种调节方式虽然能够同时对多个基因调节,但分别构建出每个质粒工作量较大,即使是以生物模块的方法一步步组装,构建过程依然较慢[6]。
前人研究了代谢工程中几种调节细胞中蛋白质表达水平的方式:使用不同强度启动子[7]、核糖体结合位点(RBS)[8]、调节转录物的稳定性[9]和改变蛋白的降解速率[10]。本研究结合实际情况,考虑使用不同强度的启动子作为调节蛋白表达水平的方式,并采用适合多片段一次性组装的Golden Gate DNA组装方法构建多基因[11-12],分别搭配不同强度启动子的质粒文库,并通过转化、筛选实现同时对多个基因进行表达水平的优化。
课题组之前通过在E.coli中异源表达crtE、crtY、crtI、crtB基因生产β-胡萝卜素[13],本实验将对crtE、crtY、crtI、crtB进行共调控,以提高β-胡萝卜素产量,同时验证该调控方法的可行性。
1实验
1.1材料与仪器
1.1.1主要试剂
DNA回收试剂盒,PrimeSTAR HS DNA聚合酶,DNA Marker trans2K plus及trans2K plusⅡ,限制性内切酶BsmBⅠ,T4 DNA 连接酶。
1.1.2仪器与设备
PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,AlphaImager HP;电转仪,MicroPulser;紫外可见分光光度计,Shimadzu UV-2550。
1.1.3菌株
本实验选择实验室之前构建的CAR001菌株作为出发菌株构建底盘细胞。所用菌株在表1中列出。


表1 所用菌株
1.2方法
1.2.1培养基及培养方法
该公司为德国NAGEL集团在中国设立的全资子公司,全权负责NAGEL集团旗下三大进口品牌在中国地区的所有业务,即:TBT深孔钻设备、刀具等;NAGEL珩磨设备、珩磨刀具等;KADIA精密小孔珩磨设备、去毛刺设备和珩磨刀具等。同时,还负责国产机床—山西NAGEL(深孔加工设备、枪钻刃磨机等)的销售业务。
使用LB培养基,氯霉素终浓度分别为30 μg/mL。
好氧培养:将转化得到的单菌落转接到4 mL LB试管中(15 mm×100 mm)中,37 ℃、220 r/min 过夜培养,1%的接种量转接到相应好氧培养基中,30 ℃、250 r/min 培养24 h。
1.2.2β-胡萝卜素产量的检测
通过测定丙酮萃取的β-胡萝卜素在453 nm下的吸光度计算β-胡萝卜素产量[14]。
1.2.3底盘细胞的构建
使用Cas9基因编辑技术将CAR001中的crtEYIB基因敲除得到CAR001-Δcrt。通过CPEC的方法构建Cas9相关质粒得到整合质粒[15],将质粒导入到CAR001中进行编辑。
1.2.4表达外源β-胡萝卜素基因的质粒库构建

图1 参与Golden Gate反应的启动子原件设计
2结果与讨论
2.1底盘细胞的构建
使用Cas9编辑技术将crtE、crtY、crtI、crtB4个基因敲除。敲除后使用表3中的验证引物200-UP-L-F、200-DOWN-R-R进行验证,其大小应为1.3 kb,结果如图2所示。

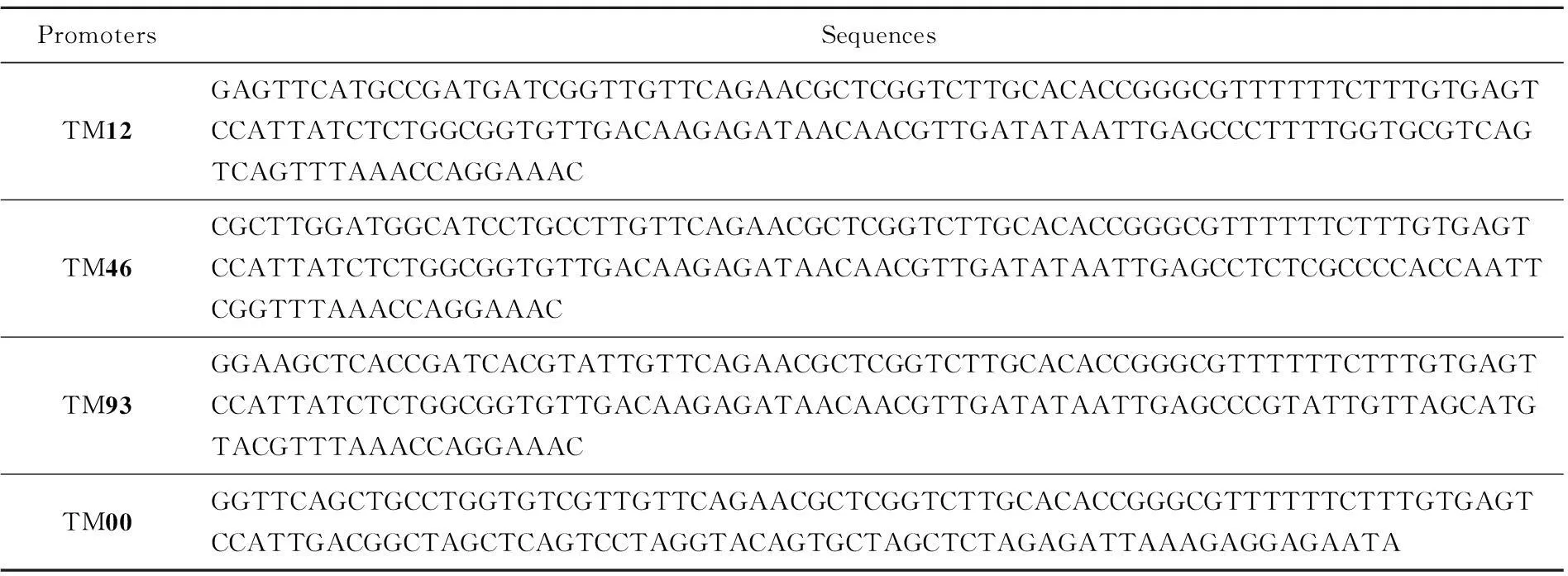
表2 终止子-启动子复合元件

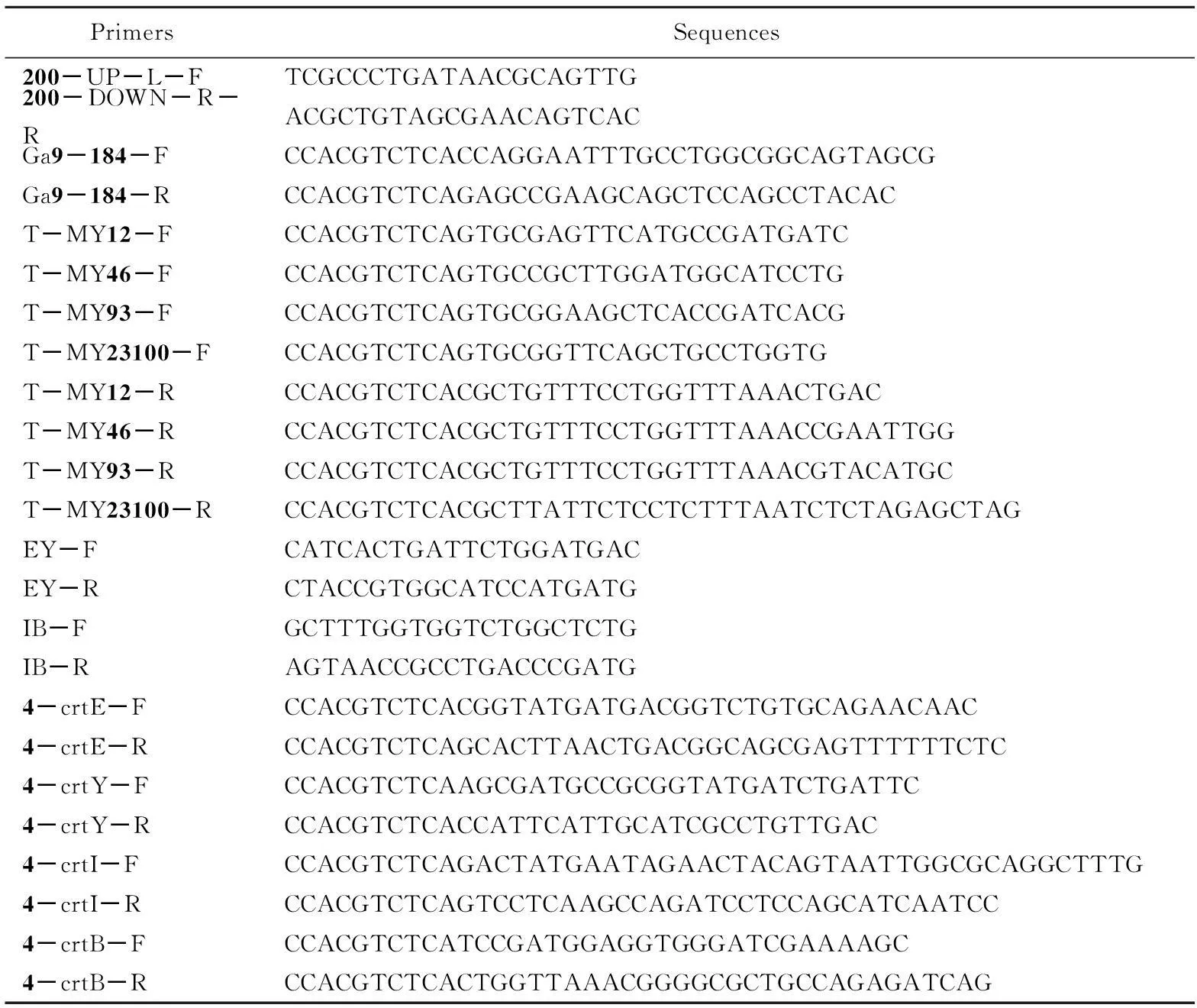
表3 引物列表
2.2表达载体的构建
选择低拷贝质粒pACYC-184为模板,将Golden Gate酶切识别位点包埋在表3中引物Ga9-184-F,Ga9-184-R,PCR得到骨架片段。骨架PCR产物条带大小2.6 kb,电泳如图3所示。
2.3外源β-萝卜素基因表达质粒的构建
本实验要在一套强度不同的启动子元件TM12、TM46、TM93、TM00(表2)前后分别包埋4种互不相同的Golden Gate酶切连接所用的黏性末端,构成4套强度不同的启动子。这4套启动子前后的酶切黏性末端分别与4个功能基因crtE、crtY、crtI、crtB提前包埋的前后黏性末端互补配对。将提前构建好的质粒载体片段与4个功能基因以及4套启动子元件,共21个片段一起放入Golden Gate DNA组装体系进行酶切连接反应,得到一个质粒文库(理论上有256种组合),如图4所示。

图2 CAR001中crtEYIB基因的敲除
将GoldenGate反应液转化到CAR001-Δcrt中,涂布于含有氯霉素的LB固体培养基。挑取部分转化子并使用鉴定引物EY-FEY-R,IB-FIB-R分别鉴定基因crtEcrtY和crtIcrtB。PCR鉴定结果如图5所示,大小分别为1.3和2.5kb。
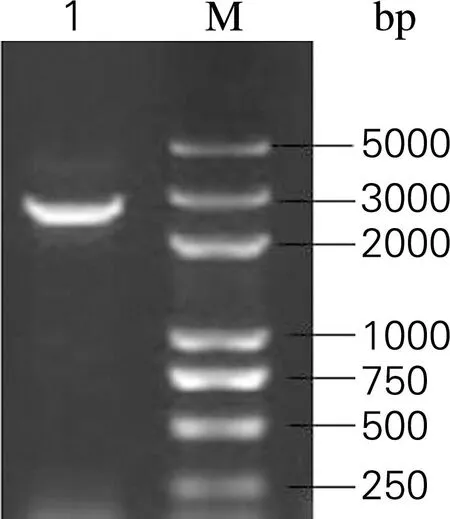
图3含有GoldenGate酶切识别位点的pACYC-184 骨架
Fig.3The backbone of pACYC-184 embedded with Golden Gate restriction enzyme recognition site
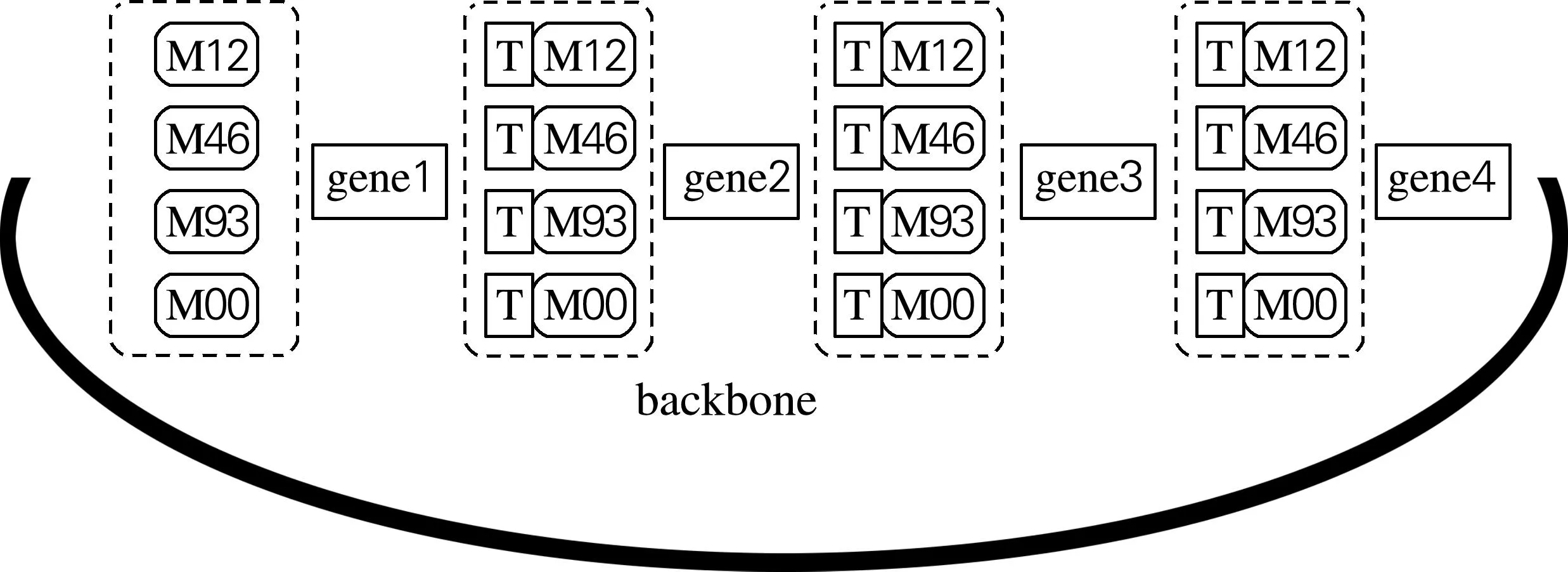
图4 基于启动子的多基因同时调控质粒文库构建示意图

1~4,基因crtEcrtY;5~8,基因crtIcrtB
2.4特征菌落测序及产量测定
根据颜色由浅到深挑选了有代表性的菌落,通过分光光度法测定OD453及OD600,并通过标准曲线和大肠杆菌细胞量经验公式计算β-胡萝卜素绝对产量和单位体积菌体量,并得到β-胡萝卜素的相对产量。如图6所示,列出了有代表性菌株的β-胡萝卜素产量,其中产量最高的TM2菌株比对照组产量提高了65.2%。对菌株测序,通过序列比对得到crtE、crtY、crtI、crtB前边的启动子组合情况,如表4所示。从表4可以看出,每个基因前边的启动子都是变动的,与预期目标一致。产量测定结果及测序结果证明,使用GoldenGate方法分别将不同强度的启动子与多个基因搭配构建文库,实现了对多个基因同时调控。该方法从设计引物构建质粒到转化底盘细胞得到转化子,最快只需3d。与传统分别构建质粒得到质粒调节库的方式相比,大大节省了时间和资源。
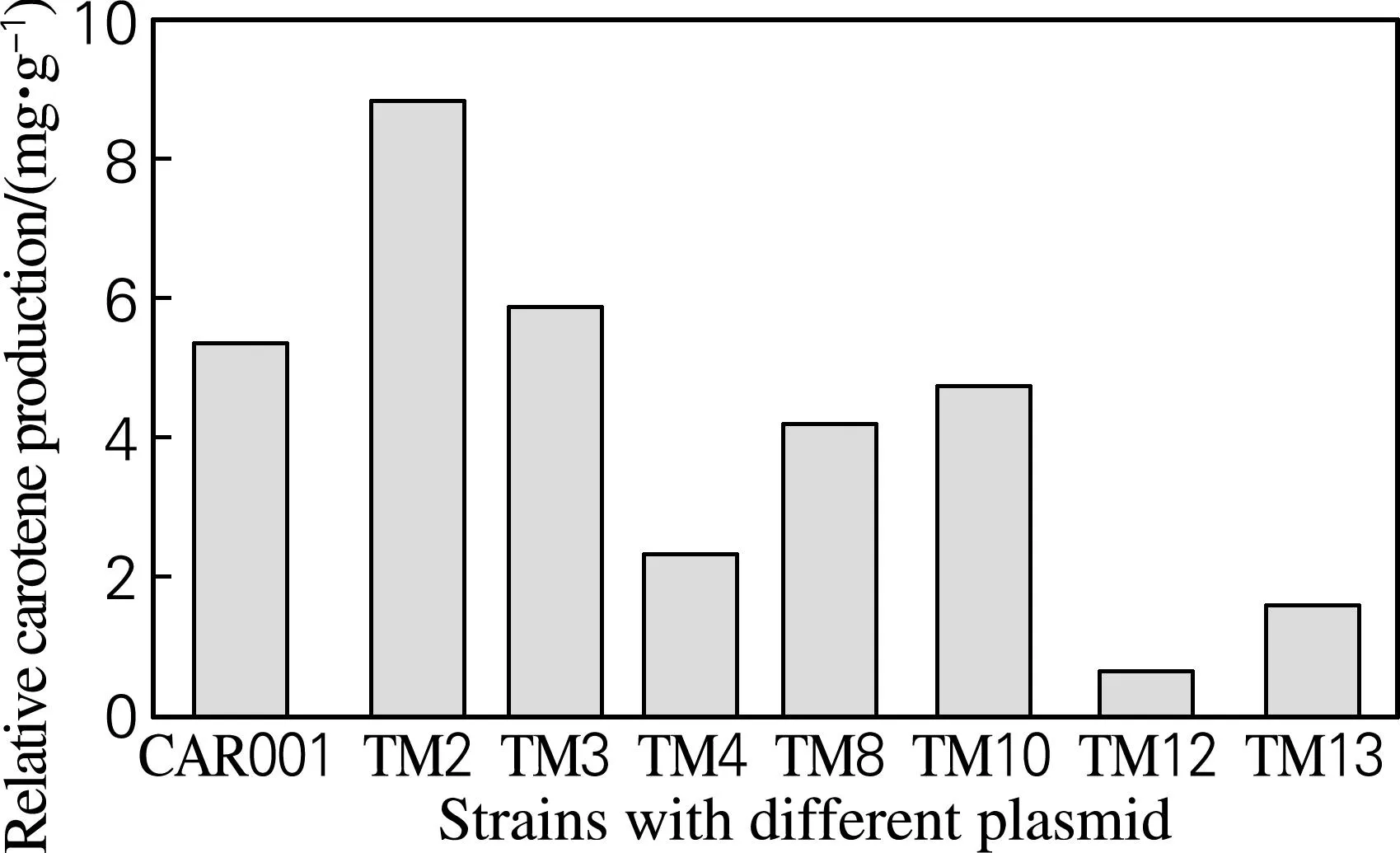
图6 不同菌株β-胡萝卜素的相对产量


表4 各个菌株启动子的组成
3结论
本实验验证了通过GoldenGateDNA装配方法,使用不同强度启动子分别与多个基因搭配构建质粒文库,从而同时调节多个基因表达的可行性。与同时调节多个基因时采用的分别构建各个质粒的方式相比,本实验的方法在节省时间和资源耗费方面都有较大的优势。但实验中使用的启动子数目较少,后续实验中,可以适当增加启动子的数目,或是改变启动子的强度范围进行更精细的调节。
参考文献:
[1]SCOTTM,GUNDERSONCW,MATEESCUEM,etal.Interdependenceofcellgrowthandgeneexpression:originsandconsequences[J].Science, 2010, 330: 1099-1102.
[2]PITERADJ,PADDONCJ,NEWMANJD,etal.BalancingaheterologousmevalonatepathwayforimprovedisoprenoidproductioninEscherichiacoli[J].Metabolicengineering, 2007, 9(2): 193-207.
[3]YINL,SHIF,HUX,etal.IncreasingL-isoleucineproductioninCorynebacterium glutamicumbyoverexpressingglobalregulatorLrpandtwo-componentexportsystemBrnFE[J].JournalofAppliedMicrobiology, 2013, 114(5): 1369-1377.
[4]LUJ,TANGJ,LIUY,etal.CombinatorialmodulationofgalPandglkgeneexpressionforimprovedalternativeglucoseutilization[J].AppliedMicrobiologyandBiotechnology, 2012, 93(6): 2455-2462.
[5]ZELCBUCHL,ANTONOVSKYN,BAR-EVENA,etal.Spanninghigh-dimensionalexpressionspaceusingribosome-bindingsitecombinatorics[J].Nucleicacidsresearch, 2013, 41(9):e98.
[6]ANDERSONJC,DUEBERJE,LEGUIAM,etal.BglBricks:aflexiblestandardforbiologicalpartassembly[J].JournalofBiologicalEngineering, 2010, 4(1): 1-12.
[7]HAMMERK,MIJAKOVICI,JENSENPR.Syntheticpromoterlibraries—tuningofgeneexpression[J].TrendsinBiotechnology, 2006, 24(2): 53-55.
[8]SALISHM,MIRSKYEA,VOIGTCA.Automateddesignofsyntheticribosomebindingsitestocontrolproteinexpression[J].NatureBiotechnology, 2009, 27(10): 946-950.
[9]BABISKINAH,SMOLKECD.AsyntheticlibraryofRNAcontrolmodulesforpredictabletuningofgeneexpressioninyeast[J].MolecularSystemsBiology, 2011, 7(1): 1-15.
[10]MCGINNESSKE,BAKERTA,SAUERRT.Engineeringcontrollableproteindegradation[J].MolecularCell, 2006, 22(5): 701-707.
[11]ENGLERC,GRUETZNERR,KANDZIAR,etal.GoldenGateshuffling:aone-potDNAshufflingmethodbasedontypeIIsrestrictionenzymes[J].PLoSONE, 2009, 4(5):e5553.
[12]ENGLERC,MARILLONNETS.Generationoffamiliesofconstructvariantsusinggoldengateshuffling[J].MethodsinMolecularBiology, 2011, 729: 167-181.
[13]ZHAOJ,LIQ,SUNT,etal.EngineeringcentralmetabolicmodulesofEscherichia coliforimprovingbeta-caroteneproduction[J].MetabolicEngineering, 2013, 17: 42-50.
[14]YUANLZ,ROUVIEREPE,LAROSSARA,etal.ChromosomalpromoterreplacementoftheisoprenoidpathwayforenhancingcarotenoidproductioninE. coli[J].MetabolicEngineering, 2006, 8(1): 79-90.
[15]QUANJ,TIANJ.Circularpolymeraseextensioncloningofcomplexgenelibrariesandpathways[J].PLoSONE, 2009, 4(7):e6441.
[16]KAJIWARAS,FRASERPD,KONDOK,etal.ExpressionofanexogenousisopentenyldiphosphateisomerasegeneenhancesisoprenoidbiosynthesisinEscherichia coli[J].BiochemicalJournal, 1997, 324(Pt2): 421-426.
[17]LUJ,TANGJ,LIUY,etal.CombinatorialmodulationofgalPandglkgeneexpressionforimprovedalternativeglucoseutilization[J].AppliedMicrobiologyandBiotechnology, 2011, 93(6): 2455-2462.
Co-regulation ofcrtE,crtY,crtI,crtBgene expression to improve β-carotene yield
YELijun1,2,BIChanghao2,ZHANGChunzhi1
( 1.School of Biological and Engineering, Dalian Polytechnic University, Dalian 116034, China;2.Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China )
Abstract:The key of metabolic or biosynthetic pathway optimization depended on expression regulation of genes in the pathway. Expression of β-carotene synthetic pathway genes were simultaneously modulated by promoters of various strength to optimized the efficiency of the pathway. Genes of crtE, crtY, crtI, crtB from P. agglomerans were modulated by promoter library and enabled by Golden Gate DNA assembly method to construct plasmid library, then transferred to E. coli chassis. Representative strains were obtained from the library and proved to have different expression pattern of crtE, crtY, crtI and crtB, and different β-carotene yield in the range of 0.64-8.82 mg/g. The highest yield was increased by 65.2% compared to the control strain. It is proved that simultaneous regulation of multiple genes in the metabolic pathway by constructing library with Golden Gate DNA assembling method to improve target production.
Key words:metabolic flux optimization; Golden Gate DNA assembling; β-carotene
收稿日期:2016-02-28.
基金项目:国家高技术研究发展计划项目(2015AA020202);天津市科技支撑计划重点项目(Y5M2121111).
作者简介:叶立军(1991-),男,硕士研究生;通信作者:张春枝(1963-),女,教授.
中图分类号:TS202.3;Q789
文献标志码:A
文章编号:1674-1404(2016)03-0167-04
网络出版时间: 2016-04-29T14:28:31.

