维生素C调控肉鸡缺氧肺动脉血管平滑肌细胞缺氧诱导因子-1αmRNA转录的分子机制
曹 林,曾秋凤,张克英,丁雪梅,白世平,罗玉衡,王建萍,玄 玥,宿卓薇
维生素C调控肉鸡缺氧肺动脉血管平滑肌细胞缺氧诱导因子-1αmRNA转录的分子机制
曹 林,曾秋凤*,张克英,丁雪梅,白世平,罗玉衡,王建萍,玄 玥,宿卓薇
(四川农业大学动物营养研究所,教育部动物抗病营养重点实验室,雅安625014)
摘 要:作者旨在通过脯氨酸羟化酶抑制剂(DMOG)和过氧化氢(H2O2)刺激肉鸡缺氧肺动脉平滑肌细胞(PASMCs)探讨维生素C(VC)对其氧化还原状态与缺氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)及其受体2(VEGFR2/Flk-1)mRNA转录调控的分子机制。在前期PASMCs培养和缺氧模型的基础上设计3个小试验,VC和H2O2、VC和DMOG、VC和H2O2+DMOG,每个试验5个处理,每个处理6个重复。结果表明:与常氧和缺氧空白组相比,试验1,VC显著增加SOD/MDA的比值(P<0.05),显著下调HIF-1α/VEGF/VEGFR2mRNA的转录水平(P<0.05),H2O2显著上调缺氧肉鸡PASMCs HIF-1αmRNA转录(P<0.05);试验2,DMOG显著上调SOD/MDA的比值(P<0.05),显著下调HIF-1α和VEGFR2mRNA转录(P<0.05),但显著上调VEGF mRNA的转录(P<0.05),VC+DMOG显著上调HIF-1α/VEGF/VEGFR2mRNA转录(P<0.05);试验3,VC+H2O2+DMOG三者同时添加极显著增加HIF-1α/VEGF/VEGFR2mRNA转录(P<0.01)。以上结果提示,VC能提升细胞外基质的抗氧化水平,其对缺氧基因表达的调控与细胞内脯氨酸羟化酶活性和氧化还原状态相关。
关键词:肉鸡肺动脉平滑肌细胞;缺氧;HIF-1α;维生素C;H2O2;DMOG
肉鸡腹水综合征(ascites syndrome,AS)又称肉鸡肺动脉高压综合征(pulmonary hypertension syndrome,PHS),是快大型肉鸡三大主要营养代谢性疾病之一。缺氧会引起肉鸡肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)异常增生,导致肉鸡肺动脉血管重构、肺动脉压升高、右心室肥大、自由基损伤等病理变化[1],引发肉鸡AS。众多研究证实,缺氧诱导因子-1α(hypoxia inducible factor-1alpha,HIF-1α)基因表达与肉鸡AS的发生发展密切相关[2-3]。
HIF-1α的表达与活性受细胞内氧化还原状态和脯氨酸羟化酶活性的影响[4]。常氧条件下,H2O2可通过失活脯氨酸羟化酶来稳定HIF-1α蛋白活性[5]。在人前列腺癌细胞中胰岛素通过诱导H2O2的产生上调HIF-1α和血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达[6]。在人血管内皮细胞线粒体SOD也可调节HIF-1α的活性[7]。脯氨酸羟化酶是HIF-1α蛋白通过泛素化途径降解的关键酶。DMOG(dimethyloxalylglycine),一种脯氨酸羟化酶的抑制剂,可上调HIF-1α蛋白的表达[8]。维生素C(VC)作为一种强抗氧化剂和脯氨酸羟化酶的辅助因子,对人或鼠类肿瘤细胞HIF-1α基因表达及其蛋白活性有着较强的调控作用。本实验室前期试验也表明,适宜浓度的VC(500或1 000μmol·L-1)能有效下调缺氧肉鸡PASMCs中HIF-1α及其下游靶基因VEGF及血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2/Flk-1)mRNA的转录[9]。
本试验旨在进一步研究VC、DMOG和H2O2对缺氧肉鸡PASMCs氧化水平和缺氧基因HIF-1α/VEGF/VEGFR2mRNA转录的影响,揭示VC降低HIF-1α/VEGF/VEGFR2基因转录的分子机制,为VC在肉鸡健康养殖中的合理应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 主要试验仪器与试剂 仪器:生物安全柜(Thermo1300Series)、倒置显微镜(Nikon TS100)、二氧化碳培养箱(Thermo3111)、照相系统(Nikon DS-Ri1)、多功能酶标仪(SpectraMax M2)、ABI 7900型荧光定量PCR仪。试剂:DMEM-F12培养基(HyClone)、南美洲胎牛血清(Sigma)、胰蛋白酶(HyClone)、青链霉素(HyClone)、D-hanks液(武汉博士德)、CoCl2·6H2O(Sigma)。
1.1.2 肉鸡肺动脉平滑肌细胞培养及缺氧模型的建立 30只21日龄健康AA肉公鸡,在实验室前期研究基础上培养肉鸡PASMCs,且CoCl2250 μmol·L-1处理48h时PASMCs细胞增殖明显,缺氧基因HIF-1α/VEGF/VEGFR2的相对转录量较空白组也显著升高。故以CoCl2250μmol·L-1,48 h为条件建立细胞缺氧模型。
1.2 试验设计
本试验包括3个小试验。处理时间均为48h。
试验1 VC和H2O2对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响。采用2×2+1因子设计。缺氧条件下,2个VC添加水平(0和500μmol·L-1),2个H2O2添加水平(0或50 μmol·L-1)[10]和常氧空白对照处理,共5个处理,每个处理6个重复。
试验2 VC和DMOG对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响。采用2×2+1因子设计。缺氧条件下,2个VC添加水平(0和500μmol·L-1),2个DMOG添加水平(0或1 mmol·L-1)[5]和常氧空白对照处理,共5个处理,每个处理6个重复。
试验3 VC/H2O2/DMOG对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响。采用2×2+1因子设计。缺氧条件下,2个VC添加水平(0和500μmol·L-1),2个H2O2+DMOG添加水平(0或50μmol·L-1H2O2+1mmol·L-1DMOG)和常氧空白对照处理,共5个处理,每个处理6个重复。
1.3 样品收集与检测
1.3.1 样品收集 按照Trizol试剂说明书提取细胞总RNA,-80℃保存,用于缺氧基因相对转录量检测。收集细胞培养液和细胞裂解液,分别测定VC、SOD和丙二醛(MDA)的含量。
1.3.2 细胞培养液与裂解液氧化和抗氧化指标的检测 细胞培养液与裂解液中VC、SOD和MDA的检测按照试剂盒说明书进行。抗坏血酸(VC)试剂盒(南京建成,货号:A009 50T/48样)、SOD试剂盒(南京建成,货号:A001-1羟胺法)、MDA试剂盒(南京建成,货号:A003-1TBA法)。
1.3.3 RT-PCR检测 利用SYBR Premix Ex TaqTMII试剂盒和ABI Prism7900sequence detection system进行RT-PCR检测。反应采用10μL体系,冰上操作,反应体系包括:5μL SYBR Premix Ex TaqTMII,0.4μL Forward Primer,0.4μL Reverse Primer,0.2μL ROX Reference,3μL dH2O 和1μL cDNA。反应条件:95℃预变性30s,40个循环(95℃5s,60℃34s),熔解曲线检测(95℃15s,60℃60s,95℃15s)。引物序列见表1。

表1 引物序列Table 1 The sequence of primers
1.4 统计分析
缺氧基因的相对转录量采用2-ΔΔCt法[11]计算:△Ct(目的基因)=Ct(目的基因)-Ct(内参基因);△△Ct=Ct(试验组)-Ct(对照组)。目的基因的相对转录量=2-ΔΔCt。用SAS(9.0)进行单因素方差分析,差异显著时用Ducan法进行多重比较。以P<0.05为差异显著,P<0.01为差异极显著。用GraphPad Prism 5作图,但试验3缺氧基因的相对转录量经对数转换后再用GraphPad Prism 5作图。
2 结 果
2.1 VC和H2O2对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响
2.1.1 VC和H2O2对肉鸡缺氧PASMCs氧化还原状态的影响 从图1可看出,肉鸡PASMCs培养液和裂解液中VC含量常氧空白组最低,且与缺氧空白组相比差异达到显著水平(P<0.05)。缺氧条件下,H2O2组培养液中VC含量显著降低(P<0.05),裂解液中VC含量与缺氧空白组和VC+H2O2组相比也显著降低(P<0.05);VC组培养液中VC含量显著高于其他处理组(P<0.05);VC+H2O2组培养液中VC浓度显著低于VC组(P<0.05),但显著高于其他处理组(P<0.05),裂解液中VC含量与缺氧空白组相比有升高趋势,但显著高于其他处理组(P<0.05)。
肉鸡PASMCs培养液和裂解液中SOD活性常氧空白组最高,且培养液中SOD活性与H2O2组相比差异显著(P<0.05),裂解液中SOD活性显著高于除H2O2组外的缺氧组(P<0.05)。缺氧条件下,H2O2组培养液中SOD活性与其他缺氧组相比仅有降低趋势,但裂解液中SOD活性上升,显著高于其他缺氧组(P<0.05);VC组和VC+H2O2组裂解液中SOD活性显著低于常氧组和H2O2组(P<0.05)。
肉鸡PASMCs培养液中MDA含量常氧空白组显著高于缺氧条件下的各处理(P<0.05);缺氧条件下,VC+H2O2组MDA含量显著高于VC组(P<0.05),其他缺氧组间差异不显著。此外,肉鸡PASMCs培养液中VC组SOD/MDA的比值显著高于其他试验组(P<0.05)。

图1 VC和H2O2对肉鸡缺氧PASMCs培养液和裂解液氧化还原状态的影响Fig.1 Effects of VC and H2O2on the redox state of culture medium and lysis solution of broiler PASMCs under hypoxia condition
2.1.2 VC和H2O2对肉鸡缺氧PASMCs缺氧基因转录的影响 从图2可看出,肉鸡PASMCs缺氧基因HIF-1α/VEGF/VEGFR2mRNA的相对转录量在常氧空白组显著低于缺氧试验组(P<0.05)。缺氧条件下,HIF-1α和VEGF mRNA的相对转录量呈现出一致的变化趋势;H2O2组缺氧基因的相对转录量最大,显著高于其他处理组(P<0.05);VEGFR2mRNA的相对转录量在缺氧空白组最大,显著高于VC组和H2O2+VC组(P<0.05)。
2.2 VC和DMOG对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响
2.2.1 VC和DMOG对肉鸡缺氧PASMCs氧化还原状态的影响 从图3可看出,肉鸡PASMCs培养液和裂解液中VC含量常氧空白组最低,且与缺氧组相比达到显著水平(P<0.05)。缺氧条件下,培养液中VC含量,DMOG组显著低于其他试验组(P<0.05),VC组显著高于其他处理组(P<0.05),VC+H2O2组显著高于缺氧空白组(P<0.05)。

图2 VC和H2O2对肉鸡缺氧PASMCs缺氧基因mRNA转录的影响Fig.2 Effects of VC and H2O2on the mRNA expression of hypoxia genes of broiler PASMCs under hypoxia condition
肉鸡PASMCs培养液和裂解液中SOD活性常氧空白组最高,其培养液中SOD活性与DMOG组相比达到显著水平(P<0.05),其裂解液中SOD活性与缺氧试验组相比均达到显著水平(P<0.05)。
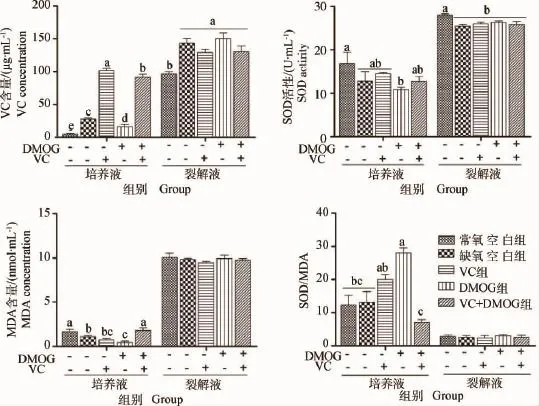
图3 VC和DMOG对肉鸡缺氧PASMCs培养液和裂解液氧化还原状态的影响Fig.3 Effect s of VC and DMOG on the redox state of culture medium and lysis solution of broiler PASMCs under hypoxia condition
肉鸡PASMCs培养液中MDA含量常氧空白组和VC+DMOG组无差异,但显著高于其他试验组(P <0.05)。缺氧条件下,DMOG组MDA含量最低,与缺氧空白组相比达到显著水平(P<0.05)。肉鸡PASMCs培养液中SOD/MDA的比值DMOG组最大,显著高于除VC组外的所有试验组(P<0.05);VC组SOD/MDA的比值与常氧空白组和缺氧空白组相比有升高趋势,与DMOG+VC组相比达到显著水平(P<0.05)。2.2.2 VC和DMOG对肉鸡缺氧PASMCs基因转录的影响 从图4可看出,肉鸡PASMCs缺氧基因HIF-1α/VEGF/VEGFR2mRNA在常氧条件下的相对转录量同试验1一致,显著低于缺氧试验组(P<0.05)。缺氧条件下,DMOG+VC组缺氧基因的相对转录量都最大,显著高于其他试验组(P<0.05);DMOG组HIF-1αmRNA的相对转录量显著低于其他缺氧组(P<0.05),VEGF mRNA的相对转录量显著高于除DMOG+VC组外的试验组(P<0.05),VEGFR2mRNA的相对转录量也达到最小值,显著低于除VC组外的缺氧组(P<0.05);VC组与缺氧空白组相比,VEGFR2mRNA的相对转录量显著降低(P<0.05)。
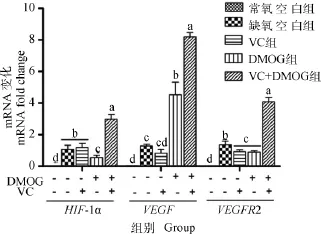
图4 VC和DMOG对肉鸡缺氧PASMCs基因转录的影响Fig.4 Effect of VC and DMOG on the mRNA expression of hypoxia genes of broiler PASMCs under hypoxia condition
2.3 VC/H2O2/DMOG对肉鸡缺氧PASMCs氧化还原状态及缺氧基因转录的影响
2.3.1 VC/H2O2/DMOG对肉鸡缺氧PASMCs氧化还原状态的影响 从图5可看出,肉鸡PASMCs培养液和裂解液中VC含量常氧空白组最低,除VC+H2O2+DMOG组外,培养液中VC含量与缺氧组相比达到显著水平(P<0.05)。缺氧条件下,H2O2+DMOG组培养液中VC含量显著高于除VC组外的其他缺氧组(P<0.05),裂解液中VC含量最高,但仅与VC组相比达到显著水平(P<0.05);VC组培养液中VC含量最高,与其他缺氧组相比达到显著水平(P<0.05),裂解液中VC含量最低但各处理组之间无显著差异(P<0.05);VC+H2O2+DMOG组培养液中VC含量最低,显著低于其他缺氧组(P<0.05)

图5 VC、H2O2和DMOG对肉鸡缺氧PASMCs培养液和裂解液氧化还原状态的影响Fig.5 Effect of VC,H2O2and DMOG on the redox state of culture medium and lysis solution of broiler PASMCs under hypoxia condition
肉鸡PASMCs培养液和裂解液中SOD活性常氧空白组都处于最高水平,培养液中SOD活性与VC+H2O2+DMOG组相比达到显著水平(P<0.05),裂解液中SOD活性与缺氧组相比均达到显著水平(P<0.05)。
肉鸡PASMCs培养液中MDA含量常氧空白组最高,显著高于除H2O2+DMOG组外的其他缺氧组(P<0.05),VC组SOD/MDA的比值最大,显著高于其他处理组(P<0.05)。
2.3.2 VC/H2O2/DMOG对肉鸡缺氧PASMCs缺氧基因转录的影响 从图6可看出,肉鸡PASMCs缺氧基因HIF-1α/VEGF/VEGFR2mRNA的相对转录量于VC+H2O2+DMOG组最大,极显著高于其他处理组(P<0.01);VEGFR2mRNA的相对转录量H2O2+DMOG组显著高于常氧空白组、缺氧空白组和VC组(P<0.05)。

图6 VC/H2O2/DMOG对缺氧肉鸡PASMCs基因转录的影响(数据经过对数转换)Fig.6 Effect of VC/H2O2/DMOG on the mRNA expression of hypoxia genes of broiler PASMCs under hypoxia condition(Data of figure 6is logarithmic conversion)
3 讨 论
HIF-1α是肉鸡AS发生的关键启动因子。研究证实,VC是降解HIF-1α蛋白关键酶活性得以发挥的必需营养成分[5],可有效降低肉鸡肺、肝中HIF-1α的表达,增强血清抗氧化水平,显著降低肉鸡AS的发病率。VC是一种广谱抗氧化物,在细胞内外液中都有重要的抗氧化活性,能有效清除O-2、H2O2、OH-、LOO-等,减轻氧化剂对RNA转录、DNA、蛋白质或膜结构的损伤。但当有过渡金属(如铁和铜)存在时VC也可能起还原剂作用[12]。SOD是清除体内自由基的重要抗氧化酶,而MDA是脂质过氧化反应链式终止阶段产生的小分子产物,其含量可间接反映自由基的产生情况[13]。SOD/MDA比值能够反映自由基引起的脂质过氧化和清除速率,便于深入了解自由基的代谢情况。
本试验在CoCl2诱导肉鸡PASMCs建立细胞缺氧模型的基础上进行。结果发现,常氧条件下缺氧基因HIF-1α/VEGF/VEGFR2的转录量都很低,而缺氧能显著上调其转录,这与D.Shweiki等的研究结果[14]一致。缺氧会引起机体自由基代谢异常[15],H2O2的添加加剧细胞氧化与抗氧化失衡,加强氧化应激,上调HIF-1α和VEGF mRNA的表达[16-17]。有研究证实H2O2与HIF-1α和VEGF mRNA的显著转录息息相关[18]。饲粮中添加1 000 mg·kg-1VC能增强肉鸡血清抗氧化水平,显著下调AS肉鸡肺HIF-1α/VEGF/VEGFR2mRNA的转录[2-3]。本试验同样发现VC能显著提升培养液中SOD/MDA的比值,增强肉鸡PASMCs抗氧化能力,显著下调HIF-1α/VEGF/VEGFR2mRNA的转录。
脯氨酸羟化酶是HIF-1α通过泛素蛋白途径降解的限速酶[19]。DMOG通过抑制脯氨酸羟化酶活性来抑制HIF-1α羟化,减少HIF-1α蛋白降解,稳定HIF-1α蛋白活性,上调HIF-1信号通路。试验发现DMOG的添加显著下调HIF-1αmRNA的转录,原因在于DMOG阻断了HIF-1α通过泛素化蛋白途径的降解,使其在细胞内大量积累[5],反馈性地下调HIF-1αmRNA的转录。脯氨酸羟化酶的抑制剂有两类:铁螯合剂,如去铁敏和环吡酮胺,或铁竞争剂,如二氯化钴(CoCl2);酮戊二酸类似物,如DMOG[20-21]和FG-4487等。本试验用于化学诱导缺氧的CoCl2已竞争性地抑制了脯氨酸羟化酶的活性,再加入DMOG进一步抑制脯氨酸羟化酶对HIF-1α的羟化作用,使HIF-1α蛋白保持稳定,并与HIF-1β结合形成HIF-1[22]。DMOG使HIF-1α蛋白在细胞内的大量积累,显著提升其靶基因VEGF mRNA的相对转录量[23],且VEGF和VEGFR2的表达受多种上游转录因子,如HIF-1α、癌基因Ras和细胞因子等的共同调控[24]。在CoCl2诱导肉鸡PASMCs缺氧的基础上,VC+DMOG以及VC+H2O2+DMOG作用时,VC不仅没有下调缺氧基因的转录,反而促使其相对转录量显著升高,甚至是常氧组的上万倍。可能由于VC在不同生理状态下其作用效果存在差异。本试验条件下VC可能增加了肉鸡缺氧PASMCs对DMOG和H2O2+DMOG的敏感性,这与马爱国等研究发现0.5 mmol·L-1VC可能增加细胞DNA对H2O2及其他有害物质损害的敏感性的结果[25]一致。
4 结 论
VC可以有效地缓解肉鸡缺氧PASMCs因H2O2氧化刺激引起的缺氧基因的转录,但还能增强其对DMOG和H2O2+DMOG的敏感性,上调缺氧基因的转录。
参考文献(References):
[1] NAIN S,WOJNAROWICZ C,LAARVELD B,et al.Vascular remodeling and its role in the pathogenesis of ascites in fast growing commercial broilers[J].Res Vet Sci,2009,86(3):479-484.
[2] YANG X,LUO Y H,ZENG Q F,et al.Effects of low ambient temperatures and dietary vitamin C supplement on growth performance,blood parameters,and antioxidant capacity of 21-day-old broilers[J].Poult Sci,2014,93(4):898-905.
[3] 曾秋凤.肉鸡腹水综合征的营养调控及其机理研究[D].雅安:四川农业大学,2006.ZENG Q F.Study on the effect of nutrients on ascites incidence of broilers and the possible mechanism[D].Ya’an:Sichuan Agricultural University,2006.(in Chinese)
[4] SEMENZA G L.Regulation of mammalian O2homeostasis by hypoxia-inducible factor 1[J].Annu Rev Cell Dev Biol,1999,15:551-578.
[5] PAN Y,MANSFIELD K D,BERTOZZI C C,et al.Multiple factors affecting cellular redox status and energy metabolism modulate hypoxia-inducible factor prolyl hydroxylase activity in vivo and in vitro[J].Mol Cell Biol,2007,27(3):912-925.
[6] ZHOU Q,LIU L Z,FU B,et al.Reactive oxygen species regulate insulin-induced VEGF and HIF-1αexpression through the activation of p70S6K1in human prostate cancer cells[J].Carcinogenesis,2007,28(1):28-37.
[7] DOSTANIC-LARSON I,MAVRAKIS L,XU W,etal.Mitochondrial superoxide dismutase enzyme(Mn-SOD)regulates hypoxia inducing factor-1alpha (HIF-1a)activity in human vascular endothelial cells [J].Am J Respir Crit Care Med,2010,181:A3936.
[8] KNOWLES H J,RAVAL R R,HARRIS A L,et al.Effect of ascorbate on the activity of hypoxia-inducible factor in cancer cells[J].Cancer Res,2003,63 (8):1764-1768.
[9] 曹 林,曾秋凤,张克英,等.维生素C对肉鸡缺氧肺动脉平滑肌细胞缺氧诱导因子-1α转录水平的影响[J].畜牧兽医学报,2016,47(2):388-396.CAO L,ZENG Q F,ZHANG K Y,et al.Effects of vitamin c on the transcription of hypoxia inducible factor-1αof broiler pulmonary artery smooth muscle cells under hypoxia[J].Acta Veterinaria et Zootechnica Sinica,2016,47(2):388-396.(in Chinese)
[10] BONELLO S,ZÄHRINGER C,BELAIBA R S,et al.Reactive oxygen species activate the HIF-1αpromoter via a functional NFκB site[J].Arterioscler Thrombo Vasc Biol,2007,27(4):755-761.
[11] LIVAK K J,SCHMITTQEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25 (4):402-408.
[12] ZEMPLENI J,SUTTIE J W,GREGORY III J F,et al.Handbook of vitamins[M].CRC Press,2013.
[13] 郭小权,胡国良,曹华斌,等.高能低蛋白日粮致脂肪肝出血综合征鸡抗氧化能力和肝损伤的研究[J].中国兽医学报,2010,30(6):829-832.GUO X Q,HU G L,CAO H B,et al.Antioxidative functions and liver injury in laying hens with fatty liver hemorrhagic sydrome induced by high energy-low protein diet[J].Chinese Journal of Veterinary Science,2010,30(6):829-832.(in Chinese)
[14] SHWEIKI D,ITIN A,SOFFER D,et al.Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis[J].Nature,1992,359(6398):843-845.
[15] GUPTA V,LAHIRI S S,SULTANA S,et al.Antioxidative effect of Rhodiola imbricata root extract in rats during cold,hypoxia and restraint(C-H-R)exposure and post-stress recovery[J].Food Chem Toxicol,2010,48(4):1019-1025.
[16] GAO N,SHEN L,ZHANG Z,et al.Arsenite induces HIF-1αand VEGF through PI3K,Akt and reactive oxygen species in DU145human prostate carcinoma cells[J].Mol Cell Biochem,2004,255(1-2):33-45.
[17] GAO N,JIANG B H,LEONARD S S,et al.p38Signaling-mediated hypoxia-inducible factor 1αand vascular endothelial growth factor induction by Cr(VI)in DU145human prostate carcinoma cells[J].J Biol Chem,2002,277(47):45041-45048.
[18] LIU L,NING X,HAN S,et al.Hypoxia induced HIF-1 accumulation and VEGF expression in gastric epithelial mucosa cell:involvement of ERK1/2and PI3K/Akt[J].Mol Biol(Mosk),2008,42(3):459-469.
[19] DEMIDENKO Z N,BLAGOSKLONNY M V.The purpose of the HIF-1/PHD feedback loop:to limit mTOR-induced HIF-1α[J].Cell Cycle,2011,10(10):1557-1562.
[20] BERNHARDT W M,GOTTMANN U,DOYON F,et al.Donor treatment with a PHD-inhibitor activating HIFs prevents graft injury and prolongs survival in an allogenic kidney transplant model[J].Proc Natl Acad Sci U S A,2009,106(50):21276-21281.
[21] LIU X B,WANG J A,OGLE M E,et al.Prolyl hydroxylase inhibitor dimethyloxalylglycine enhances mesenchymal stem cell survival[J].J Cell Biochem,2009,106(5):903-911.
[22] KALLIO P J,WILSON W J,O’BRIEN S,et al.Regulation of the hypoxia-inducible transcription factor 1αby the ubiquitin-proteasome pathway[J].J Biol Chem,1999,274(10):6519-6525.
[23] LIU L X,LU H,LUO Y,et al.Stabilization of vascular endothelial growth factor mRNA by hypoxia-inducible factor 1[J].Biochem Biophys Res Commun,2002,291(4):908-914.
[24] NEUFELD G,COHEN T,GENGRINOVITCH S,et al.Vascular endothelial growth factor(VEGF)and its receptors[J].FASEB J,1999,13(1):9-22.
[25] 马爱国,刘四朝.不同剂量维生素C对DNA氧化损伤影响的研究[J].营养学报,2001,23(1):12-15.MA A G,LIU S C.Effect of different levels of ascorbic acid on DNA damage[J].Acta Nutrimenta Sinica,2001,23(1):12-15.(in Chinese)
(编辑 白永平)
Molecular Mechanism of Vitamin C on Hypoxia Inducible Factor-1αmRNA Transcription of Broiler Pulmonary Artery Smooth Muscle Cells under Hypoxia Condition
CAO Lin,ZENG Qiu-feng*,ZHANG Ke-ying,DING Xue-mei,BAI Shi-ping,LUO Yu-heng,WANG Jian-ping,XUAN Yue,SU Zhuo-wei
(Key Laboratory of Animal Nutrition for Disease Resistance in the Ministry of Education,Institute of Animal Nutrition,Sichuan Agricultural University,Ya’an625014,China)
Abstract:This study was conducted to investigate the molecular mechanism of Vitamin C(VC)on redox state and the mRNA transcription of hypoxia inducible factor-1α(HIF-1α),Vascular endothelial growth factor(VEGF)and Vascular endothelial growth factor receptor 2(VEGFR2/Flk-1)in broiler PASMCs under hypoxia condition through dimethyloxalylglycine(DMOG)and H2O2.This study executed on the basis of the culture of PASMCs and hypoxia model,included 3 experiments,VC and H2O2,VC and DMOG,VC and H2O2+DMOG,including 5treatments with six replicates of each experiment.Compared with control group under normoxic and hypoxic,Exp.1showed that VC significantly increased SOD to MDA ratio(P<0.05),and down-regulated the mRNA transcription of HIF-1α/VEGF/VEGFR2(P<0.05);Exp.2showed that DMOG significantly increased SOD to MDA ratio(P<0.05),and down-regulated the mRNA transcription of HIF-1αand VEGFR2(P<0.05)respectively,but significantly up-regulated the mRNA tran-scription of VEGF(P<0.05),VC+DMOG significantly up-regulated the mRNA transcription of HIF-1α/VEGF/VEGFR2(P<0.05);Exp.3showed that VC+H2O2+DMOG markedly upregulated the mRNA transcription of HIF-1α/VEGF/VEGFR2(P<0.01).These results suggested that VC could increase cellular antioxidantive ability,and regulate the relative expression of hypoxia genes based on the activity of proline hydroxylase and the redox state of broiler PASMCs.
Key words:broiler pulmonary artery smooth muscle cells;hypoxia;hypoxia inducible factor-1α;vitamin C;H2O2;DMOG
中图分类号:S852.2
文献标志码:A
文章编号:0366-6964(2016)05-1033-08
doi:10.11843/j.issn.0366-6964.2016.05.022
收稿日期:2015-10-10
基金项目:国家自然科学青年基金(31101733);四川农业大学211双支计划
作者简介:曹 林(1990-),男,四川绵阳人,硕士生,主要从事家禽营养与饲料研究,E-mail:1315522048@qq.com
*通信作者:曾秋凤,研究员,博士,主要从事家禽营养与饲料研究,E-mail:zqf@sicau.edu.cn

