巴拉圭瓜多竹CCR基因的克隆与分析
朱金鑫,孙金金,原晓龙,王 娟,杨宇明,王 毅
( 1.国家林业局重点开放性实验室云南珍稀濒特森林植物保护和繁育实验室,云南省森林植物培育与开发利用重点实验室,昆明 650201; 2.云南林业学科院云南,昆明 650201; 3.西南林业大学,昆明 650224)
巴拉圭瓜多竹CCR基因的克隆与分析
朱金鑫1,3,孙金金1,3,原晓龙1,2,王 娟1,2,杨宇明1,2,王 毅1,2
( 1.国家林业局重点开放性实验室云南珍稀濒特森林植物保护和繁育实验室,云南省森林植物培育与开发利用重点实验室,昆明 650201; 2.云南林业学科院云南,昆明 650201; 3.西南林业大学,昆明 650224)
肉桂酰辅酶A还原酶(cinnamoyl-CoA reductase,CCR)是木质素生物合成途径中关键酶。本研究依据转录组数据设计特异性引物,采用RT-PCR方法成功地从巴拉圭瓜多竹(Guaduaparaguayanan)中克隆得到一个全新的CCR基因的全长cDNA序列,命名为GpCCR。序列分析结果表明,GpCCR包含完整的cDNA开放阅读框(ORF),由1065bp组成,编码354个氨基酸。Blast比对结果显示该蛋白质属于CCR家族蛋白;系统进化树结果显示瓜多竹与禾本科植物大麦、水稻等亲缘关系较近。荧光定量PCR检测显示GpCCR在巴拉圭瓜多竹的茎秆中表达量最高,在叶中表达量最低。
瓜多竹;木质素生物合成;肉桂酰辅酶A还原酶;基因克隆;荧光定量PCR
竹(Bamboo)属禾本科(Gramineae)竹亚科(Bambusadea)植物,全世界有竹类70余属1 200多种,我国有40属500多种,是世界上最主要的产竹国,且竹在中国几千年工农业生产、文化艺术、日常生活等诸多方面占据着重要地位[1]。巴拉圭瓜多竹(Guaduaparaguayanan)隶属于瓜多竹属,分布于南美洲巴西、巴拉圭、阿根廷等国[2],秆径5~8 cm,为热带大型实心秆丛生竹种,该竹种具有生长迅速、易繁殖、生物量大、结构性能优良等优点[3],在哥伦比亚、厄瓜多尔、尼加拉瓜建筑业得到广泛利用[4-5],具有重要的商业潜在开发价值。云南省林业科学院于2014年从巴西引种栽培,种植于云南省云兴园艺有限公司普洱市曼昔坝苗圃基地。
竹材造纸在我国具有悠久历史,目前仍是造纸工业的重要原料。虽然竹材造纸具有原料易得、成浆容易、成纸光滑等优点,但其木质素是影响竹浆产量和质量的一个重要因素,去除过程需要大量消耗能源和使用一些有毒化学物质,且黑液难以回收,严重影响竹浆品质,增加成本的同时造成很大的环境负担[6-9]。木质素(Lignin)是由3种单体聚合而成的、包围在木纤维等管束细胞和厚壁细胞的一类复杂的化合物,木质素不仅是细胞壁的基本组成成分,参与细胞壁木质化过程,对植物有形态建成、机械强度支撑等重要作用,且保卫植物免受病原菌侵害方面,其总体含量、各单体比例对植物物理特性、抗病和抗逆性等具有决定性影响作用,是陆生维管植物进化过程中的必要因子[10-12]。其生物合成途径主要为:单体合成、储存、运输、聚合而成木质素[13],其单体生物合成的起始物为L-苯丙氨酸,而L-苯丙氨酸在合成植物体内次生酚类物质的过程中有着多种合成流向,其产物除木质素外还有类黄酮、黄酮、鞣质、花色素苷、香豆素等多种次生酚类物质[14]。肉桂酰辅酶A还原酶(Cinnamoyl-CoA Reductase,CCR)是木质素单体合成特异途径的第1个关键酶,在NADPH的辅助下,以3种2肉桂酰辅酶A酯类作为底物(香豆酰辅酶A、阿魏酰辅酶A、芥子酰辅酶A)催化生成相应的肉桂醛,决定着苯丙氨酸代谢途径的最终流向,对木质素单体生物合成起着重要作用[15-16]。目前已报道的CCR分子量一般在38 kD左右,其分子量、等电点、最适pH、米氏常数均随不同物种而略有差异[17-19],且不同来源的CCR对各种底物的亲和力不同[20],已报道的CCR的氨基酸序列保守位点[21]有:(1)VCVTGAGGFIASWLVKLLL;(2)GYTVKG-TVRNP;(3)GVFHTASP;(4)VTDDPEQMVEPAV;(5)VRRVVFTSSIGVA;(6)TKNWYCYGKAVAE;(7)GVDLVVVNPVLVIGPLLQ;(8)ASGRYLC-AE;(9)TVKSLQEKGHL,利用基因工程定向改良木质素的含量或单体比例已经成为木质素的研究热点之一,而CCR被认为是最佳研究对象之一[22],在保证植物正常生长发育的前提下,可以使用RNAi技术特异性的抑制CCR基因表达,使转基因植株木质素含量下降[23-26]。目前,CCR基因已在水稻(Oryzasativa)[27]、马尾松(Pinusmassonian-a)[28]、象草(Pennisetumpurpureum)[29]、银杏(Ginkgobiloba)[30]、苎麻 (Boehmerianivea)[31]等多种植物中发现,但目前尚未见到在实心秆的瓜多竹中克隆得到CCR基因的相关报道,本研究对瓜多竹CCR基因进行克隆与分析,为深入研究瓜多竹木质素代谢途径相关基因、木质素生物合成的分子机理以及通过基因工程等手段对木质素的含量和单体比例进行调控提供科学依据,为其在造纸工业的应用、减轻环境污染、促进生态文明建设提供理论依据。
1 材料与方法
1.1 实验材料与试剂
Guaduaparaguayanan分子样本采于普洱市云兴园艺有限公司苗圃基地,样本经液氮速冻后于-80 ℃冰箱保存备用。pEASY-T3克隆试剂盒及Trans1-T1感受态细胞均购自北京全式金公司;TaKaRaLATaq酶、Prime Script1st Stand cDNA Synchesis Kit购自大连宝生物工程有限公司;TRIzol试剂购自上海生工生物公司。
1.2 实验方法及步骤
1.2.1 GpCCR基因克隆 以肉桂酰辅酶A还原酶的保守序列氨基酸为模板,通过本地 Blast技术分析获得茎秆转录组数据中存在的可能肉桂酰辅酶A还原酶序列。根据筛选出来的序列设计基因特异引物,按TRIzol试剂盒操作步骤提取瓜多竹茎秆总RNA,cDNA合成参照PrimeScriptTMⅡ 1st Stand cDNA Synchesis Kit试剂盒说明书操作,以cDNA第一链为模板、GpCCR-F和GpCCR-R为引物,PCR扩增获得GpCCR基因片段。PCR扩增体系:10×LATaqBufferⅡ 10 μL,dNTP Mixture 4 μL,引物GpCCR-F 1 μL,引物GpCCR-R 1 μL,cDNA 3 μL,TaKaRaLATaq1 μL,ddH2O 30 μL;反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,30个循环,最后延伸7 min;4 ℃结束反应。用1% 琼脂糖凝胶电泳检测PCR产物后,将PCR产物回收纯化后连接到pEASY-T3载体,转化到Trans1-T1感受态细胞中,然后涂布在含有AMP抗性的LB固体平板培养基上过夜,第2天挑选克隆,接种到0.5mL液体培养基中,200 r·min-1,37 ℃培养6 h后,进行菌落PCR检测阳性克隆插入片段,将有预期插入片段的阳性克隆送往测序公司检测,并对测序结果用Conting Express序列拼接软件进行全长序列拼接,同时利用DNAMAN软件进行序列分析。

表1 引物序列
1.2.2 生物信息学分析 利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)对cDNA序列和氨基酸序列进行Blast(http://www.ncbi.nlm.nih.gov/BLAST)比对分析,使用Protparam、NCBI ORF Finder(http://www.ncbi.nlm.nih.gov/gorf.html)和DNAMAN生物学软件对GpCCR基因的cDNA序列和氨基酸序列进行生物学信息分析;利用软件MEGA 5以邻位连接法(Neighbor-Joining)构建GpCCR的氨基酸序列的系统进化树。
1.2.3 RT-PCR检测GpCCR组织表达分析 采集巴拉圭瓜多竹茎秆,竹笋和竹叶三个不同组织提取RNA,采用TaKaRa Super RT Kit试剂盒获得cDNA第一链。Real-time RT-PCR反应用荧光染料SYBR Green Ⅰ,GAPDH为内参基因。PCR反应体系20 μL,反应程序为:94 ℃ 4 min;95 ℃ 15 s;57 ℃ 15 s,72 ℃ 25 s,35个循环,72 ℃单点检测信号。反应结束后,60 ℃连续检测信号产生溶解曲线。用Opticon monitor 3.1软件进行数据的记录和分析。每个样品3次重复,灭菌水对空白对照。
2 结果与分析
2.1 GpCCR基因的克隆
根据CCR转录组数据设计特异引物(CCR-F和CCR-R),克隆得到巴拉圭瓜多竹的肉桂酰辅酶A还原酶(GPCCR)基因片段;Blast比对结果表明其属于肉桂酰辅酶A还原酶合成基因家族。再以所获得的序列设计特异性引物,RACE法扩增得到GPCCR的3′端和5′端;软件拼接而得到GpCCR全长cDNA序列,以此设计含有起始密码子和终止密码子的引物,以cDNA为模板扩增得到完整的基因片段,利用NCBI ORF Finder软件对测序结果进行序列分析,结果显示GpCCR基因片段包含完整的cDNA开放阅读框(ORF),序列全长1065bp,编码含有354个氨基酸的蛋白质,起始密码子为ATG,终止密码子TGA。

图1 瓜多竹CCR与其他植物CCR部分氨基酸序列比对结果注:CCR NADPH结合位点用绿色荧光标志,保守位点用方框标志;用于对比的氨基酸序列分别为:Lolium perenne,AAL47182.1;Miscanthus sacchariflorus,ALG76005.1;Oryza sativa Japonica Group,NP001061909.1;Saccharum officinarum,CAA13176.1.Fig.1 Multiple alignment of the part of amino acid sequences of GpCCR with CCRs from other plant species.(A)Residues of the NADPH blinding marked with emitting green substrate, conserved site of the amino acid sequences marked with textbook; (B)The accession numbers of the sequences used in the comparison are: Lolium perenne,AAL47182.1;Miscanthus sacchariflorus,ALG76005.1;Oryza sativa Japonica Group,NP001061909.1;Saccharum officinarum,CAA13176.1.
2.2 GpCCR氨基酸序列比对分析
将克隆出来的GpCCR基因编码的氨基酸蛋白序列与已报道的CCR的氨基酸序列进行多重序列比对。结果显示该蛋白与已报道的CCR超家族的保守结构域具有高度一致性,共用signatural CCR催化位点,表明该蛋白属于CCR家族蛋白。GpCCR的氨基酸序列与85.6%黑麦草序列相同(AAL47182.1),与76.2%荻序列相同(ALG76005.1),与81%水稻序列相同(NP_001061909.1),与76.8%甘蔗序列相同(CAA13176.1)(图1)。
2.3 GpCCR基因系统进化树分析
利用MEGA5的Neighbor-Joining构建基于瓜多竹CCR氨基酸的系统进化树(图2),分析结果表明,瓜多竹CCR与禾本科植物大麦关系最近,与禾本科植物水稻、玉米、芒等聚为一个分支,与双子叶植物沙梨、白杨、陆地棉等聚为不同分支,亲缘关系较远。由CCR基因系统进化树可知,CCR基因的聚类与植物分类大体一致,表明CCR基因和植物的进化过程密切相关。
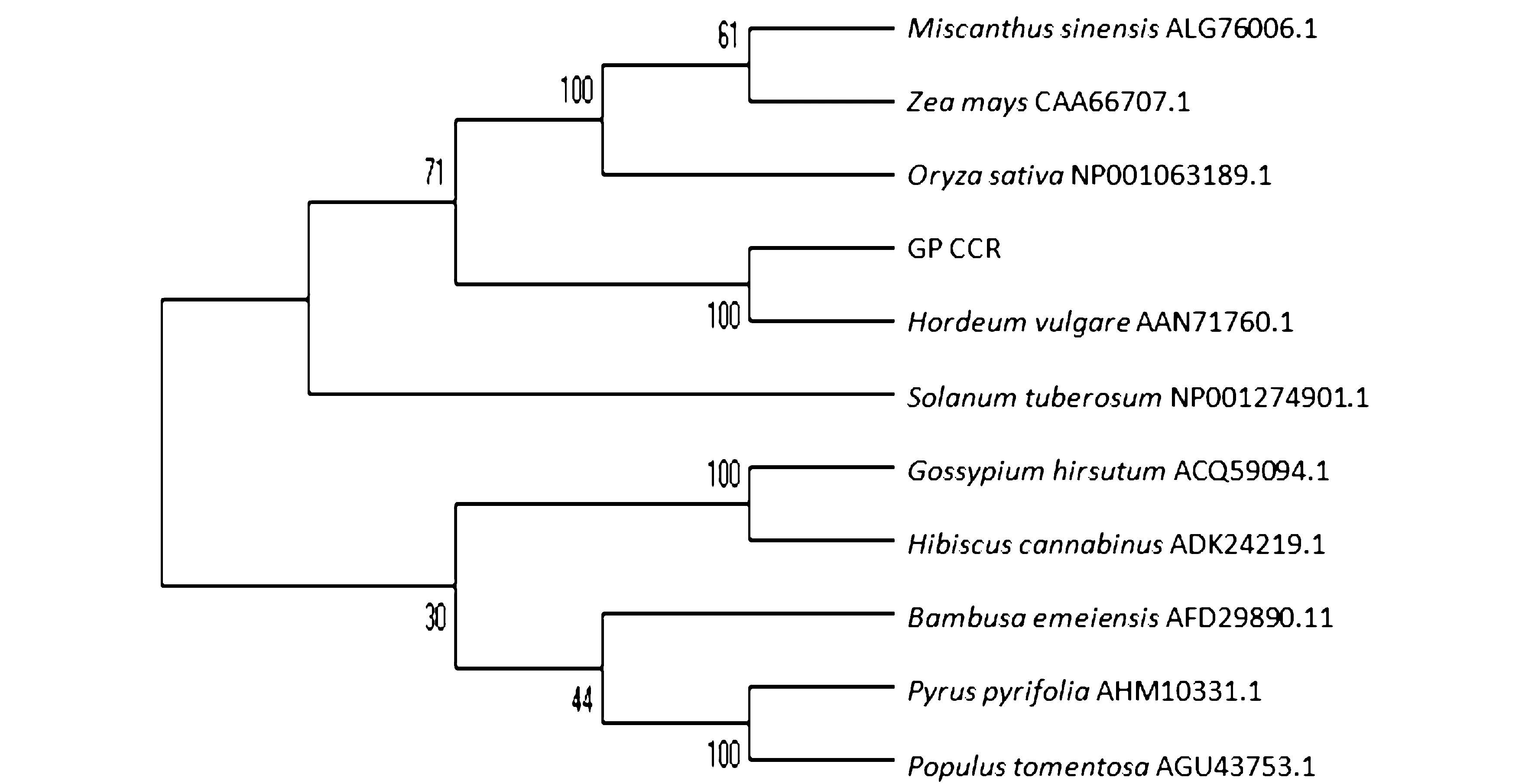
图2 瓜多竹CCR与其他植物CCR部分氨基酸序列构建系统进化树Fig.2 The phylogenetic tree based on the amino acid sequences of GpCCR with CCRs from other plant species
2.3 荧光定量PCR检测GpCCR
为确定GpCCR的功能,荧光定量PCR技术用来检测GpCCR基因在不同组织的表达情况。荧光定量PCR结果显示GpCCR在茎秆中表达量最高,竹笋中的表达量次之,在叶中的表达量最低(图3)。研究显示巴拉圭瓜多竹实心秆的主要成分之一是木质素,而荧光定量PCR结果显示GpCCR组织特异性地在茎秆中大量表达。这说明GpCCR参与了巴拉圭瓜多竹实心秆的形成过程。

图3 瓜多竹CCR不同组织表达Fig.3 Real time PCR detection of GpCCR in culms, leaves and shoots
3 结论与讨论
木质素不仅参与细胞壁木质化过程,是细胞壁的基本组成成分,对植物具有形态建成、机械强度支撑等重要作用,并且保卫植物免受病原菌侵害。肉桂酰辅酶A还原酶(Cinnamoyl-CoA Reductase,CCR)是木质素单体特异合成途径的第1个关键酶,催化3种在木质素生物合成中发挥着关键作用。此前人们通过化学和生化角度研究木质素的合成途径,本研究通过对转录组数据分析后筛选出的CCR基因设计特异性引物,从瓜多竹中克隆出其木质素生物合成途径中的肉桂酰辅酶A还原酶基因(GpCCR)。该cDNA全长1 065 bp,编码含有354个氨基酸的蛋白质,测序结果显示转录组数据真实有效。酶的催化能力主要在于其活性位点,只有少数特异氨基酸残基参与底物结合及催化作用,酶活性部位氨基酸序列较为保守,氨基酸序列分析表明该蛋白与已报道的CCR超家族的保守结构域具有高度一致性,表明该蛋白属于CCR家族蛋白;系统进化分析显示瓜多竹GpCCR蛋白与禾本科的大麦、水稻、玉米CCR蛋白等亲缘关系较近,说明本实验克隆出来的基因是肉桂酰辅酶A还原酶基因。
竹材一直是我国造纸行业的重要原材料,随着中国经济的发展,造纸行业也得到快速增长,但自2014年后中国政府对造纸行业环保要求趋于严格,加快淘汰落后产能,造纸行业2005年至2010年的急剧扩张势头趋于平缓,市场调整、行业整合进度加快,一些企业必将遭淘汰出局[32]。因此,改进生产工艺、降低成本、减轻行业对环境污染成为企业的唯一选择,而采用基因工程手段来调控木质素的生物合成,从材料源头降低木质素含量,可以在提高纸浆的得率和质量、降低成本的同时减轻对环境的压力,胡可等通过利用含有目标基因正向和反向重复序列片段能形成发卡结构的RNA(hpRNA)沉默编码CCR的基因,得到木质素含量显著降低的转基因黑麦草,在为影响黑麦草生长发育的状况下提高了黑麦草的利用率和消化率;宋恩慧等[33]培育出了生长发育正常的转基因杨树,对其茎横截面进行组织化学染色分析,发现转基因植株木质素含量较对照组平均降低9.7%,表明转基因植株更适合于造纸。瓜多竹具有生长迅速、易繁殖、生物量大、结构性能优良等优点,其优良的生物特性使其在造纸业具有极大的潜在商业价值。本研究进一步证实CCR在瓜多竹木质素生物合成途径中起着重要作用,为下一步深入研究瓜多竹的木质素生物合成途径及生物总量和单体比例调控提供了理论依据。
[1] 耿伯介,王正平.中国植物志第九卷(第一分册)[M].北京:科学出版社,1996.
[2] Lizarazu M A, Vega A S. Guadua[J]. Flora Argentina. Plantas Vasculares de la República Argentina, 2012, 3: 59-63.
[3] Tam C P T. Structural behavior of the guadua angustifolia. Connections in Guadua.[J]. Ingenier a E Investigaci n, 2004, 24(2):p gs. 3-7.
[4] Archila H F, Ansell M P, Walker P. Low carbon construction using bamboo-Guadua in Colombia[J]. Key Engineering Materials, 2012, 517.
[5] 孙茂盛.竹类植物资源与利用[M]. 北京:科学出版社,2015.
[6] 李金花, 张绮纹, 牛正田,等. 木质素生物合成及其基因调控的研究进展[J]. 世界林业研究, 2007, 01期:29-37.
[7] 李雪梅. 竹材造纸的发展前景[J]. 林业科技情报, 2008, 第4期:11-12.
[8] 崔敏, 殷亚方, 姜笑梅,等. 竹材制浆造纸技术研究与应用现状[J]. 竹子研究汇刊, 2010, 01期:1-5.
[9] 蒲韵. 论竹浆造纸的利弊[J]. 科技致富向导, 2014, 第26期:212-212.
[10] Barakat A, Yassin N B, Park J S, et al. Comparative and phylogenomic analyses of cinnamoyl-CoA reductase and cinnamoyl-CoA-reductase-like gene family in land plants.[J]. Plant Science An International Journal of Experimental Plant Biology, 2011, 181(3):249-257.
[11] Haiyun P, Rui Z, Louie G V, et al. Structural Studies of Cinnamoyl-CoA Reductase and Cinnamyl-Alcohol Dehydrogenase, Key Enzymes of Monolignol Biosynthesis[J]. Plant Cell, 2014, 26(9):3 709-3 727.
[12] 李波, 梁颖, 柴友荣. 植物肉桂酰辅酶A还原酶(CCR)基因的研究进展[J]. 分子植物育种, 2006, S1期:55-65.
[13] 魏建华, 宋艳茹. 木质素生物合成途径及调控的研究进展[J]. 植物学报:英文版, 2001, 第8期(8):771-779.
[14] 杨硕知. 木质素生物合成途径中关键酶肉桂酰辅酶A还原酶研究进展综述[J]. 安徽农学通报, 2010, 12期(12):44-45.
[15] Eric L, Simon H, Doorsselaere Jan, et al. Cinnamoyl CoA reductase, the first committed enzyme of the lignin branch biosynthetic pathway: cloning, expression and phylogenetic relationships. Plant J. 11, 429-441[J]. Plant Journal, 1997, 11(3):429-441.
[16] 李魏, 谭晓风, 陈鸿鹏. 植物肉桂酰辅酶A还原酶基因的结构功能及应用潜力[J]. 经济林研究, 2009, 第1期:7-12.
[17] Goffner D, Campbell M M, Campargue C, et al. Purification and Characterization of Cinnamoyl-Coenzyme A:NADP Oxidoreductase in Eucalyptus gunnii.[J]. Plant Physiology, 1994, 106(2):625-632.
[18] Sarni F, Grand C, Boudet A M. Purification and properties of cinnamoyl-CoA reductase and cinnamyl alcohol dehydrogenase from poplar stems (Populus X euramericana).[J]. European Journal of Biochemistry, 1984, 139(2):259-265.
[19] Wengenmayer H, Ebel J, Grisebach H. Enzymic Synthesis of Lignin Precursors. Purification and Properties of a Cinnamoyl-CoA: NADPH Reductase from Cell Suspension Cultures of Soybean (Glycine max)[J]. European Journal of Biochemistry, 1976, 65(2):529-536.
[20] Lauvergeat V, Lacomme C, Lacombe E, et al. Two cinnamoyl-CoA reductase (CCR) genes from Arabidopsis thaliana are differentially expressed during development and in response to infection with pathogenic bacteria.[J]. Phytochemistry, 2001, 57(7):1 187-1 195.
[21] 陈刚, 徐秉良, 白江平. 木质素生物合成酶CCR基因的生物信息学分析[J]. 生物信息学, 2013, 11(1):50-57.
[22] Boerjan W, Ralph J, Baucher M. Lignin biosynthesis[J]. Annual Review of Plant Biology, 2003, 54(1):519-546.
[23] Piquemal J C, Myton K, O′ C A, et al. Down-regulation of Cinnamoyl-CoA Reductase induces significant changes of lignin profiles in transgenic tobacco plants[J]. Plant Journal, 1998, volume 13(1):71-83.
[24] Song E. Cultivation of low lignin poplar by RNA interference.[J]. Scientia Silvae Sinicae, 2010.
[25] 刘晓晶. RNA干扰抑制的肉桂酰辅酶A还原酶和咖啡酸转移酶还原酶对单参木质素沉积及水溶性次生代谢物影响[D]. 陕西师范大学, 2010.
[26] 胡可, 严雪锋, 栗丹,等. 沉默CCR和CAD基因培育低木质素含量转基因多年生黑麦草[J]. 草业学报, 2013, 05期(5):72-83.
[27] 白勇, 巩威, 刘天昀,等. 水稻肉桂酰辅酶A还原酶基因的克隆与表达分析[J]. 科学通报, 2003, 48(16):1 780-1 784.
[28] 陈碧华. 马尾松肉桂酰辅酶A还原酶基因(CCR)克隆及分析(英文)[J]. 林业科学, 2009, 12期.
[29] 朱琼华, 张向前, 霍松,等. 象草CCR基因的克隆与生物信息学分析(英文)[J]. 农业科学与技术:英文版, 2012, 第2期(2):284-291.
[30] 唐映红, 陈建荣, 刘芳,等. 苎麻肉桂酰辅酶A还原酶基因cDNA序列的克隆与分析[J]. 作物学报, 2015.
[31] Prashant S, Sunita M S L, Sirisha V L, et al. Isolation of cinnamoyl CoA reductase and cinnamyl alcohol dehydrogenase gene promoters from Leucaena leucocephala, a leguminous tree species, and characterization of tissue-specific activity in transgenic tobacco[J]. Plant Cell Tissue & Organ Culture, 2012, 108(3):421-436.
[32] 花小伟. 造纸业:底部趋稳弱势向上,纸种分化显著[J]. 中华纸业, 2015, 第15期:48-53.
[33] 宋恩慧. 杨树制浆性能改良的分子育种技术研究[D]. 安徽农业大学, 2009.
Cloning and Sequence Analysis of Cinnamoyl-CoA Reductase Gene fromGuaduaparaguayana
ZHU Jin-xin1,3, SUN Jin-jin1,3, YUAN Xiao-long1,2, WANG Juan1,2, YANG Yu-ming1,2, WANG Yi1,2
(1.Yunnan Laboratory for Conservation of Rare, Endangered & Endemic Forest Plants, Public Key Laboratory of the State Forestry Administration; Yunnan Provincial Key Laboratory of Cultivation and Exploitation of Forest Plants, Kunming 650204, Yunnan, China;2.Yunnan Forestry Academy, Kunming 650204,Yunnan, China; 3.Southwest Forestry University, Kunming 650204,Yunnan, China)
Cinnamoyl-coA reductase(CCR) is an important enzyme in the biosynthetic pathway of lignin. GpCCR was successfully obtained fromGuaduaparaguayananby RT-PCR with the primers specially designed based on the data from transcriptome. Sequence analysis showed the GpCCR had complete cDNA open readimg frame(ORF), which consisted of 1065bp encoding 354 amino acids. Blast analysis showed that GPCCR belonged to the CCR family. Phylogenetic analysis showed that theGuaduaparaguayananhad closer relative relationship withHordeumvulgareandOryzasativain the Gramineae. Real time PCR detection showed GpCCR was expressed the strongest in culms and the lowest in leaves ofGuaduaparaguayana.
Guaduaparaguayanan; Lignin biosynthesis; Cinnamoyl-coA reductase; Gene clone; Real time PCR
2015-12-04
云南省对外科技合作计划(2014IA3);云南省基础研究重点项目(2013FA054);云南省中青年学术技术带头人后备人才培养项目(2010CI016);国家林业局云南珍稀濒特森林植物繁育和保护重点实验室开发基金共同资助
朱金鑫(1993-),男,硕士研究生,主要从事植物学竹类研究。E-mail:1639807959@qq.com。通信作者:王毅(1981-),男,助理研究员,博士,主要从植物分子生物学研究。E-mail:228285818@qq.com

