阳澄湖与太湖微生物多样性与群落结构研究
陈紫丹,邱业先,吴 琼
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009)
阳澄湖与太湖微生物多样性与群落结构研究
陈紫丹,邱业先*,吴 琼
(苏州科技大学 化学生物与材料工程学院,江苏 苏州215009)
以不同季节的阳澄湖、太湖的水样和底泥为研究对象,采用PCR、T-RFLP技术结合的方式研究了两湖水样和底泥中微生物多样性与群落结构,从微生物角度出发分析引发阳澄湖、太湖养殖的螃蟹重大差异的原因。结果表明:春季两湖水体环境中微生物群落结构差异不显著,底泥环境中微生物群落结构差异甚大,夏季两湖水体中的微生物群落结构跟春季相比都发生了较大变化,底泥相比春季变化不大。阳澄湖水样的细菌群落优势度高于太湖水样,群落内物种分布相对均匀,其物种多样性也较高。可能由于两湖水体微生物和底泥微生物种群和多样性的差异,影响了蟹的生长环境与营养,从而导致了两湖蟹养殖上的差异,即阳澄湖水体与底泥微生物为螃蟹的养殖与生长提供了更为良好的环境。
微生物;多样性;群落结构;T-RFLP技术
近年来随着分子生物学技术的迅速发展,从分子水平对微生物的群落结构进行研究已经成为可能[1]。末端限制性酶切片段长度多态性分析 (terminal restriction fragment length polymorphism,T-RFLP)就是在PCR技术和RFLP技术基础上发展起来的微生物群落分析的最新技术之一[2]。这种技术可有效地用于微生物菌种鉴定、群落的对比和多样性分析[3-4]。由于具有相对高的分辨率和可重复性[5-6],T-RFLP技术已经被广泛用来解析环境中微生物的群落结构[7-10]。为了探索不同水体底泥环境养殖螃蟹的质量区别,笔者采用T-RFLP技术研究了不同季节苏州太湖和阳澄湖湖水及底泥微生物多样性与群落结构。
1 材料与方法
1.1 春夏样品采集
2014年3月26、27日,底泥样品及水样用沉积物柱状采样器用五点采样法分别采自江苏省苏州阳澄湖(31°29′24″N,120°49′21″E)、东太湖(31°10′20″N,120°31′28″E)。采集的样品于冷藏条件下2 h内带回实验室,置于4℃冰箱保存。7月15、16日,同样方法同一采集地点,取回阳澄湖和太湖水样和底泥样品。
1.2 DNA提取
1.2.1 底泥总DNA提取
称取3 g底泥样品,用Ezup柱式土壤DNA抽提试剂盒(上海生工生物工程有限公司)提取底泥中DNA,具体操作步骤见试剂盒说明书。为减少DNA提取过程中产生的偏差,抽提重复三次,将三次提取得到的DNA混合到一起。提取的DNA置于4℃保存。
1.2.2 水样中总DNA提取
取水样15 mL,加3 M醋酸钠1.5 mL、33 mL无水乙醇,静置于-20℃冰箱3 d后,于5 500 rpm,7℃冷冻离心35 min。用Dzup基因组DNA快速抽提试剂盒(上海生工生物工程有限公司)提取DNA,具体操作步骤见试剂盒说明书。为减少DNA提取过程中产生的偏差,抽提重复三次,将三次提取得到的DNA混合到一起。提取的DNA置于4℃保存。
1.3 16S rDNA的PCR扩增
以提取的底泥样品及水样总DNA分别为模板,采用下列引物扩增细菌16S rDNA序列:

其中正向引物5'端用6-羧基二乙酸荧光素(FAM)标记,引物由上海生工生物工程有限公司合成并标记。
PCR反应体系25 μL,其中1 μL Primer1(FAM-8F)、1 μL Primer2(1492R)、12.5 μL 2×Taq MasterMix、1 μL模板DNA,用ddH2O补足至25 μL。阴性对照用1 μL ddH2O代替模板DNA[11]。
PCR反应条件:94℃预变性5 min;94℃变性40 s;55℃退火40 s,72℃延伸90 s,30次循环;72℃延伸10 min;4℃保存。
1.4 16S rDNA PCR产物的纯化与限制性酶切
PCR反应完成后,将反应产物用1%琼脂糖凝胶电泳进行检测,用无菌刀片割取目的条带后使用胶回收试剂盒(上海生工生物工程有限公司)回收PCR产物。具体操作步骤见试剂盒说明书。采用限制性内切酶HhaⅠ对PCR产物进行酶切。酶切体系30 μL,其中2 μL Fast Digest HhaⅠ、2 μL 10×Fast Digest Buffer、26 μL模板DNA。酶切条件为37℃反应1 h,65℃终止反应20 min。
1.5 末端限制性片段长度多态性(T-RFLP)分析
将酶切产物送至上海生工生物工程有限公司进行基因扫描,得到T-RFLP图谱。
2 结果与分析
2.1 PCR产物扩增结果
不同季节不同样品16S rDNA的基因扩增产物用1%琼脂糖凝胶电泳检测结果如图1、图2所示,从图中可以看到扩增片段为单一明亮清晰的条带,其大小在1 700 bp左右。

图1 春季不同样品PCR扩增产物结果

图2 夏季不同样品PCR扩增产物结果
2.2 酶切图谱
不同季节的两湖底泥和水样基因组DNA酶切图谱如图3、图4所示,图中A、B、C、D分别指太湖底泥、太湖水样、阳澄湖底泥、阳澄湖水样的酶切图谱。
春季两湖底泥和水样中优势菌群的种类及其变化见表1。夏季两湖底泥和水样中优势菌群的种类及其变化见表2。

图3 春季太湖底泥、太湖水样、阳澄湖底泥、阳澄湖水样细菌群落多样性酶切图谱
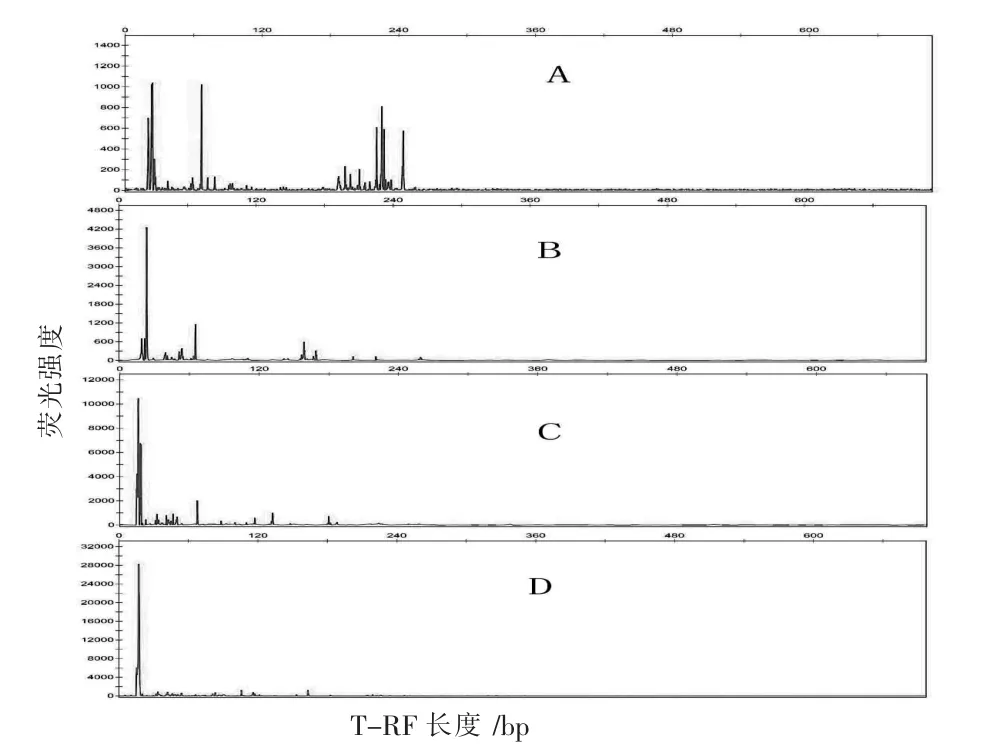
图4 夏季太湖底泥、太湖水样、阳澄湖底泥、阳澄湖水样细菌群落多样性酶切图谱

表1 春季两湖底泥和水样中优势菌群的种类及其变化

表2 夏季两湖底泥和水样中优势菌群的种类及其变化
根据表1、表2得出春夏两季两湖不同样品中细菌T-RF比例如图5、图6所示。
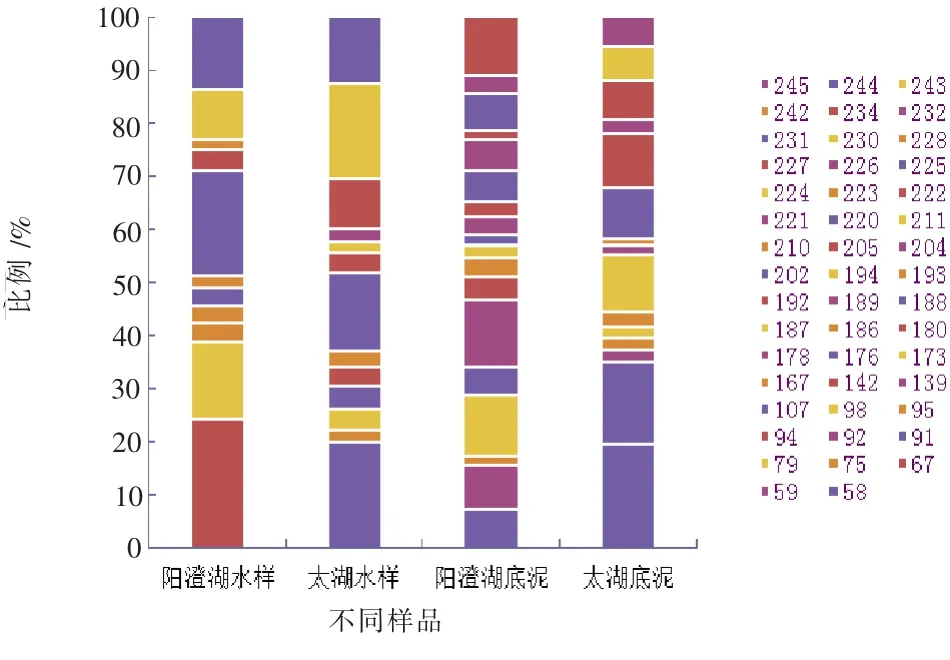
图5 春季两湖不同样品中细菌T-RF比例图

图6 夏季两湖不同样品中细菌T-RF比例图
从表1和图5中可以看出,在春季样品中,无论是阳澄湖还是太湖,其水样和底泥样本中细菌群落结构各不相同,每个样本中所含优势菌也有所不同,阳澄湖水样中的细菌优势种群T-RF分别为67 bp、187 bp、225 bp、244 bp,所占比例分别为23.97%、14.67%、19.85%、13.57%;太湖水样中的细菌优势种群T-RF分别为67 bp、187 bp、186 bp、224 bp,所占比例分别为16.12%、10.35%、14.86%、12.37%。太湖底泥中的细菌优势种群T-RF分别为67 bp、188 bp、211 bp、225 bp,所占比例分别为19.38%、15.59%、11.01%、10.17%,阳澄湖底泥中的优势种群比例超过10%的T-RF长度分别为79 bp、92 bp、205 bp,所占比例分别为11.46%、12.49%、11.03%,其他种群所占比例都较小,因此,这些种群可能为阳澄湖底泥中的优势种群。
从表2和图6中可以看出,阳澄湖水样中优势T-RF分别为106 bp、116 bp、163 bp,所占比例分别为12.32%、11.7%、13.89%;太湖水样中,优势T-RF分别为67 bp、162 bp、172 bp,所占比例分别为23.65%、17.3%、8.15%;阳澄湖底泥中,优势T-RF分别为67 bp、116 bp、132 bp、180 bp,所占比例分别为18.02%、6.39%、11.49%、8.07%;太湖底泥中,优势T-RF分别为67 bp、221 bp、225 bp、244 bp,所占比例分别为14.74%、9.72%、13.62%、11.57%。
从图4和图5中可以看出,两湖样品中夏季较之春季的微生物多样性有了明显增强,这与夏季温度升高有关,温度是影响微生物生长繁殖最重要的因素之一,在一定温度范围内,机体的代谢活动与生长繁殖随着温度的上升而增加[12]。
综上所述,春季两湖水样中的优势种群差别不明显,说明春季两湖水体环境的微生物群落结构类似。而底泥环境中,阳澄湖底泥中的优势T-RF片段均未在太湖底泥中检测到,两湖底泥微生物群落结构差别较大。到了夏季,两湖的底泥水样中优势T-RF片段与春季相比都有了很大变化,有些片段已经检测不到,更多新的优势片段显示出来。这可能是随着季节更替,水体和底泥微生物均随着环境的变化而变化[13]。
2.3 阳澄湖与太湖细菌多样性比较分析

不同季节不同样品中香浓指数变化见图7。从图7中的香浓指数变化可以看出,春夏两季,两湖水样底泥中的香浓指数总体保持夏季香浓指数较大的趋势。香农指数表明细菌群落多样性越高,香浓指数值越大[17]。春季阳澄湖底泥的细菌群落多样性最大,太湖底泥相对次之。阳澄湖和太湖水样的细菌多样性也表现出这样的规律。夏季阳澄湖水样的群落多样性最大,而太湖水样次之,两湖底泥差别不明显。两湖水样中的群落多样性随着季节变化的趋势较大,底泥则变化不大,阳澄湖底泥甚至没有变化。
不同季节不同样品辛普森指数变化见图8。图8的辛普森指数变化显示,春季无论是阳澄湖或是太湖的底泥还是水样,其辛普森指数都存在明显差异,阳澄湖的底泥和水样中细菌群落优势度指数均明显高于太湖的底泥和水样。夏季,阳澄湖水样和太湖水样的群落优势度明显高于春季,而两湖底泥的群落优势度的变化则微乎甚微。阳澄湖水样的群落优势度高于太湖水样,群落内物种分布相对均匀,其物种多样性也较高[18]。
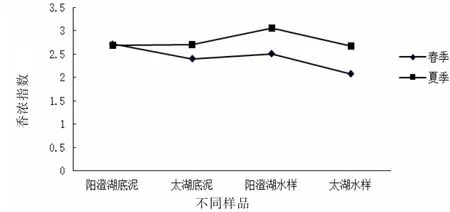
图7 不同季节不同样品中香浓指数变化

图8 不同季节不同样品辛普森指数变化
有研究表明[19],阳澄湖蟹可食部分矿物质元素大于太湖蟹,其含量分别为,雌性群体:9 983 mg·kg-1、7 599 mg·kg-1,雄性个体:7 833.24 mg·kg-1、7 501 mg·kg-1。阳澄湖清水大闸蟹享有“蟹中之王”的美称,其外形青背、白肚、黄毛、金爪,颜色鲜明,无杂色,而且体大膘肥,口感上肉质白嫩,蟹黄多,也是其他太湖区蟹无法比拟的。其原因在于阳澄湖有更好的水质,更适合各种微生物生长,也更适合孕育更鲜美的螃蟹。
3 结语
(1)随着季节的更替,春夏两季两湖的水样底泥中优势菌种片段发生了巨大变化。有些优势T-RF片段检测不到,有其他新的优势T-RF片段显现出来。
(2)分析两湖不同季节香浓指数可知,两湖水样中的群落多样性随着季节变化的趋势较大,底泥则变化不大,阳澄湖底泥的变化微乎其微。
(3)分析两湖不同季节辛普森指数可知,阳澄湖水样和太湖水样夏季的群落优势度明显高于春季。而阳澄湖水样在春夏两季其群落优势度均高于太湖水样,群落内物种分布相对均匀,其物种多样性也较高,其中的微生物结构组成更为和谐,种间竞争也更为平衡,从而给阳澄湖的螃蟹提供了更为良好的生长环境。
[1]周德平,褚长彬,范洁群,等.不同种植年限设施芦笋土壤微生物群落结构与功能研究[J].土壤,2014,46(6):1076-1082.
[2]彭三妹,王博林,徐建中,等.不同条件下连作杭白菊内生菌群的T-RFLP分析[J].中国中药杂志,2014,39(24):4763-4768.
[3]张华,蔡辉益,刘国华,等.T-RFLP分析技术在肉鸡肠道微生物研究中的应用[J].动物营养学报,2011,23(3):364-369.
[4]LIU W T.MARSH T L,CHENG H,et al.Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA[J].Applied and Environmental Microbiology,1997,63(11):4516-4522.
[5]储昭瑞,李相昆,孟令威,等.T-RFLP技术在厌氧氨氧化菌群结构分析中的应用[J].哈尔滨工业大学学报,2013,45(2):26-30.
[6]史青,柏耀辉,李宗逊,等.应用T-RFLP技术分析滇池污染水体的细菌群落[J].环境科学,2011,32(6):1786-1792.
[7]PARK H D,NOGUERA D R.Evaluating the effect of dissolved oxygen on ammonia-oxidizing bacterial communities in activated sludge[J].Water Research,2004,38(14/15):3275-3286.
[8]BERNHARD A E,DONN T,GIBLIN A E,et al.Loss of diversity of ammonia-oxidizing bacteria correlates with increasing salinity in an estuary system[J].Environmental Microbiology,2005,7(9):1289-1297.
[9]CABEZAS A,DRAPER P,MUXI L,et al.Post-treatment of a slaughterhouse waste water:stability of the microbial community of a sequencing batch reactor operated under oxygen limited condition[J].Water Science and Technology,2006,54(2):215-221.
[10]KUSKEL C R,YEAGER C M,BARNS S M,et al.Changes in nitrogen-fixing and ammonia-oxidizing bacterial communities in soil of a mixed conifer forest after wildfire[J].Applied and Environmental Microbiology,2005,71(5):2713-2722.
[11]钱玮,朱艳霞,邱业先.太湖底泥中厌氧氨氧化菌初步研究[J].江苏农业科学,2012(11):374-376.
[12]徐奇友,黄金凤.环境温度和蛋白质水平对鱼类生长和代谢的影响[J].东北农业大学学报,2012,42(12):1-8.
[13]凌云,林静,徐亚同.景观人工湿地微生物群落结构的季节变化[J].城市环境与城市生态,2009,22(4):8-10.
[14]董萍,孙寓姣,王红旗,等.利用T-RFLP技术对温榆河微生物群落结构研究[J].中国环境科学,2011(4):631-636.
[15]林生,庄家强,陈婷,等.不同年限茶树根际土壤微生物群落PLFA生物标记多样性分析[J].生态学杂志,2013,32(1):64-71.
[16]兰国玉,朱华,曹敏.西双版纳热带雨林树种多样性的尺度效应[J].西北植物学报,2012,32(7):1454-1458.
[17]贾志红,易建华,苏以荣,等.云南玉溪烟区轮作与连作土壤细菌群落多样性比较研究[J].应用与环境生物学报,2011,17(2):162-168.
[18]王宇超,王得祥,王宇超,等.佛坪自然保护区植物群落物种多样性和复杂性的海拔格局研究[J].西北植物学报,2013,33(1):169-176.
[19]柏如法,周刚,李跃华,等.中华绒螯蟹种质特性研究——江苏主要产区养殖河蟹可食部分矿物质元素特性的比较研究[J].水产养殖,2006,27(5):16-18.
责任编辑:李文杰
Comparative study on the microbial diversity and community structure in Yangcheng Lake and Tai Lake
CHEN Zidan,QIU Yexian,WU Qiong
(School of Chemistry,Biology and Material Engineering,SUST,Suzhou 215009,China)
Based on the water and bottom sludge samples of Yangcheng Lake and Tai Lake,we investigated the microbial diversity and community structure with the PCR and T-RFLP methods in order to analyze the reasons for the significant difference of the crabs bred in the two lakes from the microbiological perspective.The results indicate that the microbial diversity and community structure in the water of two lakes have no significant difference in spring,but do have much difference in summer.The difference is significant in the bottom sludge of the two lakes in spring while it is small in summer.Community structure of bacteria in the water of Yangcheng Lake is more harmonious than that of Tai Lake.In Yangcheng Lake,the distribution of species is relatively uniform and the microbial diversity is also better.These all have an effect on the crab breeding.Thus,the environment of grown for crabs is relatively better in Yangcheng Lake.
microorganism;diversity;community structure;technology of T-RFLP
X172
A
1672-0687(2016)02-0035-06
2015-03-06
陈紫丹(1989-),女,新疆阿克苏人,硕士研究生,研究方向:生物催化与转化工程。
*通信联系人:邱业先(1954-),男,教授,博士,硕士生导师,E-mail:qyx542@163.com

