荷叶多酚体外抗氧化活性研究
孙 建,蔡为荣,谢亮亮,许惠玲,孙涛涛,田 正(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
生物与食品科学
荷叶多酚体外抗氧化活性研究
孙建,蔡为荣∗,谢亮亮,许惠玲,孙涛涛,田正
(安徽工程大学生物与化学工程学院,安徽芜湖241000)
探究荷叶中多酚类物质的抗氧化活性.以体积分数55%乙醇恒温浸提荷叶中的多酚类物质,得到粗多酚(LP-C),经AB-8大孔树脂纯化得纯化多酚(LP-P),LP-C经大孔树脂吸附依次由30%乙醇和50%乙醇洗脱,得级分LP-30和LP-50;对上述4组样品的总还原力、羟基自由基清除率和亚硝酸盐清除率进行测定,采用HPLC-DAD法初步分析LP-30和LP-50成分.各组样品在质量浓度0.02~0.2 mg/m L范围内总还原力、清除羟基自由基活力和清除亚硝酸盐活力有良好的量效关系;经HPLC-DAD分离,级分LP-30出现3个主峰,LP-50出现7个主峰.荷叶多酚具有优良的抗氧化活性.
荷叶;多酚;清除率;抗氧化活性;HPLC-DAD
荷叶(Nelumbinis Folium),又称莲茎,古称芙蓉、菡萏、芙蕖,在我国南北均有分布,有上千年的食用历史,它是睡莲科植物莲(Nelumbo nucifera Gaertn)的干燥叶.荷叶苦平,归肝、脾、胃,具有清解暑热、凉血止血作用,同时具有抑制高胆固醇血症和动脉粥样硬化、抗有丝分裂、抑菌和止痉挛等作用[1].1991年卫生部将荷叶列入第二批“既是食品又是药品”的名单中[2].同时,荷叶中的生物活性成分种类繁多、含量丰富,这种源于自然、安全无害的植物越来越受到医学、食品、日用化工等行业的青睐.
现代研究表明,荷叶中除含有丰富的碳水化合物、脂类、蛋白质、单宁等常规化学成分外,还含有具有明显生物活性和生理功能的黄酮类、酚酸类、木脂素类等多酚类物质.Lee[3]等研究指出荷叶多酚物质具有抑制血管内皮生长因子(VEGF)诱导血管再生的活性,同时荷叶中多酚类物质具有较强的总还原力、清除DPPH·自由基活力和清除亚硝酸盐活性.实际上,关于荷叶多酚的抗氧化活性、多酚中有效活性成分分析等报道并不多见.研究立足于此,期望通过建立不同抗氧化体系探究荷叶多酚体外抗氧化活性强弱,继而通过HPLC技术分离分析其活性成分.
1 材料与方法
1.1材料与试剂
荷叶,购于芜湖市中山药房,干燥、粉碎后过80目筛备用;AB-8大孔树脂(天津市南开大学化工厂产品);Folin-Ciocalteu试剂(Sigma公司);无水碳酸钠、没食子酸、抗坏血酸、乙酸、水杨酸、无水乙醇、硫酸亚铁、双氧水、磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、氯化钠、氢氧化钠、浓盐酸均为分析纯;无水对氨基苯磺酸(AR,国药集团化学试剂有限公司);盐酸萘已二胺(AR,上海晶纯试剂有限公司);无水甲醇(色谱级),实验中试剂配制为双蒸水,HPLC分析用超纯水.
1.2仪器与设备
722型可见分光光度计(上海佑科仪器仪表有限公司);H H-6数显恒温水浴锅(常州国华电器有限公司);LGJ-10冷冻干燥器(北京松源华兴科技发展有限公司);DHG-9023电热恒温鼓风干燥箱(上海三发科学仪器有限公司);JY1002电子天平(上海良平天平厂);RE-52A旋转蒸发器(上海青浦沪西仪器厂);TGL-16C离心机(金坛市杰瑞尔);DZX-6050B真空泵(上海福玛实验设备有限公司);Waters1525高效液相色谱仪(配备1525二元泵,DAD2998检测器,2707自动进样器,Breeze2工作站;美国Waters公司).
1.3方法
(1)没食子酸标准曲线的绘制.参考Maria[4]等方法,并做少许改动.准确称取0.25 g没食子酸标准品用50%乙醇溶液定容至50 m L容量瓶,再分别配制0.05 mg/m L、0.1 mg/m L、0.15 mg/m L、0.2 mg/m L、0.25 mg/m L、0.3 mg/m L、0.5 mg/m L标准溶液.分别从上述标液中各取0.1 m L于10 m L刻度试管中,加适量蒸馏水混合后,加入0.5 m L稀释10倍的Folin-ciocalteu试剂,混合反应5 min后加入2 m L质量分数15%的Na2CO3溶液,混合,定容,静置2 h后在765 nm处测吸光度.
(2)荷叶多酚的提取和含量测定.按料液比1∶20、温度60℃、55%乙醇(V/V)条件下恒温浸提90 min,将所得浸出物抽滤,滤渣按同样条件再次浸提,抽滤,滤液混合.混合液于旋转蒸发器中,38℃条件下真空除去乙醇,得到浓缩液,3 500 r/min下离心除去沉淀,得荷叶多酚粗提取液(LP-C).适当稀释后计算待测液多酚质量浓度C,按下式计算荷叶多酚提取率,以没食子酸当量(Gallic Acid Equivalent,GAE)表示,单位为mg GAE/g荷叶干粉.荷叶干粉提取率为:

式中,C为待测样品液质量浓度;V为提取液体积;N为浓缩液稀释倍数;m为称量的荷叶粉质量.
(3)粗多酚的纯化.参考朱静对大孔树脂的处理方法[5]对AB-8大孔树脂进行预处理.将所得LP-C分为两份,分别上柱,一份直接用70%(V/V)乙醇溶液进行洗脱,得到样品LP-P;另一份依次用30%(V/V)、50%(V/V)和70%(V/V)乙醇溶液进行梯度洗脱,得到级分LP-30、LP-50和LP-70.将所得洗脱液旋蒸除去溶剂,冷冻干燥.多酚纯度计算:称取冻干后质量为m2的样品,溶解,测定其多酚总量m1,计算其纯度为:

(4)抗氧化活性研究.准确称取各组样品(或Vc)50 mg溶解于50%乙醇中,转移至50 m L容量瓶,定容得到质量浓度1 mg/m L样品原液.随后配制各种不同质量浓度样品待测液,以Vc为阳性对照,考察各组多酚样品的总还原力,清除羟基自由基活力和清除亚硝酸盐活力.
①总还原力的测定.参考Liu[6]等的方法,实验用水为双蒸水,铁氰化钾溶液须现配现用.②清除羟基自由基的测定.参考颜军[7]等的方法,其清除率公式为:

式中,A0为空白对照液吸光值;A1为加入样品后反应体系吸光值;A2为样品的本底吸光值.
③清除亚硝酸盐的测定.参考宋茹[8]等的方法,其清除率公式为:

式中,A0为以样品溶剂代替样品溶液测得的吸光值;A1为加入样品液后实验组吸光值;A2为以蒸馏水代替亚硝酸钠溶液测得吸光值,样品的本底吸收.
(5)HPLC-DAD分析.色谱分析主要考察了LP-30部分和LP-50部分可能含有的活性成分.DAD检测器启用3D波长扫描模式,波长扫描范围210~400 nm.柱子为沃特斯Sunfire反相C18柱(4.6×150 mm,5μm),配备柱温箱保持分离条件下恒温30℃.进样体积为20μL,流速0.8 m L/min.流动相:A相,无水甲醇;B相,0.5%乙酸水溶液(v/v).LP-30部分与LP-50部分的活性成分种类、性质不同,故采用两种不同梯度洗脱程序.对级分LP-30:0~10 min,5%~10%A相;10~30 min,10%~50%A相.对级分LP-50:0~8 min,30%~30%A相;8~18 min,30%~55%A相;18~40 min,55%~65%A相.
2 结果与分析
2.1各组样品多酚的含量
应用软件Origin 8.0进行线性拟合,得到没食子酸标准曲线的回归方程Y=0.889 7X+0.009 3,在0.05~0.5 mg/m L质量浓度范围内线性关系良好,相关系数达到0.997 6,标准曲线如图1所示.
将多酚粗提液稀释4倍,计算荷叶多酚提取率为48.50 mg GAE/g荷叶干粉,这与赵晓云[9]等对荷叶多酚的提取率相当.粗多酚(LP-C)经过大孔树脂纯化后得到纯化多酚(LP-P),其纯度由24.24%提高到52.85%,显示出大孔树脂对荷叶粗多酚优良的纯化效果,这与李均[10]等对中华补血草根多酚的纯化效果相当.另一部分粗多酚上大孔树脂经不同质量浓度乙醇溶液梯度洗脱后,级分LP-30得率为总吸附量的59.63%,级分LP-50得率为总吸附量的21.2%,级分LP-70得率为总吸附量的4.87%.表明级分LP-30多酚含量最丰富,LP-50含量次之,LP-70含量最低.经计算,荷叶多酚在大孔树脂上总解吸率为86.35%.
2.2抗氧化实验结果
(1)各组样品的总还原力大小.还原力强的样品产生的电子能将反应体系中的铁氰化钾(K3[Fe(CN)6])的三价铁还原成二价铁(亚铁氰化钾),二价铁进一步和三氯化铁反应,生成在700 nm波长下有最大吸光值的普鲁士蓝(Fe4[Fe(CN)6]3)[11].依照同样的反应机理,孟庆焕[12]测定了牡丹种皮黄酮的总还原力,反应体系吸光值越大表示样品的还原力越强,还原力与样品抗氧化能力呈正相关.不同质量浓度下4组样品和Vc在700 nm波长处的吸光值变化如图2所示.由图2可以看出,各组样品随着样品质量浓度的增大,A700吸光值不断增大,还原力不断增强.整体来看,Vc的总还原力最强,在0.08 mg/m L质量浓度时,吸光值达到0.533,而LP-P为0.331,LP-C仅为0.12,总还原力大小顺序为:LP-P>LP-30>LP-50>LP-C.在质量浓度达到0.1 mg/m L时,LP-P与LP-C在700 nm处吸光度分别为0.461与0.159.可见,荷叶多酚经AB-8大孔树脂纯化后,总还原力有显著增强.级分LP-30总还原力比LP-50强,质量浓度达到0.2 mg/m L时,两者的吸光值达到0.61和0.342,这可能与两样品中多酚的含量、种类和性质有关.
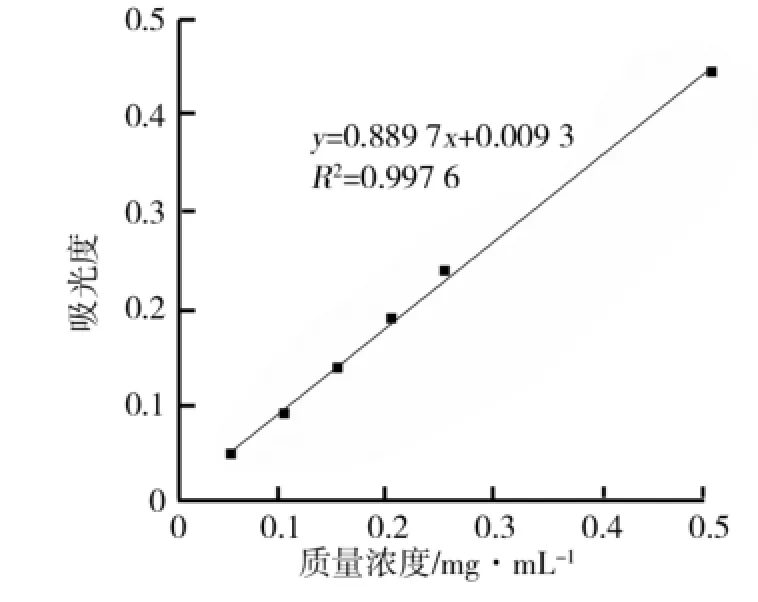
图1 没食子酸测定总多酚标准曲线

图2 不同质量浓度Vc和4组样品在700 nm波长处吸光值
(2)各组样品对羟基自由基的清除能力.生物体内,有害的羟基自由基会导致细胞膜系统氧化并与生物大分子反应,造成细胞损伤乃至死亡[13].样品和Vc在不同质量浓度下对羟基自由基的清除率如图3所示.由图3可以看出,Vc对羟基自由基的清除率最高,质量浓度为0.04 mg/m L时,清除率即达到50.15%,而LP-C在质量浓度达到0.2 mg/m L时,清除率仅有47.44%,但级分LP-30与LP-50清除率分别达到71.12%和63.73%.经计算,LP-30和LP-50的IC50分别为0.059 3 mg/m L和0.083 1 mg/m L,可见,级分LP-30清除率较高.整体来看,各组样品在0.02~0.2 mg/m L质量浓度范围内,对自由基的清除率均随质量浓度的增大不断增强,总清除活力大小顺序为:Vc>LP-30>LP-50>LP-P>LP-C.
(3)各组样品对亚硝酸盐的清除能力.亚硝酸盐能够与仲胺合成亚硝胺,而亚硝胺是一类明确的化学致癌物,它能够引起人体和动物肝脏等多种器官的恶性肿瘤[14].一次大剂量摄入亚硝酸盐会导致机体发生急性亚硝酸盐中毒,出现高铁血红蛋白症;长期低剂量摄入亚硝酸盐则会导致慢性亚硝酸盐中毒.可见,有效清除亚硝酸盐对机体健康有重要意义.不同质量浓度Vc和4组样品对亚硝酸盐的清除率影响如图4所示.由图4可以看出,Vc清除亚硝酸盐活力均较其他组强,在质量浓度为0.1 mg/m L时,其清除率即达到92.57%,质量浓度0.2 mg/ml时,清除率达到99.24%,这与库尔班[15]对Vc的实验结果一致.样品组中,LP-50的IC50(0.055 2 mg/m L)比LP-30的IC50(0.059 7 mg/m L)略低,在质量浓度0.02~0.1 mg/m L范围内,两组的清除率分别从19.31%到87.64%和15.58%到83.63%,并且都显示一定量效关系.值得注意的是,LP-C部分清除率大于LP-P,甚至在样品质量浓度0.02 mg/m L时,其清除率(22.56%)大于Vc清除率(16.18%).类似的,也有研究指出山竹壳粗多酚[14]的清除活力强于对照品Vc.整体来看,4组样品对亚硝酸盐均有显著的清除活力,在质量浓度达到0.2 mg/m L时,其清除率都达到97%以上.

图3 不同质量浓度Vc和4组样品对羟基自由基的清除率

图4 同质量浓度Vc和4组样品对亚硝酸盐的清除率
2.3HPLC-DAD分析
样品经DAD检测器在线紫外波长扫描(210~400 nm),结合田娜[16]和Ye[17]等研究所用波长,选择360 nm为走样检测波长.两级分和标准品的色谱分离图谱如图5、图6所示.由图5、图6可以看出,在选定的色谱柱、流速、洗脱梯度等色谱条件下,级分LP-30各组分分离度较好,LP-50部分峰6与峰7间的分离度R达到1.30>1,表明两峰的分离程度大于98%.总体来看,选定的色谱条件对两组样品中有效成分均有较为理想的分离,有利于后续研究.

图5 级分LP-30及标准品芦丁的HPLC分离图谱

图6 级分LP-50及标准品金丝桃苷和槲皮素的HPLC分离图谱
大多数黄酮类化合物在紫外波长扫描下呈现两个特征吸收峰,一个在波长300~400 nm范围内,称为带Ⅰ,由B-环肉桂酰系统影响;另一个在波长240~280 nm范围内,称为带Ⅱ,由A-环苯酰系统影响.级分LP-30峰2和标准品芦丁,LP-50峰5和标准品槲皮素的UV谱图如图7所示.由图7可以看出,级分LP-30中,峰2保留时间(32.742 min)与芦丁保留时间(32.693 min)很接近,调出峰2和芦丁的UV谱图(见图7a)发现,峰2中出现两吸收峰(255.6,354.5)分别介于300~400 nm范围和240~280 nm范围,与芦丁类似,表明峰2成分可能含有肉桂酰系统和苯酰基.级分LP-50中,槲皮素出峰时间(23.970 min)与峰5(24.147 min)相近,调出峰5的UV谱图(见图7b)发现,峰5的两吸收峰(254.4,362.8)同样介于300~400 nm和240~280 nm范围内,与槲皮素类似,表明峰5成分中可能也含有肉桂酰系统和苯酰基.

图7 级分LP-30峰2和标准品芦丁,LP-50峰5和标准品槲皮素的UV谱图
3 结论
荷叶多酚具有优良的抗氧化活性.总还原力测定结果表明,总还原力大小与样品质量浓度有明显的质量浓度依赖效应,4组样品总还原力大小顺序为:LP-P>LP-30>LP-50>LP-C;在Fenton体系中,级分LP-30表现出最高的清除·OH能力,其IC50为0.059 3 mg/m L,比LP-50(0.083 1 mg/m L)略低,质量浓度达到0.2 mg/m L时,清除率可达到71.12%;在清除亚硝酸盐实验中,各组样品均表现出较高的清除率,质量浓度为0.1 mg/m L时,级分LP-50与LP-30的清除率随即达到87.64%和83.63%.质量浓度达到0.2 mg/m L时,各组样品的清除率均可达到97%以上;HPLC-DAD分离结果表明,选定的色谱条件对LP-30和LP-50中活性组分分离较好,级分LP-30有3个主峰,LP-50有7个主峰.
[1]张蕾,乔旭光.荷叶黄酮对油脂抗氧化作用研究[J].粮食与油脂,2009,25(5):19-21.
[2]靳素荣,姚礼峰,卢威,等.超声波法提取荷叶多酚工艺研究[J].氨基酸和生物资源,2006,28(3):20-22.
[3]J S Lee,S Shukla,J A Kim,et al.Anti-angiogenic Effect of Nelumbo Nucifera Leaf Extracts in Human Umbilical Vein Endothelial Cells with Antioxidant Potential[J].Plos One,2015,10(2):1163-1179.
[4]Francisco MLLD,Resurreccion AVA.Total Phenolics and Antioxidant Capacity of Heat-treated Peanut Skins[J].Journal of Food Composition and Analysis,2008,22(1):16-24.
[5]朱静,陆晶晶,袁其朋.大孔吸附树脂对石榴皮多酚的分离纯化[J].食品科技,2010,35(1):188-193.
[6]Q Liu,H Y Yao.Antioxidant Activities of Barley Seeds Extracts[J].Food Chemistry,2007,102(3):732-737.
[7]颜军,苟小军,邹全付,等.分光光度法测定Fenton反应产生的羟基自由基[J].成都大学学报:自然科学版,2009,28(2):91-93,103.
[8]宋茹,韦荣编,胡金申,等.荔枝皮色素体外清除亚硝酸盐作用研究[J].食品科学,2010,31(5):104-107.
[9]赵晓云,赵博,邢媛媛,等.荷叶多酚的微波辅助提取工艺优化及其抗氧化活性研究[J].中国酿造,2010(3):79-83.
[10]李均,陈炳华,王晶晶,等.AB-8大孔树脂对中华补血草根多酚的吸附洗脱特性[J].食品与发酵工业,2009,35(4):65-69.
[11]K I Berker,K Güçlü,I Tor,et al.Total Antioxidant Capacity Assay Using Optimized Ferricyanide/prussian Blue Method[J].Food Analytical Methods,2010,3(3):154-168.
[12]孟庆焕.牡丹种皮黄酮提取分离与抗氧化及抗疲劳作用研究[D].哈尔滨:东北林业大学,2013.
[13]王娅玲,李维峰,郭芬,等.微波辅助提取菱红菇多糖及抗氧化活性研究[J].食品工业科技,2015,36(9):251-254.
[14]王晓波,李金芳,王梅,等.山竹壳总黄酮抗氧化及抑制亚硝化作用研究[J].食品研究与开发,2013,34(6):9-13.
[15]库尔班·吐松,展锐,张宏,等.顶羽菊抗氧化活性研究[J].生物技术通讯,2010,21(3):406-412.
[16]田娜,刘仲华,黄建安,等.高效制备液相色谱法从荷叶中分离制备黄酮类化合物[J].色谱,2007,25(1):88-92.
[17]L H Ye,X X He,M Z Yan,et al.Identification of in Vivo Components in Rats After Oral Administration of Lotus Leaf Flavonoids Using Ultra Fast Liquid Chromatography with Tandem Mass Spectrometry[J].Analytical Methods,2014,6(15):6 088-6 094.
Study on in Vitro Antioxidant Activity of Polyphenols Extracted from Lotus Leaves
SUN Jian,CAI Wei-rong∗,XIE Liang-liang,XU Hui-ling,SUN Tao-tao,TIAN Zheng
(College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
The researh aimed to investigate the antioxidant activity of polyphenols from lotus leaves.LP-C was the polyphenols extracted with 55%ethyl alcohol at a constant temperature and LP-P was the total polyphenols purified by AB-8 macroporous resins.LP-30 and LP-50 were obtained by gradiently eluting polyphenols absorbed on macroporous resins.Total reducing power,hydroxy radical scavenging rate and nitrite sacvenging rate were measured for the above four samples.In additon,the HPLC-DAD method was used to analyze constituents of LP-30 and LP-50 preliminarily.The four samples exhibited strong total reducing power,hydroxy radical scavenging activity and nitrite scavenging activity,which was obviously related to the concentration(0.02~0.2 mg/m L).Three peaks in LP-30 and five peaks in LP-50 were determined by HPLC-DAD separation.Polyphenols in lotus leaves had excellent in vitro antioxidant activity.
lotus leaves;polyphenols;scavenging rate;antioxidant activity;HPLC-DAD
TS201.2
A
1672-2477(2016)04-0001-06
2016-01-10
安徽省自然科学基金资助项目(1408085 MC52)
孙建(1990-),男,河南信阳人,硕士研究生.
蔡为荣(1963-),男,安徽芜湖人,教授,硕导.

