不同来源内皮细胞生物学性状的比较
许慧芳,王俊力,邱昕,万小林,陈国华
·论著·
不同来源内皮细胞生物学性状的比较
许慧芳,王俊力,邱昕,万小林,陈国华
目的:比较大鼠胸主动脉来源的成熟内皮细胞和骨髓间充质干细胞(MSCs)来源的内皮细胞生物学性状及各自Akt表达的情况。方法:分离培养大鼠胸主动脉来源内皮细胞,诱导MSCs分化为内皮细胞,对2组细胞的细胞形态、增殖能力、成管能力进行比较,通过Western blotting比较其表面标记表达情况及Akt表达情况。结果:MSCs来源的内皮细胞形态学与成熟内皮细胞不尽相同,增殖能力和成管能力均强于后者。2组细胞均可表达内皮细胞的表面标记,但成熟内皮细胞表达强于分化而来的内皮细胞(P<0.05)。Akt表达在分化而来的内皮细胞明显高于成熟内皮细胞(P<0.05)。结论:MSCs分化而来的内皮细胞和成熟内皮细胞存在生物学性状和Akt表达差异。
内皮细胞;骨髓间充质干细胞;Akt
内皮损伤所致的内皮功能失调是动脉粥样硬化的始动因素,血管受损部位内皮化推迟及炎症细胞浸润、平滑肌细胞迁移和过度增殖可促进血栓形成及新内膜增生,导致靶血管狭窄发生[1],快速再内皮化对于恢复正常血管功能和调节新生血管内膜增生有至关重要的作用。成熟内皮细胞在损伤区域的再生缓慢,大多数情况下,新生的内皮细胞增殖、迁移、再排序是一个不完整的过程[2]。近年来有很多研究聚焦于内皮祖细胞(endothelial progenitor cells,EPCs)[3]和干细胞来源内皮细胞,证实两者对于血管再生和再内皮化的作用,这提示干细胞来源的前体细胞或内皮细胞可能是移植修复内皮损伤的突破口。Akt又称作蛋白激酶B(proteinkinase B,PKB)[4],是PI3K重要的下游分子,其中Akt1促进细胞存活和增殖,可能在促进受损动脉快速再内皮化中起重要作用。本研究探讨成熟内皮细胞和骨髓间充质干细胞(mesenchymal stem cells,MSCs)分化的内皮细胞生物学性状的差异,以及各自Akt表达的不同。
1 材料与方法
1.1材料
1.1.1动物 健康SD大鼠,雌雄不限,体质量200~250 g,由同济医学院动物中心提供。1.1.2主要试剂与仪器 DMEM/F12(购于美国Hyclon公司);胎牛血清、胰蛋白酶-EDTA消化液、胶原酶Ⅰ(购于美国Gibco公司);重组大鼠血管内皮生长因子(recombinant vascular endothelial growth factor,rVEGF,购于以色列Prospec公司);小鼠抗血管性血友病因子(von Willebrand factor,vWF)、血管内皮生长因子受体2(kinase insert domain receptor,KDR)、内皮型一氧化氮合酶(endothelialnitric oxide synthase,Enos)、磷酸化Akt(P-Akt)抗体及羊抗小鼠IgG二抗(购于美国Santa Cruz公司);基质胶(购于美国BD公司)。
1.2方法
1.2.1大鼠胸主动脉内皮细胞原代培养及传代和免疫荧光鉴定 大鼠颈部脱臼处死,消毒。无菌操作环境中剪开大鼠胸骨,取约2 cm左右的胸主动脉,去除外膜及脂肪组织。在培养基中将手术线穿过动脉管并封住血管的两端,加入适量胶原酶Ⅰ,在37℃、5%CO2环境中消化约30 min。加入胎牛血清终止消化,去除两端,将血管剪成3~4个1×1 mm2大小的组织块分别放入六孔培养板中,加入培养液(90%DEME/F12+10%FBS)培养约3 d。更换培养液继续培养直至细胞长满培养皿底部,消化并按1∶3传代培养。传代前以血细胞计数板计算细胞总数。免疫荧光鉴定:在培养板中将已爬好细胞的玻片用PBS浸洗3次,每次3 min;用4%的多聚甲醛固定爬片15 min,PBS浸洗玻片3次,每次3 min;PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min;吸水纸吸掉封闭液,不洗,每张玻片滴加足够量的稀释好的一抗(VWF)并放入湿盒,4℃孵育过夜;加荧光二抗:PBST浸洗爬片滴加稀释好的荧光二抗,湿盒中孵育1 h,PBST浸洗切片;复染核:滴加DAPI避光孵育5 min,PBST 5 min×4次洗去多余的DAPI;封片液封片,然后在荧光显微镜下观察采集图像。
1.2.2大鼠MSCs培养 大鼠脱臼处死,消毒。在无菌环境下取大鼠的胫骨和股骨,用5 mL注射器吸取适量DEME/F12冲出骨髓,去除大的杂质后倒入离心管,1 000 r/min离心5 min,弃上清,吸取培养基进行吹打悬浮后分瓶培养,培养基为90%DEME+10%FBS。待细胞长满瓶底后传代。
1.2.3MSCs诱导分化为内皮细胞 取第 2~3代MSCs,待其长至瓶底80%时开始加入诱导液(97% DMEM/F12+3%胎牛血清+VEGF 50 μg/mL)进行诱导。每隔2 d进行诱导换液,第13天停止诱导,加90% DMEM/F12,10%胎牛血清培养液进行正常培养,按1∶3比例进行传代。传代前以血细胞计数板计算细胞总数。按如上所述免疫荧光鉴定其表面标志。
1.2.4内皮细胞成管实验 取基质胶和24孔培养板,放入冰块上中待用,吸取约30 μL基底胶在24孔板上铺胶。取培养中的成熟内皮细胞和新分化内皮细胞,倒掉废液,加入PBS缓冲液清洗细胞,去除杂质。吸出缓冲液,加入适量胰蛋白酶,在显微镜下观察,当细胞由扁平逐渐变成圆形时加入含胎牛血清的培养液终止消化。将消化好的细胞溶液移至离心管中,1 000 r/min离心5 min。弃上清,重新悬浮细胞。取适量细胞液加入基质胶包被的24孔板中,加入适量培养液。放入培养箱中培养。自2 h开始,每隔0.5 h在显微镜下观察成管情况,并拍照。
1.2.5Western blotting检测 提取成熟内皮细胞、新分化内皮细胞、MSCs 3组细胞的总蛋白,测蛋白浓度后,各样品取50 μg总蛋白上样电泳,根据蛋白分子量配制6%的PAGE胶电泳。根据预染Marker显示,判断目的蛋白得到充分分离后,停止电泳。常规转膜,用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。用封闭液稀释相应的一抗,使PVDF膜浸泡于一抗孵育液中,4℃孵育过夜。TBST充分洗涤PVDF 膜5~6次,5 min/次。用封闭液稀释相应的HRP标记二抗1∶50 000稀释,使PVDF膜浸泡于二抗孵育液中,室温摇床孵育2 h。显色曝光:TBST充分洗涤PVDF膜5~6次,5 min/次。每张膜滴加适量的ECL底物液,孵育数分钟。
1.3统计学处理
采用SPSS 19.0统计软件进行数据分析,计量结果以(M±s)表示,t检验,方差分析,P<0.05为差异有统计学意义。
2 结果
2.1细胞形态学观察
MSCs生长情况:原代细胞接种后,细胞较多较杂,培养液外观浑浊,经过数次换液后,混杂细胞逐渐去除,可见培养瓶内梭贴壁细胞,后期随着细胞数目增多,细胞呈辐射状排列生长。传代后细胞生长增快,24 h完全贴壁,一般7 d左右可在瓶底完全长满融合,见图1A。内皮细胞生长情况:原代内皮细胞培养3 d左右,组织块周围开始出现内皮细胞,14 d左右细胞融合成片,形态一致,大小均匀,边界清晰,呈典型的“铺路石样”镶嵌排列生长,vWF表达阳性,见图1B、D。诱导分化的内皮细胞:诱导分化培养液中生长的MSCs,生长旺盛,13 d时观察细胞,形态学介于干细胞和成熟内皮细胞之间,梭形生长,有“铺路石样”改变趋势,vWF表达阳性,见图1C、E。

图1 细胞形态学观察
2.2细胞增殖情况
成熟内皮细胞自第2代开始,细胞增殖到(5~8)× 106个细胞的时间,大约为5~6 d,平均(5.7±0.40)d (n=6);新分化内皮细胞传代后计算增殖情况,至(5~8)×106个细胞大约4~5 d,平均(4.4±0.37)d(n=6);成熟内皮细胞增殖速度低于新分化内皮细胞,有显著性差异(t=5.782,P<0.001)。
2.3成管实验结果
在基质胶包被的培养板上,成熟内皮细胞大约6 h可形成管腔样结构并连接成网状,见图2A。新分化内皮细胞需要4 h左右,成管分支更多且粗大,见图2B。

图2 内皮细胞成管实验
2.4Western blotting检测结果
内皮细胞及新分化的内皮细胞均可表达特异性表面标记Vwf、KDR、eNOS,MSCs几乎不表达(少量表达eNOS);与细胞增殖成长相关的Akt表达,则是MSCs>新分化内皮细胞>成熟内皮细胞,见图3、表1,提示相对成熟内皮细胞,新分化内皮细胞的Akt有更高的表达。
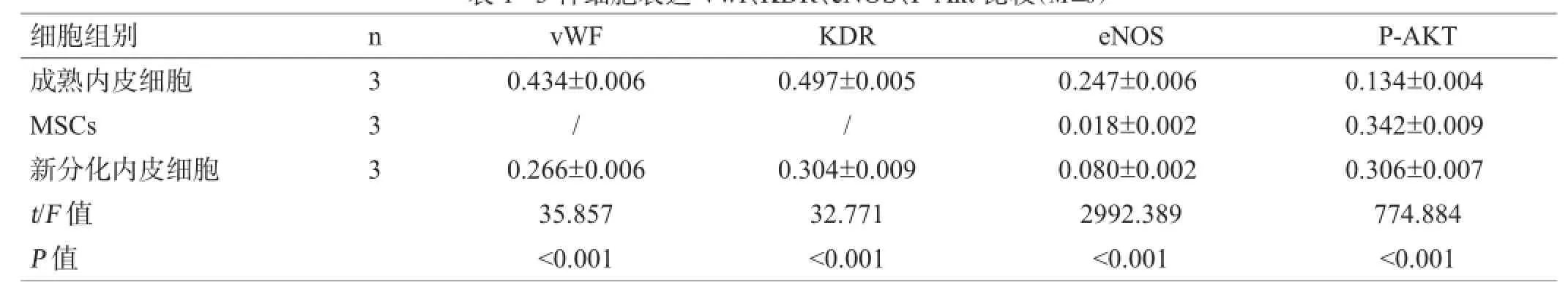
表1 3种细胞表达Vwf、KDR、eNOS、P-Akt比较(M±s)
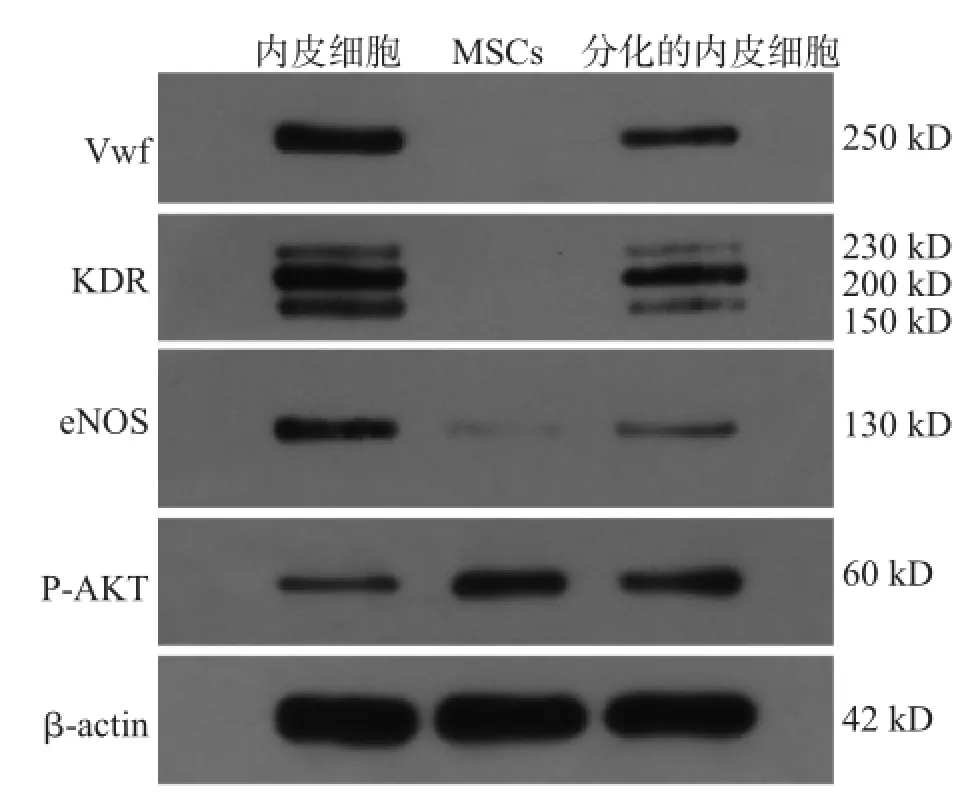
图3 细胞表面标记表达检测
3 讨论
血管内膜受损后快速修复,对于预防和治疗颈动脉粥样硬化性狭窄和颈动脉支架成形术术后再狭窄,是关键的一步,对于脑卒中预防意义重大[5]。长期以来人们一直认为成熟内皮细胞的增殖迁移能力极其有限,并不适合用于移植,因而内皮细胞直接移植修复血管内膜的研究也鲜有报道。EPCs是内皮细胞的前体。众多体内和体外试验均证实EPCs对于血管再生和再内皮化的作用,但EPCs特异性表面标志目前尚缺乏统一的意见。本研究表明,新分化的内皮细胞在形态学上与成熟内皮细胞存在差异,但可表达公认的内皮细胞表面标记,虽然表达强度与成熟内皮细胞相比略弱。可以以此获得成分单一,性质稳定的内皮细胞,且具有更好的增殖和成管能力。
Akt是PI3K重要的下游分子,目前发现至少有3种形式的Akt:Akt1、Akt2和Akt3。众多实验证实抑制AKT信号途径可抑制血管再生[6,7],本研究表明,新分化内皮细胞具有更强增殖和血管形成能力,且Akt表达明显强于成熟内皮细胞。故推断2组细胞的差异可能与Akt信号系统有关,而上调Akt表达,可能会使成熟内皮细胞获得与新分化内皮细胞一样的增殖能力和成管能力,可进一步设计实验进行验证。Akt信号系统是非常复杂的通路,该通路对于内皮细胞增殖能力和成管能力的具体作用机制也有待深入研究。
[1]Kirton JP,Xu Q.Endothelial precursors in vascular repair[J].Microvasc Res,2010,l79:193-199.
[2]Reidy MA,Clowes AW,Schwartz SM.Endothelial regeneration.V.Inhibition of endothelial regrowth in arteries of rat and rabbit[J].Lab Invest, 1983,49:569-575.
[3]崔斌,黄岚.大鼠脾源性内皮细胞移植在损伤血管内膜修复中的作用[J].第三军医大学学报,2006,28:1553-1556.
[4]Gosen N,She QB.AKT and cancer-is it allmTOR[J].Cancer Cell,2006, 10:254-256.
[5]Chu L,Hao H,Luo M,et al.Ox-LDL modifies the behavior of bone marrow stem cells and impairs their endothelial differentiation via inhibition of Akt phosphorylation[J].J Cell Mol Med,2011,15:423-432.
[6]Sami A,Karsy M.Targeting the PI3K/AKT/mTOR signaling pathway in glioblastoma:novel therapeutic agents andadvances in understanding[J]. Tumour Biol,2013,34:1991-2002.
[7]Polivka J Jr,Janku F.Molecular targets for cancer therapy in the PI3K/AKT/Mtor pathway[J].Pharmacol Ther,2014,142:164-175.(本文编辑:王晶)
Comparison of Biological Characters between Different Sources of Endothelial Cells
XU Hui-fang,WANG Jun-li,QIU Xin,WAN Xiao-lin,CHEN Guo-hua.Department of Neurology,Wuhan Traditional Chinese Medicine Hospital,Huazhong University of Science and Technology,Wuhan 430022,China
Objective:To compare the biological characters and Akt expression between rat endothelial cells and mesenchymal stem cells(MSCs)-derived endothelial cells.Methods:The endothelial cells derived from the thoracic aorta of rats were isolated and cultured,and MSCs were induced to differentiate into endothelial cells.The two groups of cells were compared for their morphology,proliferation,tube formation ability,and the expression of surface marker and Akt were exmaine by Western blot.Results:The morphology was different between stem cell-derived endothelial cells and mature endothelial cells.Proliferation and tube formation abilities of stem cell-derived endothelial cells were stronger than the latter.The both groups could express endothelial cells surface markers,but the mature endothelial cells were more intensive(P<0.05).Akt expression in stem cell-derived endothelial cells was significantly higher than that of mature endothelial cells(P<0.05).Conclusion:There were biological and Akt differences between MSCs-derived endothelial cells and mature endothelial cells.
endothelial cells;mesenchymal stem cells;Akt
R741;R321
A
10.16780/j.cnki.sjssgncj.2016.01.001
华中科技大学附属武汉市中西医结合医院神经内科
武汉430022
基金课题
武汉市学科带头人计划
(No.20127113045 8);
湖北省自然科学基金重点项目
(No.CDA061);
武汉市科技局
(No.201506170101 1618)
2015-01-26
陈国华
cghys2008@126. com

