酸敏感离子通道阻断剂对酸诱导偏头痛模型小鼠的影响
康玉琪,陈康,何小华,尹皓,毛立武,卢祖能#,肖哲曼#
·论著·
酸敏感离子通道阻断剂对酸诱导偏头痛模型小鼠的影响
康玉琪1*,陈康1*,何小华2,尹皓1,毛立武3,卢祖能1#,肖哲曼1#
目的:观察酸敏感离子通道阻断剂对酸诱导偏头痛模型小鼠行为学及相关蛋白表达的影响。方法:24只小鼠随机分为pH7.4组、pH6.0组、阿米洛利治疗组、PcTx1治疗组,每组6只。pH7.4组采用pH值7.4的合成组织间液(SIF)涂抹硬脑膜,后3组采用pH值6.0的SIF建立小鼠实验性偏头痛模型,阿米洛利治疗组、PcTx1治疗组分别给予阿米洛利和PcTx1治疗。观察小鼠制模后1 h内挠头次数、3 h后三叉神经脊束核尾侧亚核内c-fos及脑干中酸敏感离子通道(ASIC1a)蛋白的表达。结果:在造模后1 h内pH6.0组的挠头次数明显多于pH7.4组(P<0.01),阿米洛利治疗组和PcTx1治疗组则明显少于其他两组(P<0.01)。与pH7.4组相比,pH6.0组的小鼠脑干中三叉神经脊束核尾侧亚核内的c-fos免疫反应阳性细胞数明显增多(P<0.01);阿米洛利治疗组和PcTx1治疗组与pH6.0组相比,相应部位c-fos免疫反应阳性细胞数明显减少(P<0.01)。与pH7.4组相比,pH 6.0组脑干中的ASIC1a蛋白表达较高(P<0.05);阿米洛利治疗组、PcTx1治疗组与pH6.0组相比,ASIC1a蛋白表达均明显下调(P<0.01)。结论:酸敏感离子通道阻断剂能够减少偏头痛模型小鼠行为学异常及相关蛋白表达,提示酸敏感离子通道参与偏头痛的发生机制。
阿米洛利;PcTx1;偏头痛;c-fos;ASIC1a
偏头痛是临床上较常见的一种反复发作的原发性头痛,主要为头部一侧或双侧搏动样疼痛,可伴恶心、呕吐,部分患者发作前有眼前闪光或视野缺损等先兆症状,可有家族史,病程长者往往伴有焦虑、抑郁,严重影响患者工作和生活[1]。据统计,偏头痛全球发病率约为11%,在《2010年全球疾病负担评估》中高居第3位,并且此病具有很高的致残率,在致残特殊原因中居于第7位[2]。偏头痛的发病机制仍不十分清楚,有研究显示,该病的发生可能与遗传因素、雌激素、5-羟色胺、缓激肽、前列腺素E等有关,而焦虑、紧张、疲劳等精神因素、光、冷、声等物理因素及饮酒、咖啡等食物亦可诱发此病[3],主要有血管学说、三叉神经血管学说、皮质扩散性抑制学说。最近研究表明炎症通路在偏头痛的发作中发挥重要作用,酸敏感离子通道(acid-sensing ion channels,ASICs)又参与炎症反应[4],因此本文以酸诱导头痛小鼠为研究对象,探讨ASICs对偏头痛模型小鼠行为学及相关蛋白表达的影响。
1 材料与方法
1.1材料
1.1.1实验动物6~8周龄雄性SPF级C57小鼠24只,体质量20~25 g,由武汉大学ABSL-Ⅲ实验动物中心提供。保证正常昼夜规律,生理环境饲养1周,室温20℃,自然光照,通风良好,自由摄食和饮水。适应试验环境1周。
1.1.2主要试剂 阿米洛利、PcTx1(购于美国Sigma公司),由DMSO稀释;兔抗鼠c-fos抗体、驴抗鼠ASIC1a(购于美国Abcam公司);合成组织间液(synthetic interstitial fluid,SIF)由10 mmol/L Hepes、5 mmol/L KCl、1mmol/L MgCl2、5 mmol/L CaCl2、135 mmol/L NaCl组成。
1.2方法
1.2.1分组及偏头痛模型的建立 小鼠随机分为pH7.4组、pH6.0组、阿米洛利治疗组、PcTx1治疗组,每组6只。参考Wieseler等[5]的实验方法,在此基础上稍作修改。10%水合氯醛(0.004 mL/g)腹腔注射麻醉小鼠,消毒后剪开头皮暴露颅骨。在立体定位仪下定位于后囟点,两侧旁开1.5 mm定位,并由此两点分别向前3 mm处定位,以此四点为界用牙科水泥钻钻开3 mm×3 mm的颅骨,暴露矢状窦,避免损伤硬脑膜。用微量移液器在硬脑膜上分别涂上20 μL不同pH值的SIF,pH7.4组给予pH值7.4的SIF,其他3组均给予pH值6.0的SIF。为避免液体外漏用胶水将0.5 mL EP管盖粘于颅骨上,以免头皮碰到胶水,随后缝合伤口。阿米洛利治疗组在术后给予腹腔注射阿米洛利(100 mg/kg),PcTx1治疗组在硬脑膜给酸后给予 PcTx1毒素(500 ng/mL×5 μL)。
1.2.2偏头痛行为学检测 术后,将老鼠分别放入透明笼子中,待小鼠苏醒后计时1 h,记录小鼠挠头次数。
1.2.3脑标本采集 给药3 h后,用10%水合氯醛(0.004 mL/g)腹腔注射麻醉小鼠,开胸后于心尖部进针进入左心室,先用0.9%的生理盐水冲洗,随后用预冷4%多聚甲醛先快后慢灌注后取出小鼠脑部,将组织置于4%多聚甲醛固定液中4~6 h后,放于20%蔗糖中脱水,置于4℃冰箱,直至组织沉底。石蜡包埋。
1.2.4免疫组化 用石蜡切片机制备连续切片,片厚约2 μm,贴于预先涂0.1%多聚赖氨酸的载玻片上,67℃温箱烘干后,切片脱蜡脱水,3%双氧水封闭10 min,高温修复,自然晾干至室温,滴加兔抗鼠c-fos抗体(稀释倍数1∶200),4℃孵育24 h,滴加羊抗兔IgG室温孵育2 h。以上各步骤之间均用0.01 mol/L磷酸盐缓冲液(PBS pH值7.4)洗5 min,重复3次,最后用新鲜配制的0.05%DAB-0.01%H2O2混合液显色,镜下控制显色程度,复染,蓝化,常规梯度酒精脱水,二甲苯透明,中性树胶封片,晾干后观察。
1.2.5Western blotting取脑干组织(中脑、桥脑、延髓)样本加入RIAP细胞裂解液,用匀浆器充分匀浆,直至裂解。将上述EP管中液体 12 000rpm,4℃离心10 min,取上清置于新的离心管中。用BCA法测定蛋白浓度,向蛋白中加入5×SDS上样缓冲液(按4∶1的体积比混匀),100℃沸水浴10 min。取适量样品上样,SDS-PAGE电泳,先用80 V恒压电泳约40 min,后改为120 V恒压电泳约70 min。电泳结束后将凝胶上蛋白质带转移至聚偏氟乙烯(PVDF)膜上。将PVDF膜放入50 mL含5%脱脂牛奶的1×TBST中,于室温下封闭2 h。将膜放入稀释的一抗中(驴抗鼠ASIC1a,1∶200),4℃缓慢摇振孵育过夜。用TBST洗膜3次,每次15 min。加入羊抗驴二抗(1∶5 000),4℃缓慢摇振孵育90 min。TBST洗膜3次,每次15 min。ECL显色,在暗房中用胶片曝光,用Quantity One对灰度值进行分析。
1.3统计学处理
2 结果
2.1头痛行为学
与造模后的0~30 min相比,30~60 min内pH7.4组、pH6.0组、阿米洛利治疗组和PcTx1治疗组挠头次数均呈上升趋势。在造模后1 h内pH6.0组的挠头次数明显要多于pH7.4组(P<0.01),阿米洛利治疗组和PcTx1治疗组则明显少于其他两组(P<0.01),见图1。
2.2脑干c-fos的表达
免疫组化结果显示,与相应时间段pH7.4组相比,pH6.0组的小鼠脑干中三叉神经脊束核尾侧亚核内的c-fos免疫反应阳性细胞数均明显增多(P<0.01);阿米洛利治疗组和PcTx1治疗组与pH6.0组相比,相应部位c-fos免疫反应阳性细胞数明显减少(P<0.01),见图2。

图1 酸诱导偏头痛小鼠模型行为学
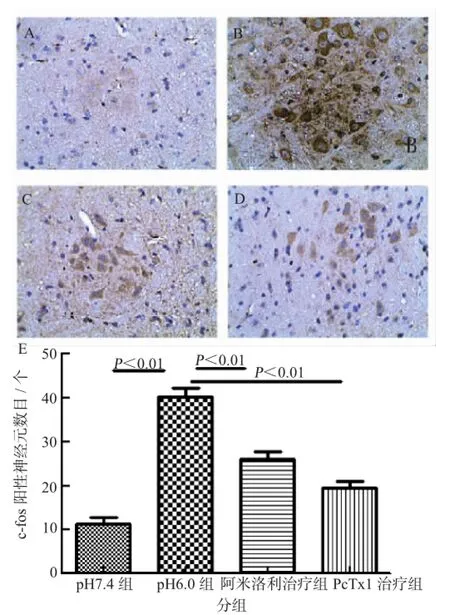
图2 c-fos阳性表达(免疫组化染色,×40)
2.3脑干ASIC1a的表达
Western blotting显示,pH7.4组、pH6.0组、阿米洛利治疗组和PcTx1治疗组的ASIC1a表达分别为(0.34±0.01)、(0.40±0.01)、(0.25±0.03)和(0.07±0.01)。与pH7.4组相比,pH6.0组的ASIC1a表达较高(P< 0.05);阿米洛利治疗组、PcTx1治疗组与pH6.0组相比,ASIC1a表达均明显下调(P<0.01),见图3。

图3 脑干中ASICla蛋白表达水平
3 讨论
ASICs是一种配体门控型离子通道,属于上皮钠离子通道/退化蛋白超家族(epithelial Na+channel/ degenerin,ENaC/DEG)成员,由4种编码酸敏感离子通道基因共编码6种ASICs亚基蛋白,即ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3和ASIC4。Krishtal和Pidoplichko[6]于1980年发现pH值骤降可引起大鼠三叉神经元产生钠离子传导,由此提出ASICs的概念和体内存在“质子受体”的理论[7]。由于这种现象与酸中毒具有极强的联系,故推断该反应过程可能与疼痛相关[8]。经30余年的研究,Yan等[9]不仅确定ASICs在三叉神经感受伤害中的作用,并证实酸碱依赖所诱发的硬脑膜传入纤维激活为炎症条件下被敏化。这些研究均提示ASICs在偏头痛的发病过程中发挥重要作用,且为主要中介物。因此,人们对ASICs有了新的认识,并为寻找有效治疗偏头痛提出了一个新的研究方向。
另有研究显示,约有80%的硬脑膜传入纤维表达ASICs免疫标志[9,10],酸性溶液在清醒动物硬脑膜上的应用通过激活ASICs引起偏头痛相关的疼痛行为,表明细胞外液轻微的酸碱度变化即能够通过激活ASICs而直接激发硬脑膜传入纤维[11]。笔者对酸性溶液引起偏头痛及ASIC1a在偏头痛中的作用进行了一系列前期研究,通过制作小鼠偏头痛模型,观察小鼠行为学的变化及组织学变化,发现酸性溶液使小鼠挠头次数明显增多,脑干中三叉神经脊束核尾侧亚核内c-fos表达显著增加,同时ASIC1a蛋白表达上调,提示酸性溶液能引起偏头痛,并且ASIC1a在酸诱导偏头痛中起着重要作用。
阿米洛利是ASICs非特异性阻断剂,通过阻断ASICs而引导人体伤害性感受器上酸感受器的表达,并且产生剂量依赖性抗伤害作用[12]。PcTx1是ASIC1a特异阻断剂。一项对7例严重偏头痛患者的观察性研究显示,阿米洛利可有效降低患者(4例)先兆症状并改善头痛程度[13]。本研究显示,阿米洛利和PcTx1处理后,偏头痛小鼠的挠头次数明显减少,脑干中三叉神经脊束核尾侧亚核内c-fos表达显著减少,同时ASIC1a蛋白表达也明显下调,这说明,ASICs阻断剂通过阻断ASICs来减少偏头痛的发作。
总之,ASICs阻断剂可以减少偏头痛的发作,而这种作用与ASICs有关,为偏头痛的治疗提供了新的方向。
[1]陈娟,黄淼,瞿昌华,等.湖北恩施土家族地区偏头痛患者经颅多普勒分析[J].神经损伤与功能重建,2015,5:444-463.
[2]Headache Classification Committee of the International Headache Society(IHS).The International Classification of Headache Disorders,3rd edition(beta version)[J].Cephalalgia,2013,33:629-808.
[3]耿晓英.氟桂利嗪联合血塞通治疗偏头痛的临床疗效观察[J].神经损伤与功能重建,2012,4:307-308.
[4]Rash LD.ASIC3:first the heartache,now a migraine![J].Headache, 2013,53:1204-1206.
[5]Wieseler J,Ellis A,Sprunger D,et al.A novel method for modeling facial allodynia associated with migraine in awake and freely moving rats[J].J Neurosci Methods,2010,185:236-245.
[6]Krishtal OA,Pidoplichko VI.A receptor for protons in the nerve cell membrane[J].Neuroscience,1980,5:2325-2327.
[7]Krishtal O.The ASICs:signaling molecules?Modulators?[J].Trends Neurosci,2003,26:477-483.
[8]Krishtal OA,Pidoplichko VI.A"receptor"for protons in small neurons of trigeminal ganglia:possible role in nociception[J].Neurosci Lett,1981, 24:243-246.
[9]Yan J,Wei X,Bischoff C,et al.pH-evoked dural afferent signaling is mediated by ASIC3 and is sensitized by mast cell mediators[J].Headache, 2013,53:1250-1261.
[10]Durham PL,CG Masterson.Two mechanisms involved in trigeminal CGRP release:implications for migraine treatment[J].Headache,2013,53: 67-80.
[11]Yan J,Dussor G.Ion channels and migraine[J].Headache,2014,54: 619-639.
[12]Chanda ML,Mogil JS.Sex differences in the effects of amiloride on formalin test nociception in mice[J].Am J Physiol Regul Integr Comp Physiol,2006,291:R335-R342.
[13]Holland PR,Akerman S,Andreou AP,et al.Acid-sensing ion channel 1:a novel therapeutic target for migraine with aura[J].Ann Neurol,2012, 72:559-563.
(本文编辑:王晶)
Effect of Acid-sensing Ion Channels Blocker on Acid Induced Migraine Mice Model
KANG Yu-qi1,CHEN Kang1,HE Xiao-hua2,YIN Hao1,MAO Li-wu3,LU Zu-neng1,XIAO Zhe-man1.1.Department of Neurology,Renmin Hospital,Wuhan University,Wuhan 430060,China;2.Department of Pathophysiology,School of Basic Medical Sciences,Wuhan University,Whuhan 430060,China;3.Department of Neurology,The Centre Hospital of Suizhou,Hubei 441300,China
Objective:To observe the effect of acid-sensing ion channels(ASICs)blocker on ethology and related protein expression of acid induced migraine mice model.Methods:Twenty-four mice were randomly divided into groups pH7.4,pH6.0,amiloride,PcTx1(n=6 in each group).The dura mater of the pH7.4 group was daubed by pH7.4 synthetic interstitial fluid(SIF).And the dura mater of the other three groups were daubed by pH6.0 SIF to induce headache.The groups Amiloride and PcTx1 were given amiloride or PcTx1 for treatment respectively.The number of scratching head was counted within 1 h after building model.The expressions of c-fos in the caudal spinal trigeminal nucleus(cSTN)and ASIC1a in the brain stem were observed 3 h later.Results:The number of scratching head of the pH6.0 group was obviously more than that of the pH7.4 group(P<0.01).The number of scratching head of the groups amiloride and PcTx1 were obviously less than the other two groups(P<0.01).Compared with the pH7.4 group,the number of c-fos immunoreactive positive cells of pH6.0 group was significantly increased in the caudal spinal trigeminal nucleus of mice(P<0.01).Compared with the pH6.0 group,the numbers of c-fos immunoreactive positive cells of amiloride group and PcTx1 group were significantly decreased(P<0.01). Compared with the pH7.4 group,the ASIC1a expression of pH6.0 group was higher in the brain stem of mice(P<0.05).Compared with the pH6.0 group,the ASIC1a expressions of amiloride group and PcTx1 group were significantly lower(P<0.01).Conclusion:That ASICs blocker could reduce behavior abnormalities of migraine mice model and the expression of related protein suggests ASICs involved in the mechanism of migraine.
Amiloride;PcTx1;migraine;C-fos;ASIC1a
R741;741.02
A
10.16780/j.cnki.sjssgncj.2016.01.002
1.武汉大学人民医院神经内科
武汉430060
2.武汉大学基础医学院病理生理教研室
武汉430060
3.随州市中心医院神经内科
武汉441300
基金课题
国家自然科学基金
(No.81471133,309 00459);
湖北省卫计委重点项目
(No.WJ2015MA00 7);
高等学校博士学科点专项科研基金课题
(No.200804861046);湖北省自然科学基金
(No.2014CFB734);武汉市科技局2015年应用基础研究计划项目
(No.201506010101 0047)
2015-11-03
卢祖能
lzn196480@126.
com
肖哲曼
zmxiao@whu.edu. cn
注:*为并列第一作者,#为并列通讯作者

