不同盐度海水对低盐诱导长牡蛎三倍体的影响*
陈洪发, 王昭萍❋❋, 于瑞海, 牟宗宝, 李 伟, 张 哲
(1.中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003;2.大连獐子岛渔业股份有限公司,辽宁 大连 116000)
不同盐度海水对低盐诱导长牡蛎三倍体的影响*
陈洪发1, 王昭萍1❋❋, 于瑞海1, 牟宗宝2, 李伟1, 张哲1
(1.中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003;2.大连獐子岛渔业股份有限公司,辽宁 大连 116000)
研究了环境盐度对低盐诱导长牡蛎(Crossotreagigas)三倍体的影响。在海水温度为(25±2)℃条件下,长牡蛎亲贝,经过不同盐度(22、26、30、34和38)海水培育,采取人工受精,在受精卵中出现40%~50%第一极体时,进行15min的低盐(4、6、8、10、12和14)持续诱导,然后放入不同盐度海水中进行孵化。研究表明:同一环境盐度下,随着低盐逐渐升高至环境盐度,卵裂率和孵化率均逐渐升高;与其他环境盐度相比,环境盐度为38时,卵裂率和孵化率均明显较低。当环境盐度为26、30、34和38时,在低盐为时8三倍体率最高;当环境盐度为22时,在低盐为6时三倍体率最高。当环境盐度为22、26、30、34和38时,在低盐为8时综合评价指数最高。通过双因子方差分析发现,环境盐度和低盐均对卵裂率、孵化率及三倍体率有显著影响(P<0.05)。
海水盐度;低盐;长牡蛎;三倍体
引用格式:陈洪发, 王昭萍, 于瑞海, 等. 不同盐度海水对低盐诱导长牡蛎三倍体的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 24-28.
CHEN Hong-Fa, WANG Zhao-Ping, YU Rui-Hai, et al. Effect of salinity on the induction of triploid oyster (Crossotreagigas)[J]. Periodical of Ocean University of China, 2016, 46(9): 24-28.
环境盐度是影响海水贝类正常生长代谢的一种重要环境因子。贝类是变压动物,海水盐度的改变会引起海洋贝类的一系列生理变化和代谢紊乱,甚至导致死亡[1]。但贝类可以在适应盐度范围内正常生长和发育,根据贝类适应盐度范围的大小和强弱,可以将贝类分为狭盐性和广盐性两类[2]。由于胚胎期和幼虫期的贝类是贝类生活史中最脆弱的2个重要时期,盐度的变化对贝类早期受精卵的卵裂、孵化、生长及存活尤为重要。
低盐诱导多倍体均已经在长牡蛎(Crossotreagigas)[3-4]、近江牡蛎(C.rivularis)[5]、虾夷扇贝(Patinopectenyessoensis)[6]和栉孔扇贝(Chlamysfarreri)[7]中开展研究,并对低盐的诱导机制进行了初步探讨。以上研究均在同一环境盐度下进行的,并未对环境盐度对低盐诱导三倍体的影响进行进一步探讨。长牡蛎作为广盐、广温种,在全国各沿海地区均有养殖,且各海区的盐度差异较大,相同海区的盐度在不同季节也有差异,因此,有必要对环境盐度对低盐诱导长牡蛎三倍体的影响进行研究,以期获得不同盐度海水对低盐诱导长牡蛎三倍体的影响规律。
本实验以长牡蛎作为对象,研究不同盐度海水和低盐组合对诱导长牡蛎三倍体的交互影响,探索环境盐度对低盐诱导长牡蛎三倍体的影响规律。
1 材料方法
1.1 材料
本研究于2014年5—8月在獐子岛莱州苗场(附近自然海水盐度为30±1、温度为(25±2)℃进行,所用的2龄长牡蛎,壳长为8~15cm,均来自莱州海鲜批发市场,洗刷干净,挑选活力良好的长牡蛎进行培育。首先,置于250L的水槽中暂养4~5d,均匀分成5组,其中一组的培育海水盐度为30,其余4组逐步降低和升高海水盐度,幅度为1/1d,直至盐度为22、26、34和38,置于各环境盐度的70L海水实验桶中培育10d。
1.2 精卵的获得和受精
选取符合实验要求的长牡蛎,解剖取其精卵,对不同实验盐度处理的长牡蛎,取其卵细胞和精子,精卵的清洗、浸泡、受精和孵化均在各自环境盐度中进行。具体精卵获取的实验步骤:使用牙签取出少量性腺组织,点于载玻片上的水滴上,把载玻片置于显微镜下辨雌雄以及检查卵子的质量和精子的活力;选取性腺发育良好的牡蛎,使用250目筛绢清洗卵细胞,置于盛有4L海水的15L实验桶中浸泡促熟1h,受精前弃去上清液;精液用500目筛绢网除去杂质;向卵液中按卵子∶精子=1∶5~6的比例加入精液,防止精子过多引起胚胎发育的畸形,迅速搅拌均匀,进行人工授精。在受精过程中,务必避免精卵的污染和不同实验盐度下的交叉污染。
1.3 低盐诱导
精卵混合5min后,使用300目筛绢网洗卵。对受精卵显微观察,当受精卵出现40%~50%的第一极体时,在500mL实验烧杯中,对其按照最终盐度为4、6、8、10、12和14进行低盐处理,持续处理15min,处理结束后,置于70L的各自环境盐度海水中进行孵化。
1.4 胚胎发育
保持充气,定时使用搅扒搅桶防止沉底,且及时测定卵裂率,等受精卵发育至D形幼虫时,测定孵化率,用300目筛绢筛选出D形幼虫,并取样测量幼虫的倍性。
1.5 倍性检测
以二倍体长牡蛎作对照,在样品管中加入1×10-5g/mL DAPI荧光染料1mL,经振动器震荡1~2min,制成细胞悬液,通过300目筛绢过滤置于2mL的测量管中,30min后采用Partec PAⅡ流式细胞仪(FCM)对幼虫进行倍性检测,如果浓度过大,可加入适量的DAPI进行稀释。实验药品DAPI(4',6-二脒基-2-苯基吲哚)为美国Sigma公司产品。
1.6 数据处理
卵裂率=分裂的卵数/总卵数×100%。
孵化率=D形幼虫数/受精卵数×100%。
三倍体诱导率=三倍体比例/(三倍体比例+二倍体比例)×100%。
综合评价指数(Evaluation index)=孵化率×三倍体诱导率×100%。
实验数据采用平均值±标准差(Mean±SD)表示,采用Sigmaplot 10.0软件作图,采用IBM SPSS Statistics 19.0软件进行分析统计,对实验数据的比较采用单因素方差分析(ANOVA)和交互作用的双因子方差分析,差异显著性定为P<0.05。
2 结果与分析
2.1 卵裂率和孵化率
环境盐度和低盐诱导对长牡蛎胚胎发育的影响可以通过卵裂率和孵化率反应。卵裂率(见图1a)和孵化率(见图1b)的实验结果表明,环境盐度为22、26、30、34和38对照组的卵裂率和孵化率分别为(91.6±5.7)%、(92.7±3.7)%、(92.2±4.7)%、(85.9±7.4)%、(69.3±6.9)%和(82.8±4.3)%、(92.0±6.4)%、(91.3±6.2)%、(89.4±6.9)%、(69.2±11.0)%;同一环境盐度下,随低盐逐渐升高至环境盐度,卵裂率和孵化率均逐渐升高,且低盐≥6,卵裂率和孵化率均增速减缓;同一低盐环境下,环境盐度≤30时,卵裂率和孵化率差异不明显,但环境盐度>30时,卵裂率和孵化率随着环境盐度的升高而显著下降;与其他环境盐度相比,环境盐度为38时,卵裂率和孵化率均显著降低。本实验卵裂率和孵化率的范围分别为(17.3±4.1)%~(92.7±3.7)%和(9.3±4.4)%~(92.0±6.4)%,在环境盐度和低盐都为26,卵裂率和孵化率均最高,在环境盐度为38、低盐为4时,卵裂率和孵化率均最低。环境盐度和低盐对长牡蛎卵裂率的方差分析表明,环境盐度、低盐和两者的交互作用对卵裂率和孵化率均有显著的影响(P<0.05)。
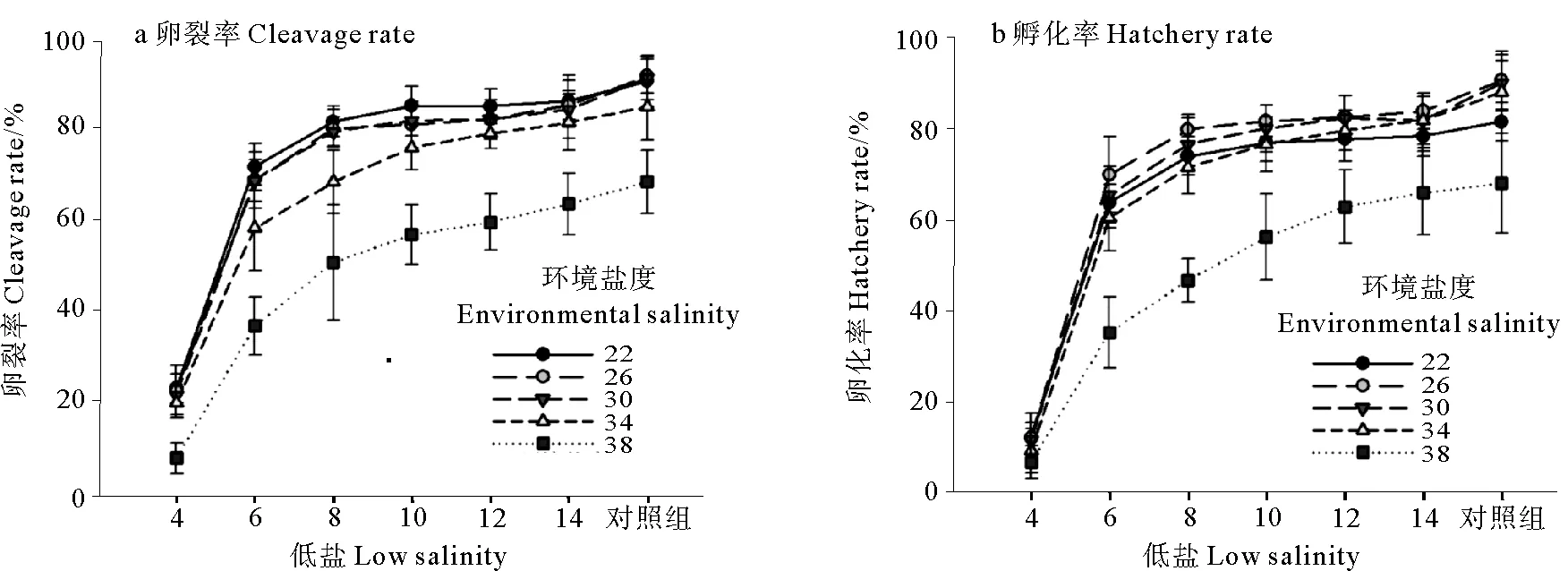
图1 环境盐度和低盐对卵裂率和孵化率的影响
2.2 三倍体率
使用流式细胞仪对长牡蛎D形幼虫的倍性检测结果如图2所示。图2a为2n对照组倍性检测结果,图2b为经过低盐处理幼虫的倍性检测结果,其三倍体率为76.92%;不同环境盐度和低盐与三倍体率的关系如图3所示。实验结果表明,环境盐度为22时,在低盐为6时三倍体率最高,为(76.49±7.45)%;在环境盐度为26、30、34、38时,三倍体率均是在8最高,分别为(76.92±8.16)%、(81.27±4.68)%、(70.63±0.55)%、(63.78±5.88)%;在环境盐度为30和低盐为8时,三倍体诱导率最高,为(81.27±4.68)%。相同环境盐度下,随着低盐升高,三倍体诱导率先升高后降低,均高于各自环境盐度下的对照组(三倍体率均为0)。

(a:2n对照组;b:环境盐度和低盐分别26和8,幼虫的三倍体率为76.92%。a:2n control; b: Salinity of environment and low are 26 and 8 respectively, triploid rate of D shape larvae is 76.92%.)
图2流式细胞仪倍性检测结果
Fig.2Ploidy level revealed by flow cytometry

图3 环境盐度和低盐对三倍体率的影响
通过对环境盐度和低盐与三倍体率关系的方差分析,结果表明,环境盐度、低盐诱导以及交互作用对三倍体率均有显著影响(P<0.05)。
2.3 综合评价指数
在不同环境盐度与低盐诱导下,综合评价指数如图4所示,实验结果表明,环境盐度为22、26、30、34和38的综合评价指数均在低盐为8时最高,分别为52.68%、62.38%、63.23%、51.35%和30.47%;低盐<8时,综合评价指数分别随着低盐的增加而升高,低盐>8时,综合评价指数分别随着低盐的增加而降低;综合评价指数均高于各自环境盐度对照组(对照组的综合评价指数均为0),其中,在本实验中,综合评价指数在环境盐度为30、低盐为8最高,为63.23%。

图4 环境盐度和低盐对综合评价指数的影响
3 讨论
许多学者在同一环境盐度下对低盐诱导三倍体进行了研究,但长牡蛎作为广温性、广盐性生物,可养殖的区域较广,遍布全国沿海各地。各海区的环境盐度不尽相同,也随季节的变化而不同,因此应该探索不同环境盐度对低盐诱导三倍体长牡蛎的影响及其影响规律。
3.1 环境盐度对低盐诱导三倍体的卵裂率、孵化率影响
在诸多影响因素中,盐度是影响海洋贝类受精及孵化的比较直接和关键的一个因子。盐度对胚胎发育的影响,国内外学者已在海湾扇贝(Argopectenirra-dians)[8]、栉孔扇贝[9]、薄片镜蛤(Dosiniacorrugate)[10]、菲律宾蛤仔(Ruditapesplilippinarum)[11]、文蛤(Meretrixmeretrix)[12]和青蛤(Cyclinasinensis)[13]等中进行了研究,发现不同的贝类种类,最适盐度范围是不同的。本研究结果表明,与较低环境盐度相比,较高环境盐度会引起长牡蛎的卵裂率和孵化率明显降低,说明在发育过程中长牡蛎胚胎耐高盐的能力较差;从实验结果可以发现,长牡蛎受精阶段和孵化阶段的适宜盐度范围约为22~34,这与吴宝铃等[1]的研究结果有一定差异,其原因可能是长牡蛎经过10d的训化,增加了其对盐度的耐受性。本实验诱导所获得的幼虫并未进行继续培养,这些幼虫在各自环境盐度下的存活及生长状况需要进一步研究。
3.2 低盐对诱导三倍体的影响
低盐诱导长牡蛎三倍体具有成本低、易操作、效果好、无毒害等优势[4],适合进行牡蛎三倍体的产业化培育。王昭萍等[6]诱导虾夷扇贝三倍体时,最佳低盐为12,孔静等[3]在自然海水温度为25℃时诱导长牡蛎三倍体,在低盐为8的综合评价指数效果最佳;张晨晨等[7]诱导栉孔扇贝三倍体在低盐为14时,三倍体率最高,因此,诱导贝类三倍体的最佳低盐随物种种类而变化。目前,对低盐诱导三倍体的作用机理和机制尚不清晰和明确,可能与低盐引起细胞能量代谢紊乱,抑制或影响微丝和微管的形成有关[6],导致细胞第一极体(PB1)、第二极体(PB2)的正常排出和正常分裂受阻,从而形成多倍体贝类。本研究结果表明,无论环境盐度如何改变,综合评价指数均在低盐为8时最佳,因此,在本实验的环境盐度下,综合评价指数的最佳低盐基本不受环境影响;除环境盐度为22,在低盐为6时三倍体率最佳之外,其余实验环境盐度均在低盐为8时,三倍体率最佳,因此,三倍体率的最佳低盐在一定程度上受环境影响。以上实验结果说明,环境盐度对卵裂率、孵化率以及三倍体率均会产生影响,但对最佳综合评价指数所对应的最佳低盐没有影响,这些实验结果的原因可能与细胞内渗压的调节有关[14-18]。
4 结语
本研究发现环境盐度对低盐诱导长牡蛎三倍体的影响是有规律的,环境盐度>26时,三倍体率均是在低盐为8最高,但环境盐度为22时,在低盐为6下三倍体率最高;不同环境盐度下的综合评价指数均在低盐为8最高。本研究确定了不同环境盐度下低盐诱导长牡蛎三倍体的规律,为在不同的养殖海区开展低盐诱导长牡蛎三倍体提供了理论和实践参考。
[1]吴宝铃. 贝类繁殖附着变态生物学[M]. 济南: 山东科学技术出版社, 1999.
Wu Baoling. Reproductive and Metamorphosis Biology of Shellfish[M]. Jinan: Shangdong Science and Technology Press, 1999.
[2]王如才, 王昭萍. 海水贝类养殖学[M]. 青岛: 中国海洋大学, 2008.
Wang Rucai, Wang Zhaoping. Science of Marine Shellfish Cultures[M]. Qingdao: Ocean University of China, 2008.
[3]孔静, 王昭萍, 于瑞海, 等. 低渗诱导太平洋牡蛎三倍体以及与其他诱导方法的比较[J]. 中国水产科学, 2011(3): 581-587.
Kong Jing, Wang Zhaoping, Yu Ruihai, et al. Triploid induction in pacific oyster (Crassostreagigas) by hypotonic treatment and comparison with other induction methods[J]. Journal of Fishery Sciences of China, 2011(3): 581-587.
[4]于瑞海, 王昭萍, 孔静, 等. 利用不同盐度诱导长牡蛎三倍体的研究[J]. 中国海洋大学学报(自然科学版), 2015, 45(1): 26-29.
Yu Ruihai, Wang Zhaoping, Kong Jing, et al. A methodological study on the induction of triploidy oyster with different salinities[J]. Journal of Ocean University of China, 2015, 45(1): 26-29.
[5]王康. 盐度诱导太平洋牡蛎和近江牡蛎三倍体的研究[D]. 青岛:中国海洋大学, 2014.
Wang Kang. The Study of Salinity Induce Triploid ofCrassostreagigasandC.ariakensis[D]. Qingdao: Ocean University of China, 2014.
[6]王昭萍, 赵婷, 于瑞海, 等. 一种新方法--低渗诱导虾夷扇贝三倍体的研究[J]. 中国海洋大学学报(自然科学版), 2009, 39(2): 193-196.
Wang Zhaoping, Zhao Ting, Yu Ruihai, et al. A new method for triploid induction by hypotonic treatment in scallopPatinopectenyessoensis[J]. Journal of Ocean University of China, 2009, 39(2): 193-196.
[7]张晨晨, 王昭萍, 于瑞海, 等. 低渗诱导栉孔扇贝三倍体及与其它方法的比较[J]. 中国海洋大学学报(自然科学版), 2010, 40(S1): 71-75.
Zhang chenchen, Wang Zhaoping, Yu Ruihai, et al. Triploid induction inChlamysfarreriby hypotonic treatment and the comparision with other treatment methods[J]. Journal of Ocean University of China. 2010, 40(S1): 71-75.
[8]Tettelbach S T, Rhodes E W. Combined effects of temperature and salinity on embryos and larvae of the Northern bay scallop,Argopectenirradiansirradians[J]. Marine Biology, 1980(3): 249-256.
[9]梁玉波, 张福绥. 温度、盐度对栉孔扇贝(Chlamysfarreri) 胚胎和幼虫的影响[J]. 海洋与湖沼, 2008(4): 334-339.
Liang Yubo, Zhang Fusui. Effects of temperature/salinity on development of embryos and larvae of scallopChlamysFarreri[J]. Oceanologia et Limnologia Sinica, 2008(4): 334-339.
[10]王成东, 聂鸿涛,闫喜武,等. 温度和盐度对薄片镜蛤孵化及幼虫生长与存活的影响[J]. 大连海洋大学学报, 2014(4): 364-368.
Wang Chengdong, Nie Hongtao, Yan Xiwu, et al. Effects of temperature and salinity on hatching larval growth and survival iin clamDosinialaminate[J]. Journal of Dalian Ocean University, 2014(4): 364-368.
[11]王军, 王志松, 董颖, 等. 盐度对菲律宾蛤仔浮游幼体存活和生长的影响[J]. 水产科学, 2003(2): 12-13.
Wang Jun, Wang Zhisong, Dong Ying, et al. The effect of salinity on growth and survival of (Ruditapesphilippinarum) floating larva [J]. Fisheries Science, 2003(2): 12-13.
[12]陈冲, 王志松, 隋锡林. 盐度对文蛤孵化及幼体存活和生长的影响[J]. 海洋科学, 1999(3): 16-19.
Chen Chong, Wang Zhisong, Sui Xilin. Effects of salinity on incubation and growth and survival of meretrix spat [J]. Marine Sciences, 1999(3): 16-19.
[13]王丹丽, 徐善良, 尤仲杰, 等. 温度和盐度对青蛤孵化及幼虫、稚贝存活与生长变态的影响[J]. 水生生物学报, 2005(5): 495-501.
Wang Danli, Xu Shanliang, You Zhongjie, et al. The effects of temperature and salinity on the incubation ofCyclinasinensisand survival, growth and metamorphosis ofC.sinensislarvae[J]. Acta Hydrobiologyica Sinica, 2005(5): 495-501.
[14]Lange R. Isosmotic intracellular regulation and euryhalinity in marine bivalves[J]. Journal of Experimental Marine Biology and Ecology, 1970, 5: 170-179.
[15]Singnoret-Brailovsky G, Maeda-Martiinez A N, ReynosoGranados T, et al. Salinity tolerance of the Catarina scallopArgopectenventricosuscircularis[J]. Journal of Shellfish Research, 1996, 15: 623-626.
[16]Damrongphol P, Jaroensastraraks P, Poolsanguan B. Effect of various medium compositions on survival and hatching rates of embryos of the giant freshwater prawn(Macrobrachiumrosenbergii) cultured in vitro[J]. Fisheries Science, 2001, 67: 64-70.
[17]Laing I. Effect of salinity on growth and survival of king scallop spat (Pectenmaximus) [J]. Aquaculture, 2002, 205: 171-181.
[18]Wang Y J, Hu M H, Wong W H, et al. Combined effects of dissolved oxygen and salinity on growth and body composition of juvenile green-lipped musselPernaviridis[J]. Journal of Shellfish Research, 2011, 30: 851-857.
责任编辑朱宝象
Effect of Salinity on the Induction of Triploid Oyster (Crossotrea gigas)
CHEN Hong-Fa1, WANG Zhao-Ping1, YU Rui-Hai1, MU Zong-Bao2, LI Wei1, ZHANG Zhe1
(1.The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China; 2.Dalian Zhangzidao Fisheries Group Limited Company, Dalian 116000, China)
Due to the change of sea area and seasons, the difference of seawater salinity was very large. Thus it is necessary to study the effect of seawater salinity on the induction of triploidCrassostreagigas.C.gigaswere cultured at (25±2)℃ and salinities (22, 26, 30, 34 and 38). The fertilized eggs by artificial insemination were induced at low salinities (4, 6, 8, 10, 12 and 14) for 15 min when 40%~50% of PB1 appeared. . The result showed that along with the increase of salinity, both the cleavage rate and the hatching rate increased. Compared with the other environmental salinity, at 38, both the cleavage rate and the hatching rate were significantly lower. When the environment salinity was 26, 30, 34 and 38, the triploid rate was the highest at 8. But when the environment salinity was 22, the triploid rate peaked at 6. When the environmental salinity was 22, 26, 30, 34 and 38, theIewas the highest if salinity was 8. And the environmental salinity was 30 and inducing salinity was 8, both the triploid rate and theIewere the highest 81.27%± 4.68% and 63. 23%, respectively. Through the factor analysis of variance, both the environmental salinity and the inducing salinity had a remarkable influence on the cleavage, the hatching and the triploid rates (P< 0.05). These findings can provide a reference to the production of triploidC.gigas.
seawater salinity; low salinity;Crassostreagigas; triploidy
国家自然科学基金项目(31172403)资助
2015-06-12;
2016-01-15
陈洪发(1988-),男,硕士生。E-mail:chenhongfa2008@163.com
❋❋通讯作者:E-mail:zpwang@ouc.edu.cn
S968.31
A
1672-5174(2016)09-024-05
10.16441/j.cnki.hdxb.20150212
Supported by the National Natural Science Foundation of China(31172403)

