不同浓度磺胺二甲嘧啶对中国对虾APND、ECOD和GST活性的影响❋
孙 铭, 翟倩倩, 常志强, 葛倩倩, 李 健,3❋❋, 赵法箴,3
(1.中国海洋大学水产学院,山东 青岛266003; 2. 中国水产科学研究院黄海水产研究所,山东 青岛 266071;3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266235)
不同浓度磺胺二甲嘧啶对中国对虾APND、ECOD和GST活性的影响❋
孙铭1,2, 翟倩倩2, 常志强2, 葛倩倩1,2, 李健2,3❋❋, 赵法箴2,3
(1.中国海洋大学水产学院,山东 青岛266003; 2. 中国水产科学研究院黄海水产研究所,山东 青岛 266071;3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266235)
为研究药物代谢酶对磺胺二甲嘧啶作用的响应及其在中国对虾代谢磺胺二甲嘧啶过程中的作用,以50、100和150 mg/kg(干重)磺胺二甲嘧啶连续投喂中国对虾5d,于投喂后的第1、2、3、4、5天和停止投喂药物的第1、2、3、4、5、7、10天取样,测定中国对虾肝胰腺、鳃和血清中的氨基比林-N-脱甲基酶(Aminopyrine-N-demethylase, APND)、7-乙氧基香豆素-O-脱乙基酶(7-ethoxycoumarin-O-Deethylase, ECOD)和谷胱甘肽还原转移酶活性(Glutathione-S-transferase, GST)的含量。研究表明:磺胺二甲嘧啶对中国对虾肝胰腺、鳃和血清中I相药物代谢酶(APND、ECOD)活性的抑制作用均具有剂量依赖性。投喂药物期间,酶活性呈逐渐下降趋势,而停止投喂后,酶活性呈逐渐上升趋势,至实验结束时均恢复至对照组水平。在整个实验周期内,高浓度组的血清GST活性呈现抑制作用,其它浓度磺胺二甲嘧啶组的各组织中GST活性呈现诱导作用。磺胺二甲嘧啶对中国对虾肝胰腺和鳃ECOD活性发生抑制作用的时间较ANPD晚。结果表明:中国对虾对磺胺二甲嘧啶的代谢,一方面通过抑制I相代谢酶的活性,抑制药物的活化,另一方面通过诱导II相代谢酶的活性,加速药物的解毒与代谢。在实际生产中,磺胺类药物通常会与增效剂甲氧苄啶合用以提高药效,应考虑磺胺二甲嘧啶对药物代谢酶的抑制作用,以减轻甲氧苄啶可能在体内的蓄积和毒效作用。
磺胺二甲嘧啶;中国对虾;氨基比林-N-脱甲基酶(APND);7-乙氧基香豆素-O-脱乙基酶(ECOD);谷胱甘肽还原转移酶(GST)
引用格式:孙铭, 翟倩倩, 常志强, 等. 不同浓度磺胺二甲嘧啶对中国对虾APND、ECOD和GST活性的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(10): 16-23.
SUN Ming, ZHAI Qian-Qian, CHANG Zhi-Qiang, et al. Effect of sulfamethazine on APND, ECOD and GST activities ofFenneropenaeuschinensis[J]. Periodical of Ocean University of China, 2016, 46(10): 16-23.
磺胺二甲嘧啶是磺胺类药物代表之一,通过干扰细菌的叶酸代谢而抑制其生长繁殖,该类药物一般采用口服给药方式在水产养殖中广泛使用[1]。但此类药物在食品动物中的残留会引起人类病原菌对其产生耐药性,它产生的毒副作用还会对人体产生直接的危害[2],因而其在可食性动物组织中的残留问题已经日益引起各个国家的关注。中国、欧盟、美国和日本制定了磺胺二甲嘧啶在水产动物中最大残留限量为100 μg/kg[3-4]。
对于水产动物而言,由于其生存环境的特殊性,影响药物在动物体内代谢的因素很多,除环境因素如水温、盐度和pH等,药物代谢酶是其体内过程的关键因素。药物在生物体内的代谢过程是其在体内清除的主要途径,主要分为两步:首先是I相代谢,其次是Ⅱ相代谢[5]。CYP450酶作为药物代谢I相酶对药物分子进行官能团化反应,使药物发生氧化、还原或水解作用,其中CYP1A和CYP2参与60%的临床药物的代谢[6]。在甲壳动物中,ECOD和APND分别是上述2种酶的主要代表[7-10]。GST是药物代谢II相反应中一类重要的药物代谢转移酶,可催化谷胱甘肽(GSH)、葡萄糖醛酸等内源性物质与I相代谢物结合,使药物排出体外[11]。
目前,有关多环芳烃在哺乳动物及农药在昆虫中的代谢机制已经明确[12-13],多环芳烃在脊椎动物体内的代谢机制也取得重大进展[14]。有关抗菌药物在水产动物体内的代谢机制目前尚未见报道。但已有学者开展了抗菌药物在水生生物体内的代谢研究,确定了药物通过调节动物体内药物代谢酶的活性而进行代谢。喹诺酮类药物如恩诺沙星和诺氟沙星等对CYP450酶具有抑制作用[15-16];氯霉素类药物如氟苯尼考对凡纳滨对虾CYP450酶具有诱导作用[17],对鲫CYP2E1具有显著的抑制作用[18];呋喃西林对中国对虾CYP450酶具有抑制作用[19];中草药黄芩苷对能够诱导中国对虾体内细胞色素P450酶活性[20];磺胺类药物磺胺二甲嘧啶对大菱鲆肝EROD活性具有显著的诱导作用[21]。
本文以磺胺二甲嘧啶为研究对象,研究了不同给药剂量下磺胺二甲嘧啶对中国对虾I相酶(APND、ECOD)及II相酶(GST)活性的影响,为研究磺胺二甲嘧啶在中国对虾体内的代谢机制提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物健康中国对虾,购于昌邑市海丰水产养殖责任有限公司,平均体重8~10 g。养殖实验于昌邑海丰水产养殖有限公司12个长方形养殖池塘进行,每个池塘2 000尾虾,且于实验前均分别养殖于各个池塘,投喂不含任何药物的基础饲料。虾池长25 m,宽10 m,水深1.5 m,底泥体积275 m3。整个实验期间每天监测水质,水温(22±2)°C,盐度23±1,pH=8.0±0.3。
1.1.2 药品和试剂磺胺二甲嘧啶,由德邦制药公司提供(含量98%);7-乙氧基香豆素(7-Ethoxycoumarin)(含量≥99%)、7-羟基香豆素(7-hydroxycoumarin)(纯度99.5%)、乙酰丙酮、氨基比林(Aminopyrine)、1-苯基-2-硫脲(PTU,98%)、考马斯亮蓝试剂盒(Coomassie Brilliant Blue)、乙二胺四乙酸二钠(EDTANa2)、α-苯甲磺酰氟(PMSF)(99%)购自Amreco公司;1,4-二硫苏糖醇(DTT)(99.5%)购自Merck公司;还原型辅酶(NADPH)(99%)、牛血清白蛋白(Bovine Serum Albumin)购自Roche公司;谷胱甘肽-S-转移酶(GST)测试盒,南京建成生物技术公司。
1.2 实验梯度设置
采用鸡蛋作为黏合剂,将磺胺二甲嘧啶药粉分别按照150 mg/kg(高剂量组)、100 mg/kg(中剂量组)和50 mg/kg(低剂量组)添加,即高剂量组按照7.5 g磺胺二甲嘧啶药粉配制1 000 g 饲料;中剂量组按照5 g磺胺二甲嘧啶药粉配制1 000 g饲料;低剂量组按照2.5 g磺胺二甲嘧啶药粉配制1 000 g饲料。基础饲料配方如下:鱼粉(45%)、花生粉(25%)、豆粕(10%)、面粉(7%)、鱼油(5%)、玉米粉(5%)、鱼膏(2%)。饲料直径约2 mm。实验分为1个空白组和3个处理组,每组3个池塘。
投喂及取样实验前一天实验组停止投喂基础饲料,实验开始后,试验组分别投喂含不同浓度磺胺二甲嘧啶的基础饲料,对照组投喂不含磺胺二甲嘧啶药粉的基础饲料,每天早晚各投喂一次,每次投喂量为对虾体重的2%[22],连续投喂5 d,后投喂基础饲料。分别于给药期间的1、2、3、4、5 d (1DW、 2DW、 3DW、 4DW、5DW)及最后一次给药后的1、2、3、4、5、7、10 d (1DPW、 2DPW、 3DPW、 4DPW、 5DPW、 7DPW、 10DPW) 取中国对虾肝胰腺和鳃。并用一次性注射器于对虾第一复节处抽取血淋巴,与抗凝血剂按照1∶1比例混合,每个时间点随机取对虾8尾,全部样品保存于液氮中待测。
1.3 样品制备
酶活测定前将血淋巴于冰上自然解冻,4 ℃ 5 000 r/min离心10 min分离血清,取上清,PBS缓冲液稀释10倍后用于酶活的测定。
S9微粒体制备肝胰腺和鳃S9微粒体的制备参照沈钧[23]等改进的方法进行,用预冷的缓冲液反复冲洗,尽可能出去血细胞,用滤纸吸干称重,并按1∶5(W/V)的比例加入预冷的匀浆缓冲液(0.1 mol/L pH=7.5 PBS,含1 mmol/L EDTANa2,1 mmol/L PMSF,1 mmol/L PTU,0.1 mmol/L DTT,15%甘油),将肝胰腺和鳃转入Precellys 24 dual多功能样品均质器匀浆,将匀浆液离心(4 ℃,13 500 g,25 min),上清液用2层已被PBS缓冲液润湿过的纱布过滤,将漂浮的脂类物质除去,即制成S9部分,分装于离心管中,置于液氮中保存。
1.4 对虾药物代谢酶活性测定
1.4.1 氨基比林-N-脱甲基酶(APND)活性测定参照Schenkman[24]等方法并适当修改,取0.1 mol/L PBS(pH=7.4)缓冲液1.7 mL,加S9蛋白悬液0.1 mL,氨基比林(24 g/L)0.1 mL,25 ℃水浴2 min后,测定管加10 mmol/L NADPH 0.1 mL,空白管加双蒸水0.1 mL,25 ℃水浴30 min。各管加15%ZnSO40.35 mL,混匀,冰浴5 min,加饱和Ba(OH)20.35 mL,混匀,室温放置5 min后5 000 r/min离心10 min。取上清2 mL,加Nash试剂2 mL,60 ℃水浴10 min,自来水冷却,紫外可见分光光度计于420 nm测定吸光值。
1.4.2 7-乙氧基香豆素-O-脱乙基酶(ECOD)活性测定ECOD活性的测定参照文献[25]改进的方法进行。反应在96孔酶标板黑板中进行。反应过程如下:取0.1 mol/L PBS匀浆缓冲液(含2 mmol/L 7-乙氧基香豆素)140 μL,加入S9部分10 μL,27 ℃孵育5 min,测定管加10 mmol/L NADPH 10 μL, 空白管加缓冲液,37 ℃水浴10 min EX=380,Em=460条件下测定其产物7-羟基香豆素浓度。
1.4.3 GST酶活测定参照谷胱甘肽-S-转移酶测定试剂盒(南京建成生物工程研究所)说明书。
1.5 数据处理
实验数据以平均值±标准差(x±SD)表示,用SPSS11.5软件、样品T检验来分析酶活数据。P<0.05为具有显著性差异,P<0.01为具有极显著性差异。
2 结果
2.1 不同浓度磺胺二甲嘧啶对中国对虾氨基比林-N-脱甲基酶(APND)活性的影响
由图1可知,与对照组相比,磺胺二甲嘧啶对中国对虾肝胰腺、鳃、血清APND抑制作用呈现一定的剂量时间关系,抑制作用整体呈现高浓度组>中浓度组>低浓度组。在投喂渔药后,低、中、高浓度组肝胰腺APND活性先受到抑制,分别于停止投喂渔药后第2、2、1天活力降到最低后逐渐上升。投喂期间第1天,低、中剂量组APND活性虽然受到抑制,但与对照组水平无显著差异,高剂量组APND活性较对照组显著抑制(P<0.05)。投喂渔药第5天,中、低剂量组APND活性呈现出显著差异(P<0.05),高剂量组呈极显著差异(P<0.01)。停止投喂后,各浓度组APND活性逐渐上升,到实验结束时均恢复至对照组水平。
投喂期间,低剂量组鳃中APND活性在第5天抑制作用最大,呈现显著性差异(P<0.05),中剂量组于第3~5天抑制作用呈现显著差异(P<0.05),高剂量组于投喂第5天抑制作用呈现极显著差异(P<0.01)。停止投喂渔药阶段,鳃APND酶活性逐渐上升,于停止投喂第5天均恢复至对照组水平。
在5DW和1DPW两个时间点,高剂量组磺胺二甲嘧啶对血清APND活性的抑制作用呈现极显著差异(P<0.01)。各剂量组血清APND活性均于停止投喂后第1天达到最低水平,于停止投喂后第7天3个剂量组血清APND活性均恢复至对照组水平。
2.2 不同浓度磺胺二甲嘧啶对中国对虾7-乙氧基香豆素-O-脱乙基酶(ECOD)活性的影响
由图2可知,与对照组相比,磺胺二甲嘧啶对肝胰腺、鳃和血清ECOD活性的抑制作用亦呈现剂量时间效应关系。肝胰腺ECOD活性整体呈现先下降后上升的趋势,低、中剂量组于停止投喂药物第1天对肝胰腺ECOD活性抑制作用最大,高剂量组对ECOD活性抑制作用于投药第5天达到最大值。于停止投喂渔药第5天各处理组肝胰腺ECOD活性均恢复至对照组水平。
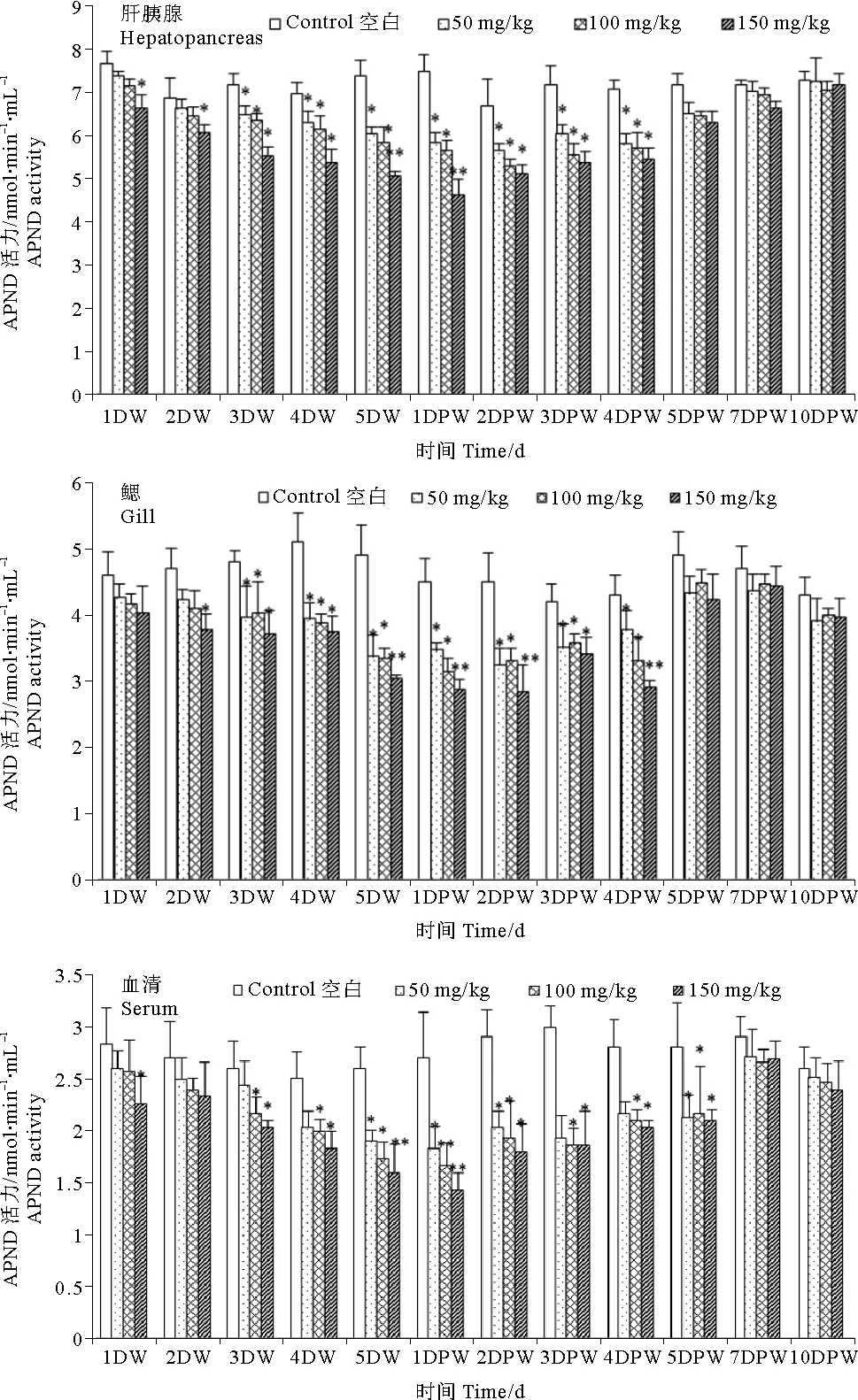
(*表示与对照组相比差异显著(P<0.05),**表示与对照组相比差异极显著(P<0.01)。Asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.05), double asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.01).)
图1不同浓度磺胺二甲嘧啶对中国 对虾肝胰腺、鳃、血清APND活性的影响
Fig.1Effects of sulfamethazine on the activities of APND in hepatopancreas,gill and serum
鳃中ECOD活性显著降低,于停药后第1天达到最小值后呈现上升趋势。4DW至4DPW,高剂量组磺胺二甲嘧啶对鳃ECOD活性具有显著抑制作用(P<0.05),中剂量组仅在4DW、2DPW和3DPW三个时间点呈现显著性抑制作用(P<0.05),于实验结束时恢复至对照组水平。低剂量组,磺胺二甲嘧啶对鳃ECOD活性虽表现出抑制作用,但于整个实验期间未出现显著性差异。
投喂渔药第1天,低剂量组和中剂量组磺胺二甲嘧啶对血清ECOD活性具有显著的抑制作用(P<0.05)。低、中剂量组于停止投喂渔药第2天血清ECOD活性达到最低值,高剂量组于停止投喂渔药第1天血清ECOD活性达到最低值。
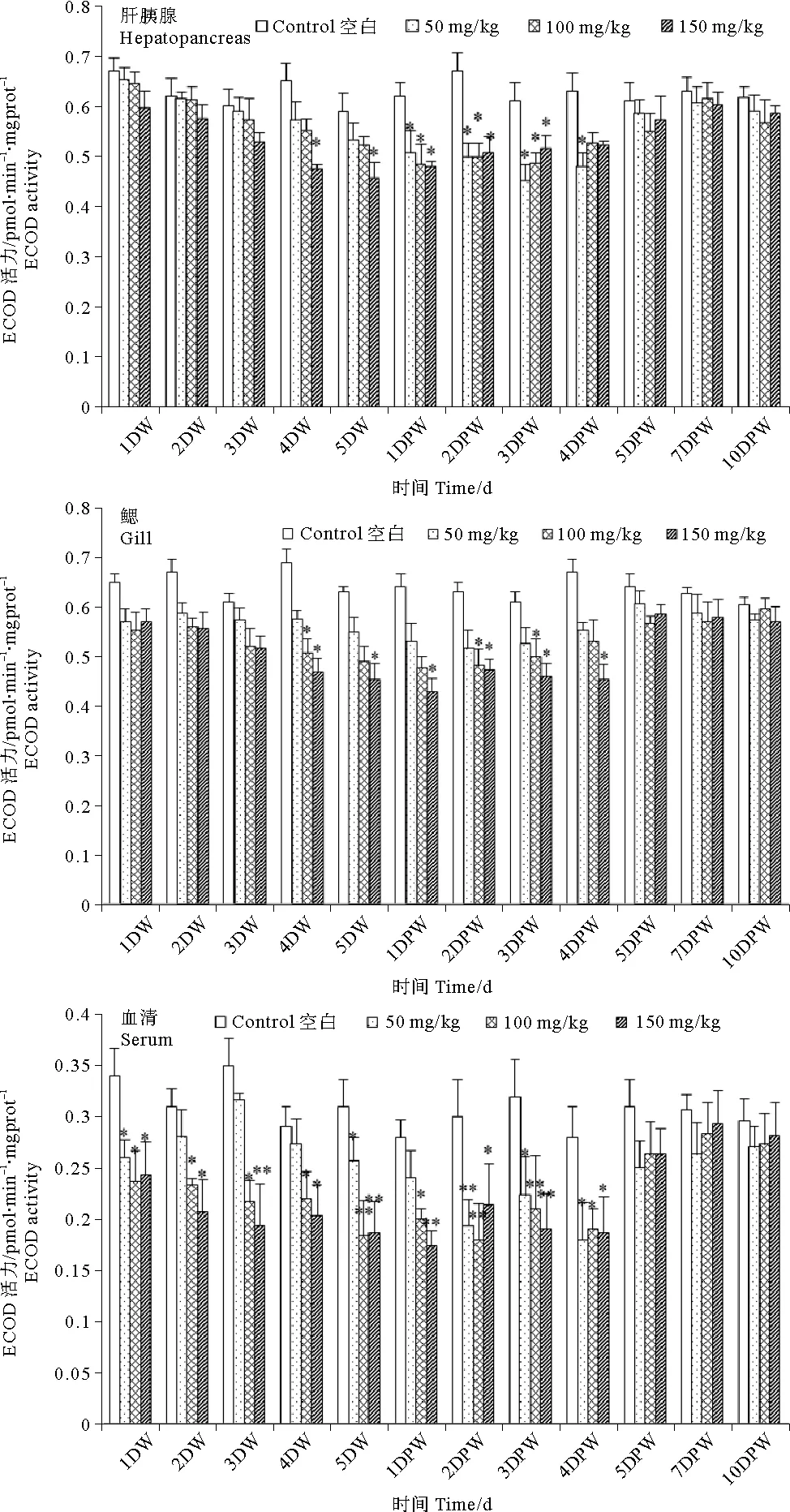
(*表示与对照组相比差异显著(P<0.05);**表示与对照组相比差异极显著(P<0.01)。Asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.05); Double asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.01).)
图2不同浓度磺胺二甲嘧啶对中国 对虾肝胰腺、鳃、血清ECOD活性的影响
Fig.2Effects of sulfamethazine on the activities of ECOD in hepatopancreas,gill and serum
2.3 不同浓度磺胺二甲嘧啶对中国对虾谷胱甘肽-S-转移酶(GST)活性的影响
由图3可知,3个剂量磺胺二甲嘧啶暴露后,与对照组相比,肝胰腺和鳃GST活性均被诱导,且呈现先升高后降低的趋势,血清GST活性则表现出不同的趋势。肝胰腺GST活性均于停药后第1天达到最高值,分别是对照组的1.47、1.67和2.18倍,具有明显的剂量效应关系。低剂量组于4DW与4DPW期间,与对照组相比均具有显著性差异(P<0.05),中剂量组于3DW与4DPW期间对GST的诱导作用与对照组相比具有显著差异(P<0.05),高剂量组于4DW与3DPW期间对GST的诱导作用与对照组相比具有极显著差异(P<0.01)。至实验结束时,各剂量组GST活性恢复至对照组水平。

(*表示与对照组相比差异显著(P<0.05);**表示与对照组相比差异极显著(P<0.01)。Asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.05); Bouble asterisks indicate the significant differences between the sulfamethazine treatments and control (P<0.01)
图3不同浓度磺胺二甲嘧啶对中国 对虾肝胰腺、鳃、血清GST活性的影响
Fig.3Effects of sulfamethazine on the activities of GST in hepatopancreas,gill and serum
低剂量组作用下,鳃中GST活力呈先上升后下降的趋势,投喂渔药第5天,GST活力呈现显著性诱导(P<0.05)。中剂量组,GST活力亦呈现先上升后下降趋势,投喂渔药第5天至停止投喂渔药第3天均呈显著性诱导(P<0.05)。高剂量组,GST活力变化与低、中剂量组相似,于停止投喂渔药后第2天达到最高水平,随后呈下降趋势。实验结束时,各剂量组GST活性恢复至对照组水平。
血清GST活性在低剂量组磺胺二甲嘧啶作用下,于投喂渔药第3、4天高于对照组水平,第4天达到最高值,是对照组的1.15倍,随后其他各时间点均低于对照组水平,整体呈现先升高再降低的趋势。中剂量组血清GST活性变化趋势与低剂量组相似,投喂渔药前2天低于对照组,第3天至停止投喂渔药第1天高于对照组水平,于投喂渔药第5天达到最高值,是对照组的1.31倍,呈极显著诱导(P<0.01),随后各时间点低于对照组水平。高剂量组血清GST活性在取样各时间点均低于对照组,除投喂渔药第1、3天和停止投喂渔药第7、10天,其他各时间点均呈显著抑制作用(P<0.05)。实验结束时,各剂量组GST活性恢复至对照组水平。
3 讨论
药物进入生物体后,首先进入I相代谢过程,进行官能团化反应,被氧化成环氧化物。研究表明,细胞因子和代谢过程中活性氧的形成,可以抑制I相代谢酶的活性[26-27]。由于抗菌药物结构的的特殊性,抗菌药物的使用可能是导致生物体内活性氧含量上升的原因之一[28-29]。本研究中,磺胺二甲嘧啶作用下,I相代谢酶APND和ECOD均受到抑制。
投喂渔药后,肝胰腺APND的活性有不断降低的趋势,投喂渔药后,低中剂量组APND活性没有立刻表现出抑制作用,于投药第3天表现出显著性抑制作用(P<0.05),而高剂量组磺胺二甲嘧啶对APND活性的抑制作用早于中低剂量组,于给药1天后即表现出显著的抑制作用(P<0.05),且于投喂渔药第5天表现出极显著抑制作用(P<0.01)。在鳃和血淋巴中同样发现高剂量组APND活性受到抑制作用的时间早于低中剂量组,说明给药剂量对于APND活性具有影响。磺胺二甲嘧啶对肝胰腺和鳃ECOD活性在投喂渔药后并未立刻被显著抑制,低中剂量组于停止投喂渔药后表现出显著性抑制作用,高剂量组对ECOD活性发生显著性抑制作用的时间较低中剂量组早,可能与高剂量组磺胺二甲嘧啶在组织中的含量更高有关。磺胺二甲嘧啶对血清ECOD活性的抑制作用在投喂渔药后立刻表现出显著性差异,可能与对虾的开放式循环系统有关,且磺胺二甲嘧啶在中国对虾体内不存在“首过效应”,药物通过胃肠黏膜及毛细血管立刻进入血液循环。磺胺二甲嘧啶对中国对虾肝胰腺和鳃ECOD活性发生抑制作用的时间较ANPD晚,抑制作用随着时间的延长和药物的消除而逐渐恢复到对照组水平,这一点与李健的研究结果相似[20]。在代谢的过程中,我们推测由于I相代谢酶活性受到抑制,降低了环氧化物的生成,从而抑制了磺胺二甲嘧啶的活化[30]。而II相代谢酶GST活性被显著诱导,加速了磺胺二甲嘧啶的代谢与解毒。肝胰腺是药物积累和代谢的主要器官,在解毒过程中使得GST活性处于较高的状态。本实验中磺胺二甲嘧啶对肝胰腺GST活性的诱导作用在投喂渔药后立刻出现,且表现出了较长时间的极显著诱导作用,随后浓度逐渐下降,恢复至对照组水平。表明随着肝胰腺中磺胺二甲嘧啶含量升高,在GST的催化下,磺胺二甲嘧啶与还原型GSH发生作用,进行II相代谢。随着给药时间的延长,肝脏中蓄积的大量的磺胺二甲嘧啶使得GST酶中毒失活,导致GST活性降低。
磺胺二甲嘧啶对中国对虾APND、ECOD活性的抑制作用和对GST活性的诱导作用具有一定的时间和剂量效应,这为解释药物在动物体内的残留浓度呈剂量-效应关系提供了理论依据。我们之前的研究发现,以50、100、150 mg/kg 磺胺二甲嘧啶连续投喂中国对虾5天,中国对虾各组织中磺胺二甲嘧啶含量在投喂渔药第5天达到最高值,随后逐渐下降[31]。本实验中肝胰腺APND活性在投喂渔药第5天抑制率达到最大,血清和鳃APND活性均于停止投喂第1天抑制率达到最大,与磺胺二甲嘧啶在中国对虾体内代谢规律基本一致。我们发现在投喂渔药期间,磺胺二甲嘧啶对APND活性抑制作用增强,停止投喂渔药后,抑制作用逐渐减弱,此发现对磺胺类药物在水产养殖上的合理应用具有积极的指导意义。
除药物代谢酶的作用,药物在生物体内的代谢还受到转运蛋白共同介导,如ABC转运体及SLC转运体,在药物的摄取与外排过程中起到重要作用[32]。目前已发现呋喃西林对中国对虾ABC转运蛋白基因具有显著上调作用[19],说明在水产动物体内转运蛋白亦发挥其III相代谢作用。有必要深入研究ABC转运蛋白在磺胺二甲嘧啶的代谢过程中的作用,从而为阐明磺胺二甲嘧啶在中国对虾体内的代谢机制提供更全面的科学依据。
4 结论
本研究结果表明,机体对磺胺二甲嘧啶的代谢,一方面通过抑制I相代谢酶的活性,抑制药物的活化,另一方面通过诱导II相代谢酶的活性,加速药物的解毒与代谢。在实际生产中,磺胺类药物通常会与增效剂甲氧苄啶合用以提高药效,应考虑磺胺二甲嘧啶对药物代谢酶的抑制作用,以减轻甲氧苄啶可能在体内的蓄积和毒效作用。
[1]巢磊. 磺胺类药物在水产养殖中的应用[J]. 水利渔业, 2002, 22(3): 50-51.
Chao L. The application of sulfanamides in aquaculture[J].Reservoir Fisheries, 2002, 22(3): 50-51.
[2]常志强, 李健, 刘萍. 磺胺二甲嘧啶的危害特征[J]. 中国渔业质量与标准, 2013, 2(4): 15-20.
Chang Z Q, Li J, Liu P. Toxicological character of sulfadimidine[J]. Chinese Fishery Quality and Standards, 2013, 2(4): 15-20.
[3]孙玉增, 张世娟, 秦华伟, 等. 磺胺二甲嘧啶在黑鲪体内的药物代谢动力学和残留消除研究[J]. 中国动物检疫, 2010, 27(2): 39-41.
Sun Y Z, Zhang S J, Qin H W, et al. Pharmacokinetics and elimination of sulfamethazine in Sebastodes fuscescens[J]. China Animal Health Inspection, 2010, 27(2): 39-41.
[4]Love D C, Rodman S, Neff R A, et al. Veterinary drug residues in seafood inspected by the European Union, United States, Canada, and Japan from 2000 to 2009[J]. Environmental Science & Technology, 2011, 45(17): 7232-7240.
[5]李小彦, 李健, 张喆, 等. 黄芩苷对中国对虾细胞色素 P450 酶及谷光甘肽-S-转移酶活性的影响[J]. 中国海洋大学学报(自然科学版), 2010, 40(3): 49-53.
Li X Y, Li J, Zhang Z, et al. Effects of Baicalin on Cytochrome P450 enzymes and Glutathione S-Transferase ofFenneropenaeusChinensis[J]. Periodical of Ocean University of China, 2010, 40(3): 49-53.
[6]胡云珍, 姚彤伟. 细胞色素P4501A的研究进展[J]. 中国药学杂志, 2003, 38(4): 246-250.
Hu Y Z, Yao T W. Research progress of cytochrome P450[J]. Chinese Pharmaceutical Journal, 2003, 38(4): 246-250.
[7]James M O. Catalytic properties of cytochrome P450 in hepatopancreas of the spiny lobster, Panulirus argus[J]. Environmental Research, 1984, 14(1-4): 1-11.
[8]Zapata-Perez O, Del-Rio M, Dominguez J, et al. Preliminary studies of biochemical changes (ethoxycoumarin O-deethylase activities and vitellogenin induction) in two species of shrimp (Farfantepenaeus duorarum and Litopenaeus setiferus) from the Gulf of Mexico[J]. Ecotoxicology and Environmental Safety, 2005, 61(1): 98-104.
[9]冷欣夫. 细胞色素P450酶系的结构、功能与应用前景[M]. 北京: 科学出版社, 2001: 84-95.
Leng X F. The Structure, Function and Application of Cytochrome P450[M]. Beijing: Science Press, 2001: 84-95.
[10]James M O, Boyle S M. Cytochromes P450 in crustacea[J]. Comparative Biochemistry and Physiology Part C, 1998, 121(1-3): 157-172.
[11]任加云, 李树峰. 多氯联苯(PCB1254)对栉孔扇贝消化盲囊和腮丝EROD、GST 酶活力的影响[J]. 中国水产科学, 2008, 15(2): 342-346.
Ren J Y, Li S F. Effects of polychlorinated biphenyls 1254 (PCB1254) on two enzyme activity of biotransformation in digestive gland and gills of scallopChlamysferrari[J]. Journal of Fishery Sciences of China, 2008, 15(2): 342-346.
[12]Beaucham P C, Fridovich I. Superoxide dismutase: Improved assays and an assay applicable to acrylamidegels[J]. Analytical Biochemistry, 1971, 44(1): 276-287.
[13]李亚红. 昆虫谷胱甘肽硫转移酶农药解毒与内源代谢研究进展[J]. 山西大同大学学报(自然科学版), 2014, 30(4): 49-51.
Li Y H. The Progress in the research of insect GST on insecticide detoxification and endogenous metabolism[J]. Journal of Shanxi Datong University(Natural Science Edition), 2014, 30(4): 49-51.
[14]Mimura J, Fujii-Kuriyama Y. Functional role of AhR in the expression of toxic effects by TCDD[J]. Biochimica et Biophysica Acta, 2003, 1619: 263-268.
[15]张喆, 李健, 陈萍, 等. 诺氟沙星对中国明对虾鳃和血清 ECOD, APND 和 GST 活性的影响[J]. 中国水产科学, 2012, 19(3): 514-520.
Zhang Z, Li J, Chen P, et al. Effects of norfloxacin on gill and serum ECOD, APND and GST activity inFenneropeneasChinensis[J]. Journal of Fishery Sciences of China, 2012, 19(3): 514-520.
[16]卢彤岩, 陈琛, 李兆戊, 等. 恩诺沙星对2 种鲟细胞色素P450活性影响的比较研究[J]. 中国农学通报, 2011, 27(20): 87-91.
Lu T Y, Chen C, Li Z W, et al. A comparison study on the effects of enrofloxacin on the cytochrome P450 enzyme activities in two kinds of sturgeons[J]. Chinese Agricultural Science Bulletin, 2011, 27(20): 87-91.
[17]Ren X Y, Pan L Q, Wang L. Tissue distribution, elimination of florfenicol and its effect on metabolic enzymes and related genes expression in the white shrimpLitopenaeus vannameifollowing oral administration[J]. Aquaculture Research, 2014, 47(5): 1584-1595.
[18]陈大健. 鲫鱼肝微粒体细胞色素 P450 酶系的初步研究 [D]. 南京: 南京农业大学, 2006.
Chen D J. A Preliminary Study on the Hepatic Microsomal Cytochrome 450 inCARASSIUSAURATUS[D]. Nanjing: Nanjing Agricultural University, 2006.
[19]李东利. 呋喃西林代谢物在中国对虾体内残留消除规律及其对相关药酶和基因影响的研究[D]. 上海: 上海海洋大学, 2015.
Li D L. Residue and Elimination of Nitrofurazone Associated its Effects on Drug Metabolic Enzymes and Transporter Proteins inFenneropenaeusChinensis[D]. Shanghai: Shanghai Ocean University, 2015.
[20]李健, 梁俊平, 李小彦, 等. 黄芩苷在中国对虾体内对诺氟沙星消除及细胞色素 P450酶的影响[J]. 海洋科学, 2012, 36(3): 81-88.
Li J, Liang J P, Li X Y, et al. Effects of Baicalin on the Elimination of Norfloxacin and Activity of CYP450 Enzymes inFenneropenaeuschinensis[J]. Marine Sciences, 2012, 36(3): 81-88.
[21]孙爱荣. 噁喹酸, 环丙沙星和磺胺二甲嘧啶在大菱鲆体内的药代动力学及其代谢酶基因 CYP3A 的克隆与表达分析[D]. 上海: 上海海洋大学, 2012.
Sun A R. Pharmacokinetics of Oxolinic Acid, Ciprofloxacin, Sulfamethazine in Turbot and Molecular Cloning and Expression Analysis of Its Cytochrome P450 3A Gene[D]. Shanghai: Shanghai Ocean University, 2012.
[22]农业部编委会. 渔药手册[M]. 北京:中国农业出版社, 2005:196.
Agriculture Department Compiling Committee ADCC. Handbook of Fishery Drugs [M]. Beijing: China Agriculture Press, 2005: 196.
[23]沈钧, 徐佩佩. 肝脏中细胞色素 P450 测定方法的改进[J]. 工业卫生与职业病, 1997, 23(4): 236-238.
Shen J, Xu P P. The improvement of detection method of cytochrome P450 in liver[J]. Industrial Health and Occupational Diseases, 1997, 23(4): 236-238.
[24]Schenkman J B, Remmer H, Estabrook R W. Spectral studies of drug interaction with hepatic microsomal cytochrome[J]. Molecular Pharmacology, 1967, 3(2): 113-123.
[25]Oberdörster E, Brouwer M, Hoexum-Brouwer T, et al. Long-term pyrene exposure of grass shrimp, palaemonetes pugio, affectsMolting and reproduction of exposed males and offspring of exposed females[J]. Environmental Health Perspectives, 2000, 108(7): 641-646.
[26]Charles W, Barker J B F, David S P. Down-regulation of P4501A1 and P4501A2 mRNA Expression in Isolated Hepatocytes by Oxidative Stress[J]. The Journal of Biological Chemistry, 1994, 269(6): 3985-3990.
[27]Charles W, Barker J B F, David S P. Interleukin-1β Suppresses the Induction of P4501A1 and P4501A2 mRNAs in Isolated Hepatocytes[J]. The Journal of Biological Chemistry,1992, 267(12): 8050-8055.
[28]Farombi E O, Akanni O O, Emerole G O. Antioxidant and scavenging activities of flavonoid extract (kolaviron) of Garcinia kola seeds[J]. Pharmaceutical Biology, 2002, 40(2): 107-116.
[29]Holt P S. Effects of induced moulting on immune responses of hens[J]. Poultry Science, 1992, 33: 165-175.
[30]Chan H T, Chan C, Ho J W. Inhibition of glycyrrhizic acid on aflatoxin Bl-induced cytotoxicity in hepatoma cells[J].Toxicology, 2003, 188(2-3): 211-217.
[31]Sun M, Li J, Zhai Q Q, et al. Environmental fate and pharmacokinetics of sulfamethazine in Fenneropenaeus chinensis shrimp production systems after oral administration[J]. Aquaculture Research, 2015, 7(5):1973-1977.doi: 10.1111/are.12803.
[32]杨波, 王静, 丛宇婷, 等. 基于蛋白质组学的药物代谢酶与转运体定量分析研究进展[J]. 药学学报, 2015, 50(6): 668-674.
Yang B, Wang J, Cong Y T, et al. Recent advances in the quantification of drug metabolizingenzymes and transporters by proteomic approach[J]. Acta Pharmaceutica Sinica, 2015, 50(6): 668-674.
责任编辑朱宝象
Effect of Sulfamethazine on APND, ECOD and GST Activities ofFenneropenaeuschinensis
SUN Ming1, 2, ZHAI Qian-Qian2, CHANG Zhi-Qiang2, GE Qian-Qian2, LI Jian2,3, ZHAO Fa-Zhen2,3
(1.College of Fisheries, Ocean University of China, Qingdao 266003, China; 2.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 3.Function Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China)
The antimicrobial sulfamethazine is widely used in aquaculture for the prevention and treatment of bacterial diseases. Residues of sulfamethazine have been detected in aquatic environments and edible tissues of aquaculture fish and shrimps at relatively low, but detectable concentrations, which is a potential risk to human health. It is necessary to understand the mechanism of its drug metabolism. In order to study the response of drug metabolism enzyme to sulfamethazine and their functions in the metabolism of sulfamethazine, the shrimp were fed with medicated feed at 50, 100 and 150 mg/kg(BW) daily, and sampled at day 1, 2, 3, 4, 5 during the drug exposure period and day 1, 2, 3, 4, 5, 7, 10 after drug exposure. Aminopyrine-N-demethylase (APND), 7-ethoxycoumarin-O-deethylase (ECOD) and glutathione-S-transferase (GST) in hepatopancrease, gill and serum were determined. Results showed that the effect of sulfamethazine on the activities of Phase I metabolism enzyme was dose-dependent. The inhibition of sulfamethazine on APND and ECOD activities increased with dose. APND and ECOD activities were significant lower than those of control, which decreased during the drug exposure while increased gradually after exposure. For APND, the significant difference was occurred earlier at 150 mg/kg(BW) than at 50 and 100 mg/kg(BW). The inhibition of sulfamethazine to APND in hepatopancrease, gill and serum was the highest at day 5 during exposure. The inhibition of sulfamethazine to ECOD in hepatopancrease and gill was not occurred immediately after the drug administration, which was occurred after drug administration at 50 and 100 mg/kg(BW) while the inhibition of sulfamethazine to ECOD in serum was occurred immediately after drug administration. Different concentrations of SM2can induce GST activity in hepatopancrease and gills significantly compared to the control in a dose-dependent manner. In 50 and 100 mg/kg(BW), GST activity in serum was inhibited on the first 2 days of the exposure followed by an induction, and peaked on day 5 of the exposure, then decreased gradually after the exposure. GST activity in serum was lower than that in control during the experimental period in 150 mg/kg(BW). There was a dose and time effect on the inhibition of APND and ECOD and induction of GST, and the time to the inhibition of ECOD was later than that of APND. These findings suggest that the metabolism of sulfamethazine inF.chinensiswas conducted by the inhibition of Phase I metabolism enzymes and the induction of Phase Ⅱ metabolism enzymes.
sulfamethazine;Fenneropeneauschinensis; aminopyrine-N-demethylase; 7-ethoxycoumarin-O-Deethylase; glutathione-S-transferase
国家虾产业技术体系专项项目(CARS-47);山东省自主创新专项项目(2013CXC80202);国家高技术研究发展计划项目(2012AA10A409);2013年中国水产科学研究院院级基本科研业务费专项项目(2013A1102);公益性行业(农业)科研专项项目(201103034)资助
2015-07-02;
2016-02-29
孙铭(1986-),女,博士生,主要从事对虾健康养殖。
❋❋通讯作者:E-mail:lijian@ysfri.ac.cn
S948; S943
A
1672-5174(2016)10-016-08
10.16441/j.cnki.hdxb.20150240
Supported by Modern Agro-industry Technology Research System (CARS-47), Independent Innovation Foundation of Shandong Province (2013CXC80202),earmarked fund for National “863” Project of China (2012AA10A409), Basal research fund of Chinese Academy of Fishery Sciences(2013A1102) and Special Fund for Agro-scientific Research in the Public Interest (201103034)

