基于关联分析发掘烟草高钾优异等位变异
樊文强,孙鑫,杨爱国,程立锐,张忠锋,任民
1中国农业科学院烟草研究所,中国农业科学院烟草遗传改良与生物技术重点开放实验室,青岛 266101;2中国农业科学院研究生院,北京 100081
基于关联分析发掘烟草高钾优异等位变异
樊文强1,2,孙鑫1,2,杨爱国1,程立锐1,张忠锋1,任民1
1中国农业科学院烟草研究所,中国农业科学院烟草遗传改良与生物技术重点开放实验室,青岛 266101;2中国农业科学院研究生院,北京 100081
采用全基因组454个SSR位点对96份烤烟种质资源进行了群体分型,获得有效等位变异1038个。NJ聚类分析将供试材料分为3个类群,群体结构分析表明,当K=3时,ΔK值最大。同时对该供试材料在4个环境进行了烟叶钾含量测定,其频率符合正态分布。采用混合线性模型(MLM),进行了标记-性状关联分析,获得11个烟草钾含量的关联标记。通过不同基因型的钾含量对比,获得5个高钾优异等位变异。为验证这些优异等位变异,本研究又利用这5个关联标记扫描了其他130份烟草种质,获得了一致的结果。表明可以利用这5个高钾等位变异对烟草种质资源进行定性筛选,促进烟草高钾种质的利用和品种选育。
烟草;高钾;关联分析;SSR标记;优异等位变异
钾是植物中重要的矿物质元素,参与了众多生理活动,例如酶的活化、气孔开闭、膜电势的维持以及渗透调节等,并且占了植物干重的10 %[1-2]。目前已从拟南芥等物种中克隆到一系列与钾积累、代谢有关的基因[3-4],可以分为2大类,即钾离子转运体和钾离子通道[5]。通常情况下,钾离子转运体蛋白承担了植物对钾的高亲和吸收转运,而钾离子通道蛋白则承担植物对钾的低亲和吸收转运[6]。烟草是典型的喜钾作物,钾也是烟草吸收最多的一种矿质元素,并对提高烟叶的燃烧性,改善烟叶品质,减少焦油产生均有重要作用[7-8],因此,常用烟叶中的钾含量作为烟叶质量评价的重要标准[9]。已有研究证实,植物钾营养效率具有可遗传性,其遗传模式既有单基因控制,又有多基因控制[10-12]。在烟草中的研究也发现,不同烟草品种对钾的吸收利用效率存在显著的遗传差异[13-14]。因此筛选钾营养高效种质,培育高钾品种是提高烟叶钾含量的一条有效途径。我国有着非常丰富的烟草种质资源,截止到2011年,国家烟草种质资源库中己编目的种质数量多达5,267份,其中烤烟为2,203份[15]。但是直接对库存种质进行烟叶钾含量的测定存在着成本高、周期长、工作量大的困难,在现有条件下无法实现。近年来分子生物学技术的发展,为利用相应的标记在实验室内开展种质资源的分子筛选提供了可能。当前已经在烟草上开展了大量的分子遗传研究,分析了烟草种质群体的遗传多样性,构建了高密度的遗传连锁图谱,对多种重要性状开展了遗传定位和QTL研究[16-20]。但利用分子标记开展烟草高钾含量种质资源筛选的研究还未见报道。为此本研究利用近年来在植物数量遗传研究中发展较为迅速的关联分析技术,在一个烤烟自然群体上开展了烟叶钾含量的标记-性状关联分析研究,筛选了关联位点的优异等位变异,探索并建立了一个能用于烟草高钾种质筛选的分子标记筛选技术。
1 材料与方法
1.1 供试群体构建
以烟草核心种质为基础,从国家烟草种质资源库中挑选了96份烤烟品种(简称群体Ⅰ,表1)用于烟草钾含量表型变异的关联分析及其分子评价模型构建。于2012~2013年分别种植在西昌市大兴乡和诸城市相州镇。田间栽培及各项管理措施均一致,于烟叶成熟期采收中部叶片,制备调制后烟叶样品。为验证本研究发掘的高钾优异等位,又筛选了130份烤烟种质(简称群体Ⅱ),其中引进种质、育成种质和地方种质分别为51份、28份和51份。于2014年种植于诸城市相州镇,其田间栽培、各项管理措施及烟叶样品制样方法均与群体Ⅰ一致。

表1 96份材料群体Tab.1 Population including 96 materials
1.2 供试群体烟叶样品的钾含量测定
烤后烟叶样品均送至农业部烟草产业产品质量监督检验测试中心进行钾含量测定。检测方法参照烟草行业标准《YC/T 217-2007》。检测的仪器为SAN++连续流动分析仪(荷兰SKALAR公司)和410型火焰光度计(英国Sherwood公司)。
1.3 供试SSR标记
本研究采用多态性SSR 位点共454个,均匀分布于烟草全基因组24个连锁群。引物序列来自烟草高密度SSR遗传连锁图谱[16]。
1.4 DNA提取
采用 TIANGENE™ Plant Genomic DNA Kit(天根生化科技(北京)有限公司)进行供试材料全基因组DNA的提取。
1.5 PCR扩增及电泳检测
PCR扩增及其产物的聚丙烯酰胺凝胶电泳参照任民[19]的方法。PCR仪为Thermal Cycler Model 9902(美国Applied Biosystems ABI公司),电泳仪电泳电源为DYY-12型(北京六一仪器厂)。用稍加改进的 NaOH 银染方法[21]对电泳后的聚丙烯酰胺凝胶进行染色显影。
1.6 数据分析
供试群体的钾含量表型变异数据采用Excel 2007进行整理,并计算平均值、变异系数等。表型变异的显著性检验采用SPSS 18.0的one-way ANOVA[22]进行。供试群体的遗传多样性分析采用PowerMarker V3.25[23]软件,并计算个体间的Nei[24]遗传距离,最后使用MEGA5.2中邻接法(neighbor-joining, NJ)构建聚类图。进行关联分析时,首先采用STRUCTURE 2.3.4软件分析供试材料的群体结构[25],其中Length of burn-in period 和 Number of MCMC Peps after Burnin 均设为 100,000 次,K设置为1-7,通过计算 ΔK值确定亚群数[26],获得Q矩阵;接下来利用SPAGeDi-1.3d[27]软件计算供试群体的家系关系Kinship矩阵;最后将Q矩阵、Kinship矩阵、SSR群体分型信息以及供试群体的钾含量表型变异数据代入TASSEL 2.1[28]软件中的混合线性模型 (mixed linear model,MLM, Q+K 模型),选择P3D计算方式和EMMA分析方法进行关联分析。
2 结果与分析
2.1 供试群体钾含量表型变异统计分析
对供试群体Ⅰ各年点烟叶钾含量进行统计分析,发现群体Ⅰ钾含量的频率分布符合正态分布(图1),Kolmogorov-Smirnov检验中Z值为0.85,P值为0.46。在相同的年份中,西昌烟叶样品的钾含量平均值均大于诸城烟叶样品的钾含量平均值,但是西昌烟叶的钾含量变异系数小于诸城相应样品的变异系数(表2)。对供试群体Ⅱ的烟叶样品钾含量统计分析表明,其频率分布同样符合正态分布,Kolmogorov-Smirnov检验的Z值为0.72,P值为0.68,平均值为1.68 %,变幅为0.89 %-2.95 %,变异系数28.2 %。
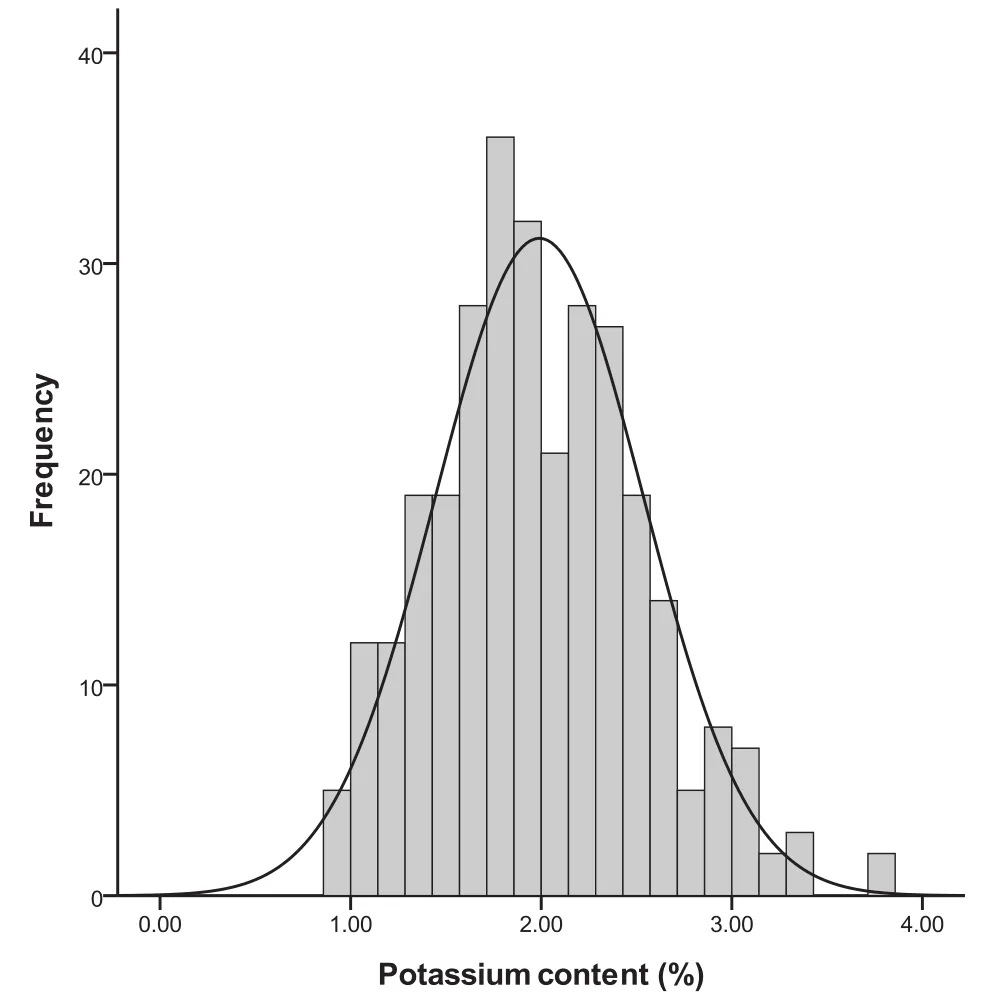
图1 96份烤烟各年点钾含量正态分布图Fig.1 Normal distribution map of potassium content of 96 materials in different years at different sites

表2 96份烤烟各年点的钾含量的统计分析Tab.2 Statistics of potassium content of 96 materials in different years at different sites
2.2 供试群体I的遗传多样性及其群体结构分析
利用分布于烟草高密度遗传图谱[16]24条连锁群中的454个多态性SSR标记对供试群体进行了标记分型。随后对各位点的等位变异频率进行了统计,过滤5 %的稀有等位变异后,有多态性的位点为417个。从上述417个位点中共检测到1038个等位变异,平均每个位点为2.5个,变幅为2~6个;标记的平均PIC为0.299,变幅为0.044~0.698。NJ聚类分析表明,群体可被划分为3个亚群(图2),随后又对供试群体Ⅰ进行了群体结构分析,从图3中可看出,当K=3时,ΔK的值最大,说明该群体存在3种遗传背景。

图2 96份材料NJ聚类图Fig.2 NJ dendrogram of 96 materials

图3 ΔK的变化趋势Fig.3 Tendency of ΔK
2.3 群体I的钾含量标记-性状关联分析
利用417个具有多态性的SSR标记及群体Ⅰ4个环境的钾含量进行关联分析,共发掘到显著关联的标记11个(-log(P-value )> 2.5,图4)。其中标记PT61367的-log(P-value)最高,为4.455,位于9号连锁群,其余标记分布在1、3、4、9、13、14、17、20、23、24号连锁群上。

图4 417个标记的Manhanttan图Fig.4 Manhanttan plot of 417 markers
2.4 高钾含量优异等位变异的筛选
对关联到的11个位点进行了各等位位点间表型差异的显著性检验和年点分布规律的统计,最终筛选到5个标记PT61367、PT51364、PT30132、PT55319、PT53362(表3)。这5个位点等位基因间的钾含量差异均有统计学意义,且在4个环境间规律一致。标记PT30312的等位变异数量最多,为5个,但只有1个等位变异可以作为高钾优异等位变异;标记PT55319有3个等位变异,其中有2个等位变异均可作为优异等位变异;其余3个标记的等位变异数量均为2,其中1个为优异等位变异。

表3 构建模型的入选标记Tab.3 Selected markers used to construct the model
2.5 高钾等位变异与群体钾含量的关系
对表3中5个位点的优异等位数量在群体Ⅰ中的分布进行了统计(表4),可将供试群体Ⅰ分成6组。随后对6组材料进行了进一步的合并和统计分析。将具有0到1个优异等位变异的材料划分为一组,简称组A;将具有2到3个优异等位变异的材料划分为第二组,简称组B;将具有4到5优异等位变异的材料划分为第三组,简称组C。利用上述分组方法对群体Ⅰ四个环境的数据进行统计检验,由图5A可知,各小组钾含量的高低顺序为组C>组B>组A。组C钾含量分别比组B、组A提高了16.7 %和31.5 %,同时各组之间钾含量的差异均有统计学意义,并且在各环境中烟叶样品钾含量的规律依然是组C>组B>组A(图5B)。上述研究表明,随着供试材料中优异等位变异位点数量的增加,供试材料烟叶钾含量的平均值也呈增加趋势。由此,可以利用上述规律进行烟草高钾种质资源的分子筛选。

表4 96份烤烟品种的优异等位数量Tab.4 Number of favorable alleles in 96 materials

图5 群体I中各小组的钾含量直方图Fig.5 Histogram of potassium content of each group in populationⅠ
2.6 高钾等位变异的烟草种质筛选验证
应用群体Ⅱ对上述钾含量分子筛选技术进行适用性验证。同样方法将群体Ⅱ分成相应的3组(图6),组A到组C供试品种的平均钾含量依次增加,分别为1.55 %、1.72 %和1.96 %,组间差异有统计学意义。组C钾含量的平均水平比组B提高了13.7 %,比组A提高了26.1%,组B又比组A提高了10.9 %。由此可知,结果与分析2.5中所描述的优异等位变异数量与群体钾含量水平的关系在1个新的种质群体中依然成立,初步证明了利用结果与分析2.4中的5个高钾等位变异进行烟草高钾种质群体筛选的可行性。

图 6 群体Ⅱ中各小组的钾含量直方图Fig.6 Histogram of potassium content of each group in population Ⅱ
3 讨论
3.1 分子标记技术在种质资源筛选中的应用
与形态学、细胞学和生化标记相比,分子标记可以直接揭示基因组上DNA的多态性,准确度高,稳定性好。同时,分子标记辅助选择还具有省时省力的特点,在动植物遗传育种研究中具有良好的应用前景[29-37]。本研究利用分子标记开展高钾烟草种质资源筛选的技术和策略,发掘了5个高钾优异等位变异:标记PT61367的101等位变异、标记PT51364的102等位变异、标记PT30132的103等位变异、标记PT55319的101&103等位变异和标记PT53362的101等位变异。同时发现供试群体烟叶钾含量有随优异等位变异数量增多而增加的趋势,并用其他的130份烤烟种质对上述趋势的有效性进行了验证。结果表明该方法有良好的稳定性,可以用于烟草高钾种质的分子筛选。
3.2 烟草高钾种质资源的分子标记辅助筛选方法
本研究发掘到的上述5个烟草高钾优异等位变异,在种质资源发掘时,可以首先利用这5个标记定性的进行分子筛选,然后再通过田间实际检测,定量每个种质的钾含量水平,从而实现提高种质资源的发掘效率,节约科研成本的目的。具体实施方法如下,首先确定对照品种,通过本研究发现,可以用烤烟品种V2和云烟2号做阳性对照,翠碧一号和革新三号做阴性对照;其次提取烤烟种质资源群体的全基因组DNA,并利用PT61367、PT51364、PT30132、PT55319、PT53362等5个标记对供试材料的DNA进行分型;最后,依据对照统计每个供试材料优异等位变异的数量,仅从中挑选具有4~5个优异等位变异的烟草种质,即为高钾烟草种质群体。
3.3 问题与展望
烟草钾含量属于典型的数量性状,表型变异由多个基因控制[38]。张海萍[34]认为在分子标记辅助育种中,多个标记的联合使用可以提高性状选择的准确性。依靠本研究所用的5个SSR标记,在群体水平上可以获得较好的选择效果。但是由于目前所获得的还仅是目标性状的关联标记,而非调控基因位点,以及标记与基因之间还存在一定的遗传距离等原因,尚不能精确的应用于个体的鉴定。为此,在下一步的研究中还需在关联位点附近深入发掘调控烟草钾含量遗传变异的基因位点,开发功能标记,进一步提升标记的选择效率。另外,在更精细的水平上,还要考虑不同生态环境与基因之间的互作关系。必要时,可随目标栽培环境不同,调整用于筛选的分子标记,以实现更优的鉴定效果。
[1] Clarkson D T, Hanson J B. The mineral nutrition of higher plants[J]. Annu Rev Plant Physio, 1980, 31(1): 239-298.
[2] Lebaudy A, Véry A A, Sentenac H. K+ channel activity in plants: Genes, regulations and functions[J]. FEBS Lett, 2007,581(12): 2357-2366.
[3] Sentenac H, Bonneaud N, Minet M, et al. Cloning and expression in yeast of a plant potassium ion transport system[J]. Science, 1992, 256(5057): 663-665.
[4] Anderson J A, Huprikar S S, Kochian L V, et al. Functional expression of a probableArabidopsis thalianapotassium channel inSaccharomyces cerevisiae[J]. Proc Natl Acad Sci U S A, 1992, 89(9): 3736-3740.
[5] Véry A A, Sentenac H. Molecular mechanisms and regulation of K + transport in higher plants[J]. Annu Rev Plant Biol,2003, 54(1): 575-603.
[6] Gierth M, Mäser P, Schroeder J I. The potassium transporterAtHAK5functions in K + deprivation-induced high-affinity K+ uptake andAKT1K+ channel contribution to K + uptake kinetics in Arabidopsis roots[J]. Plant Physiol, 2005, 137(3):1105-1114.
[7] 杨铁钊, 舒海燕, 赵献章. 我国烟草钾素营养研究现状与进展[J]. 烟草科技, 2002, (7): 39-43.Yang Tiezhao, Shu Haiyan, Zhao Xianzhang. Recent advances in tobacco potassium nutrition in China[J]. Tobacco Science &Technology, 2002, (7): 39-43. (in Chinese)
[8] 洪丽芳, 苏帆. 烤烟钾素营养的研究进展[J]. 西南农业学报, 2001, 14(2): 87-91. (Hong LiFang, Su Fan. Advances in potassium nutrition of fl ue-cured tobacco[J]. Southwest China Journal of Agricultural Sciences, 2001, 14(2): 87-91.)
[9] Leggett J E , Sims J L, Gossett D R, et al. Potassium and magnesium nutrition e ff ects on yield and chemical composition of burley tobacco leaves and smoke[J]. Can J Plant Sci, 1977,57(1): 159-166.
[10] Shea P F, Gerlo ff G C, Gabelman W H. Di ff ering efficiencies of potassium utilization in strains of Snapbeans,Phaseolus VulgarisL.[J]. Plant Soil, 1968, 28(2): 337-346.
[11] Epstein E. An inborn error of potassium metabolism in the tomato,Lycopersicon esculentum[J]. Plant Physiol, 1978,62(4): 582-585.
[12] Figdore S S, Gerloff G C, Gabelman W H. The effect of increasing NaCl levels on the potassium utilization efficiency of tomatoes grown under low-K stress[J]. Plant Soil, 1989,119(2): 295-303.
[13] 黄莺, 周梅, 黄河, 等. 基因型对烟草钾素营养的响应能力及筛选研究[J]. 中国烟草科学, 2004, (2): 30-34.Huang Ying, Zhou Mei, Huang He, et al. Study of genotype on response ability of tobacco potassium nutrition and selection[J].Chinese Tobacco Science, 2004, (2): 30-34. (in Chinese)
[14] 张喜琦, 史衍玺. 不同基因型烟草成熟期钾在植株内的迁移特征[J]. 中国烟草科学, 2004, (4): 8-12.Zhang Xiqi, Shi Yanxi. Transference characteristis of potassium in different tobacco genotypes during maturing stage[J].Chinese Tobacco Science, 2004, (4): 8-12. (in Chinese)
[15] 张兴伟. 烟草基因组计划进展篇: 4. 中国烟草种质资源平台建设[J]. 中国烟草科学, 2013, 34(4): 112-113.Zhang Xingwei. The progress of the tobacco genome project:4. Establishment of Chinese tobacco germplasm resource platform[J]. Chinese Tobacco Science, 2013, 34(4): 112-113.(in Chinese)
[16] Bindler G, Plieske J, Bakaher N, et al. A high density genetic map of tobacco (Nicotiana tabacumL.) obtained from large scale microsatellite marker development. Theor Appl Genet,2011, 123(2): 219-230.
[17] 郑吉云, 张长静, 杨爱国, 等. 烟草部分化学成分SSR关联位点发掘研究[J]. 中国农学通报, 2014, 30(13): 102-106.Zheng Jiyun, Zhang Changjing, Yang Aiguo, et al. Study on SSR loci associated with some chemical component of tobacco[J]. Chinese Agricultural Science Bulletin, 2014,30(13): 102-106. (in Chinese)
[18] 张吉顺, 王仁刚, 杨春元, 等. 国内外烤烟品种农艺性状的遗传多样性及与SRAP 标记的关联分析[J]. 作物学报,2012, 38(6): 1029-1041.Zhang Jishun, Wang Rengang, Yang Chunyuan, et al. Genetic diversity of agronomic traits and association analysis with SRAP markers in flue-cured tobacco (Nicotiana tabacum)varieties from China and abroad[J]. Acta Agronomica Sinica,2012, 38(6): 1029-1041. (in Chinese)
[19] 任民, 张长静, 蒋彩虹, 等. 基于高密度 SSR 连锁群的烟草致香物质关联分析[J]. 中国烟草学报, 2014, 20(4): 88-93.Ren Min, Zhang Changjing, Jiang Caihong, et al. Association analysis of tobacco aroma constituents based on high density SSR linkage group[J]. Acta Tabacaria Sinica, 2014, 20(4): 88-93. (in Chinese)
[20] 谭效磊, 徐秀红, 王暖春, 等. 烤烟易烤性QTL 定位分析[J]. 分子植物育种, 2012, 10(2): 201-206.Tan Xiaolei, Xu Xiuhong, Wang Nuanchun, et al. QTLs analysis of the easy curing potential in fl ue-cured tobacco[J],Molecular Plant Breeding, 2012, 10(2): 201-206. (in Chinese)
[21] 任民 , 贾兴华 , 蒋彩虹 , 等. Bassam 和 Sanguinetti 银染方法在 SRAP 和 TRAP 标记中的比较研究 [J]. 生物技术通报, 2008, (1): 113-116.Ren Min, Jia Xinghua, Jiang Caihong, et al. Comparison study of Bassam and Sanguinetti silver staining in the detecting of SRAP and TRAP[J]. Biotechnology Bulletin, 2008, (1): 113-116. (in Chinese)
[22] 张文彤, 阎洁. SPSS统计分析基础教程[M]. 北京: 高等教育出版社, 2004: 257-278.Zhang Wentong, Yan Jie. A foundation course for SPSS statistical analysis[M]. Beijing: Higher Education Press, 2004:257-278. (in Chinese)
[23] Liu K, Muse S V. PowerMarker: an integrated analysis environment for genetic marker analysis. Bioinformatics, 2005,21: 2128-2129.
[24] Nei M, Tajima F, Tateno Y. Accuracy of estimated phylogenetic trees from molecular data[J]. J Mol Evol, 1983, 19(2): 153-170.
[25] Pritchard J K, Stephens M, Donnelly P. Inference of population structure using multilocus genotype data[J]. Genetics, 2000,155(2): 945-959.
[26] Evanno G, Regnaut S, Goudet J. Detecting the number of clusters of individuals using the software STRUCTURE: a simulation study[J]. Mol Ecol, 2005, 14(8): 2611-2620.
[27] Hardy O J, Vekemans X. SPAGeDi: a versatile computer program to analyse spatial genetic structure at the individual or population levels[J]. Mol Ecol Notes, 2002, 2(4): 618-620.
[28] Bradbury P J, Zhang Z, Kroon D E, et al. TASSEL: software for association mapping of complex traits in diverse samples[J]. Bioinformatics, 2007, 23(19): 2633-2635.
[29] 张宏根, 许作鹏, 李 鹏, 等. 分子标记辅助选择改良武运粳8 号的条纹叶枯病抗性[J]. 作物学报, 2011, 37(5): 745-754.Zhang Honggen, Xu Zuopeng, Li Peng, et al. Improving the resistance of Wuyunjing 8 to rice stripe virus via molecular marker-assisted selection[J]. Acta Agronomica Sinica, 2011,37(5): 745-754. (in Chinese)
[30] 柳武革, 王丰, 金素娟, 等. 利用分子标记辅助选择聚合Pi-1和Pi-2基因改良两系不育系稻瘟病抗性[J]. 作物学报, 2008, 34(7): 1128-1136.Liu Wuge, Wang Feng, Jin Sujuan, et al. Improvement of rice blast resistance in TGMS line by pyramiding ofPi-1andPi-2through molecular marker-assisted selection[J]. Acta Agronomica Sinica, 2008, 34(7): 1128-1136. (in Chinese)
[31] Cai Zhijun, Yao Haigen, Yao Jian, et al. Screening and application of SSR markers of resistant gene against rice stripe virus[J]. Plant Diseases and Pests, 2010, 1(6): 7-11.
[32] 孔祥瑞, 王红梅, 陈伟, 等. 陆地棉黄萎病抗性的分子标记辅助选择效果[J]. 棉花学报, 2010, 22(6): 527-532.Kong Xiangrui, Wang Hongmei, Chen Wei, et al. Effect of molecular marker assisted selection to verticillium wilt resistance in upland cotton breeding[J]. Cotton Science, 2010,22(6): 527-532. (in Chinese)
[33] 陈喜文, 陈德富, 李永君. 小麦蛋白质含量分子标记辅助选择的效果分析[J]. 华北农学报, 2007, 22(2): 39-42.Chen Xiwen, Chen Defu, Li Yongjun. E ff ect of marker-assisted selection on protein content in wheat[J]. Acta Agriculturae Boreali-Sinica, 2007, 22(2): 39-42. (in Chinese)
[34] 张海萍, 常成, 游光霞, 等. 中国小麦微核心种质及地方品种籽粒休眠特性的分子标记鉴定[J]. 作物学报, 2010,36(10): 1649-1656.Zhang Haiping, Chang Cheng, You Guangxia, et al.Identification of molecular markers associated with seed dormancy in mini core collections of Chinese wheat and landraces[J]. Acta Agronomica Sinica, 2010, 36(10): 1649-1656. (in Chinese)
[35] Ribaut J M, Betrán J. Single large-scale marker-assisted selection (SLS-MAS)[J]. Mol Breeding, 1999, 5(6): 531-541.
[36] 张文龙, 杨文鹏 , 陈志伟 , 等. 玉米o16基因回交渗入o2系的分子标记辅助选择[J]. 作物学报, 2010, 36(8): 1302-1309.Zhang Wenlong, Yang Wenpeng, Chen Zhiwei, et al. Molecular marker-assisted selection for corno2introgression lines witho16gene[J]. Acta Agronomica Sinica, 2010, 36(8): 1302-1309.(in Chinese)
[37] 许勇, 张海英, 康国斌, 等. 西瓜抗枯萎病育种分子标记辅助选择的研究[J]. 遗传学报, 2000, 27(2): 151-157.Xu Yong, Zhang Haiying, Kang Guobin, et al. Studies of molecular marker-assisted-selection for resistance to fusarium wilt in watermelon(Citrullus lanatus) breeding[J]. Acta Genetica Sinica, 2000, 27(2): 151-157. (in Chinese)
[38] 尹天水, 王树会, 石磊. 烤烟烟叶钾含量的遗传分析[J].烟草科技, 2005, (5): 34-38.Yin Tianshui, Wang Shuhui, Shi Lei. Genetic analysis of potassium content in fl ue-cured tobacco leaves[J]. Tobacco Science & Technology, 2005, (5): 34-38. (in Chinese)
Exploring high-potassium favorable allele mutation of tobacco based on genome-wide association analysis
FAN Wenqiang1,2, SUN Xin1,2, YANG Aiguo1, CHENG Lirui1, ZHANG Zhongfeng1, REN Min1
1 Key Laboratory of Tobacco Genetic Improvement and Biotechnology, Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China;2 Postgraduate School, Chinese Academy of Agricultural Sciences, Beijing 100081, China
1038 e ff ective alleles were obtained by screening 96 tobacco germplasm based on 454 polymorphic SSR loci. Neighbor-Joining cluster analysis showed that there existed 3 groups in 96 lines, of which ΔK was highest when K was equal to 3. Potassium content of the 96 lines was simultaneously tested in 4 cultivated environments and its frequency was in line with normal distribution. 11 SSR markers associated with potassium content in tobacco leaves were gained through genome-wide association analysis based on mixed liner model. 5 high-potassium alleles were developed by comparing potassium content in di ff erent alleles. Another 130 tobacco lines were screened with the 5 associated SSR markers to have further vindicated the feasibility of using the 5 SSR markers to screen high-potassium germplasm and thus to improve the quality of tobacco breeding and selection.
tobacco; high-potassium; association analysis; SSR marker; favorable allele mutation
樊文强,孙鑫,杨爱国,等. 基于关联分析发掘烟草高钾优异等位变异[J]. 中国烟草学报,2016,22(2)
农业部公益性行业科研专项(201203091);烟草重要性状基因发掘及功能标记开发 (110201301008)
樊文强(1990—),在读硕士研究生,方向为烟草钾吸收转运相关基因的定位与发掘,Email:fanwenqiang2015QD@163.com
任民(1979—),博士,副研究员,研究方向为烟草分子育种,Tel: 0532-88702169,Email:renmin@caas.cn
2015-07-25
:FAN Wenqiang, SUN Xin, YANG Aiguo, et al. Exploring high-potassium favorable allele mutation of tobacco based on genome-wide association analysis[J]. Acta Tabacaria Sinica, 2016, 22(2)

