基于牛分枝杆菌PPD的猕猴全血IFN-γ释放试验观察
闵凡贵,郭 羽,罗 挺,潘金春,刘助红,黄树武,张 钰
(1. 广东省实验动物监测所,广东省实验动物重点实验室,广东广州 510663;2. 北京天坛生物制品股份有限公司,北京 100176)
基于牛分枝杆菌PPD的猕猴全血IFN-γ释放试验观察
闵凡贵1,郭 羽2,罗 挺1,潘金春1,刘助红1,黄树武1,张 钰1
(1. 广东省实验动物监测所,广东省实验动物重点实验室,广东广州 510663;2. 北京天坛生物制品股份有限公司,北京 100176)
目的 分析全血IFN-γ释放试验在猕猴分枝杆菌检测中的应用价值。方法 首先测定结核菌素试验(TST)阳性、阴性猕猴血清样本的基础IFN-γ含量。然后以PBS为对照,200 IU bovine-PPD为刺激抗原,分别与TST阴性和阳性猕猴肝素抗凝血共培养约24 h,收集血浆,测定IFN-γ含量。通过分析抗原刺激前后血浆IFN-γ含量变化和刺激指数探讨全血IFN-γ释放试验的诊断效能。结果 TST阳性猕猴血清基础IFN-γ含量明显高于TST阴性猕猴,但离散度都较大。PPD刺激前后,TST阴性猕猴血浆IFN-γ含量无明显变化,而TST阳性猕猴血浆IFN-γ含量明显升高(P<0.01)。刺激指数结果显示,TST阳性猕猴明显高于TST阴性猴(P<0.01)。ROC曲线分析表明,血浆IFN-γ含量和刺激指数均可作为全血IFN-γ释放试验的评价指标。结论 本研究基于小样本量的实验结果证实,全血IFN-γ释放试验是猕猴分枝杆菌快速诊断的有益补充方法。
猕猴,全血IFN-γ释放试验,PPD,分枝杆菌
猕猴是目前用量最大的实验非人灵长类动物,已实现了人工规模化和标准化的生产繁育。然而,猕猴的生产繁育却长期遭受到多种病原的威胁,其中,分枝杆菌病对猕猴饲养的影响巨大,以结核分枝杆菌病最为严重,由于其病原具有强烈的人兽共患性,并且群内传播和种间传播速度快,传播途径多样,控制其传播显得尤为重要,而早期筛查与及时隔离感染猴为当前最有效的控制手段[1]。
目前,实验猴结核诊断的金标方法是结核菌素试验(tuberculin skin test,TST),其次是病原学诊断,病理学(活体病理学)诊断应用相对较少。血清学诊断和分子生物学诊断方法也被用于猕猴结核诊断中,但多数仍处于研究阶段[2-4]。鉴于目前常用的诊断方法缺乏足够的准确性以及不能实现快速诊断,本研究将探讨全血IFN-γ释放试验的可行性。全血IFN-γ释放试验是基于外周血单核细胞(peripheral blood mononuclear cell,PBMC)对分支杆菌抗原刺激的记忆功能而实现的,体外抗原刺激活化的PBMC可诱导产生IFN-γ,通过测定血浆IFN-γ的增量来初步判断机体是否感染病原。在医学领域,全血IFN-γ释放试验被证实具有快速、简便等特点,降低了成本要求,成为较好的辅助诊断方法。如能将该技术充分用于实验猴的检测中,则有望大大提高结核病的诊断效能。
1 材料和方法
1.1 血清
近年来,在日常检疫和监督检测中收集到TST阳性猕猴血清30份,TST阴性猕猴血清70份。上述血清用于测定基础 IFN-γ含量。
1.2 抗凝血
广东某猕猴饲养场曾多次检出TST阳性病例,本研究收集到14例阳性猕猴肝素抗凝血,参照此前建立的方法进一步测定了PPD抗体[5-6],结果全部为阳性(A450值为1.62±0.70,cutoff值为0.217)。 在其他猕猴饲养场采集TST阴性且PPD抗体阴性猕猴的肝素抗凝血37头份。上述抗凝血用于全血IFN-γ释放试验。
1.3 抗原
Bovituber-PPD,2 mL/瓶,源于Synbiotics Corp.,批号: Lot 142574。
1.4 全血PPD刺激培养
取24 h内的抗凝血2 mL,分别加入24孔细胞培养板孔内,1 mL/孔,每个样本2孔,然后依次加入0.1 mL PBS和0.1 mL PPD(200 IU),置37℃、5% CO2培养箱孵育过夜,约24 h,收集血浆300 μL以上,-20℃保存。
1.5 血浆IFN-γ含量测定
通过流式细胞仪,采用luminex®液相芯片技术测定血浆中 IFN-γ含量,检测试剂盒源于默克密理博(Merck Millipore)。
1.6 统计学方法
测得的数据用Excel和SAS 8.01软件进行统计分析,分析方法包括随机、成对Student′sttest和ROC曲线分析等。
2 结果
2.1 血清基础IFN-γ含量
分别测定TST阴性和阳性猕猴血清样本的IFN-γ含量,检测结果见图1,分别为: 3.08±5.67 pg/mL(n=70,CV=184%)和31.88±85.46 pg/mL(n=30,CV=268%)。与TST阴性猕猴比较,TST阳性猕猴血清IFN-γ水平显著升高(unpairedt-test,P<0.01)。

图1 TST阳性和阴性实验猴血清IFN-γ含量Fig.1 Basic serum IFN-γ concentrations of TST-positive and -negative macaques
2.2 体外抗原刺激全血诱导IFN-γ产生情况

图2 PPD刺激前后血浆IFN-γ含量变化Fig.2 Changes in plasma IFN-γ pre- and post-stimulation by PPD
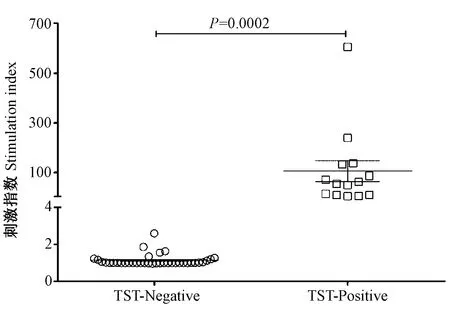
图3 PPD全血IFN-γ释放试验的刺激指数Fig.3 Stimulation indexes of PPD-based whole blood IFN-γ assay
以等体积PBS为阴性对照,分析PPD体外刺激全血诱导IFN-γ产生的情况,结果见图2。对于TST阴性猕猴,PPD刺激全血不会诱导PBMC产生IFN-γ,血浆IFN-γ含量不会显著升高(pairedt-test,P>0.05);而对于TST阳性猕猴,PPD能显著刺激PBMC产生IFN-γ,血浆IFN-γ含量显著升高(pairedt-test,P<0.01)。

图4 ROC曲线分析Fig.4 Results of ROC curves analysis
2.3 刺激指数
鉴于TST阴性猕猴基础血清IFN-γ含量分布离散度较大,通过分析抗原刺激后的绝对IFN-γ含量来判定感染状态存在一定的风险。本研究进一步探讨了全血IFN-γ释放试验的刺激指数(stimulation index,SI),即抗原刺激后和刺激前(PBS对照)血浆IFN-γ含量的比值。对TST阴性和阳性猕猴SI进行比较,结果显示,TST阳性猕猴SI明显高于TST阴性猕猴(unpairedt-test,P<0.01)。
2.4 ROC曲线分析
对TST阴性和阳性猕猴PPD刺激后血浆IFN-γ含量做ROC曲线分析,以阳性似然比最大时对应的IFN-γ含量为cutoff值,结果显示,最佳cutoff值为10.19 pg/mL,敏感性为100%,特异性为97.3%,ROC曲线下面积为0.9981(图4, A)。同样,对TST阴性和阳性猕猴的刺激指数做ROC曲线分析,显示最佳cutoff值为2.230,敏感性为100%,特异性为97.3%,ROC曲线下面积为1.0(图4, B)。以上述两种cutoff值判定,本研究选择的TST阳性猕猴均为分支杆菌感染。
3 讨论
IFN-γ体外释放试验包括全血IFN-γ释放试验和ELISPOT,与TST相比,具有敏感性和特异性高,不受TST操作上的主观因素的影响,结果更为客观可靠,检测快速,并且单次TST对IFN-γ检测对结果影响不大等优点,且该方法只需接触动物一次,有效减少了对动物的应激,具有很大的优越性;因此,IFN-γ体外释放实验被认为是TST理想的补充方法[7]。全血IFN-γ释放试验相比ELISPOT,进一步优化了试验程序,不需要分离PBMC,并且降低了对仪器和试剂的需求。
在结核病人全血IFN-γ检测方面已有商品化试剂盒(QuantiFERON-TB Gold),并得到了美国FDA和欧盟CE Mark的双重认可;在牛方面,澳大利亚于1989年率先推出商品化检测试剂盒(BovigamTM),此后被澳大利亚政府确认为根除牛结核计划的普检方法。尽管全血IFN-γ释放试验在人和牛结核检测中应用广泛,但是,其敏感性和特异性稳定性差,相关Meta分析的合并敏感性(低于80%)和特异性(低于75%)仅为中等水平[8-10],尚不能替代TST成为结核诊断的金标准,可以成为TST的有益补充。全血IFN-γ释放试验在非人灵长类动物结核诊断方面应用不多,主要原因在于试剂盒用量小,而且非人灵长类动物IFN-γ与人和牛IFN-γ不同,具有种属特异性,导致试剂盒成本增高。国外现有的少量研究和病例报道显示,全血IFN-γ释放试验在诊断非人灵长类分枝杆菌感染方面具有较高的效能[11-13];目前,国内仅有的1项初步应用报道只显示出中等的敏感性[14]。由此可见,全血IFN-γ释放试验在猕猴中的应用仍需进一步验证。我国是猕猴生产繁育大国,开展这方面研究具有重要的现实意义。
本研究首先分析了猕猴的血清基础IFN-γ水平,尽管TST阳性猕猴血清基础IFN-γ水平升高,但是离散度大,不足以成为诊断分枝杆菌感染的依据。然后,分析了PPD体外刺激对猕猴PBMC诱导产生IFN-γ的情况,结果表明,PPD刺激TST阴性猕猴不会诱导PBMC产生IFN-γ,血浆IFN-γ含量刺激前后无显著性变化;PPD刺激则可以诱导TST阳性猕猴PBMC产生大量的IFN-γ,导致血浆IFN-γ含量显著高于刺激前的测定值。进一步分析显示,PPD刺激后的IFN-γ绝对含量和SI均可作为判定分枝杆菌感染的依据,其中SI的准确性稍高(ROC曲线下面积比较)。本研究结果初步证实,全血IFN-γ释放试验是适于猕猴分枝杆菌感染诊断的有效补充手段,可以弥补TST的不足。
在刺激抗原用量方面,国外文献多数未提供PPD浓度,国内报道的PPD终浓度基本不超过20 μg/mL[15-16]。影响全血IFN-γ释放试验的因素很多,除了动物个体差异外,还包括PPD来源、用量、批次和生产厂家等[16]。本研究选择了Synbiotics Corp.生产的牛分枝杆菌PPD,纯度很高,预实验结果显示200 IU/孔和400 IU/孔无显著性差异,故选择200 IU/孔开展实验,相比国产PPD用量偏低。
本研究基于小样本量取得了较理想的实验结果,但仍处于初级研究阶段,尚需要大量临床样本来验证该方法的敏感性与特异性,尤其是TST检测假阴性样本的验证。
[1] Lerche NW, Yee JL, Capuano SV, et al. New approaches to tuberculosis surveillance in nonhuman primates [J]. ILAR J, 2008, 49(2): 170-178.
[2] 罕园园, 高家红, 罗志武, 等. 猕猴结核分枝杆菌PCR检测方法的建立与初步应用 [J]. 中国比较医学杂志, 2008, 18(9) :78-82.
[3] Centers for Disease Control and Prevention (CDC), Department of Health and Human Services (HHS). Control of communicable disease; foreign—requirements for importers of nonhuman primates (NHP). Final rule [J]. Fed Reqist, 2013, 78(32): 11521-11545.
[4] Rosenbaum M, Mendoza P, Ghersi BM, et al. Detection ofMycobacteriumtuberculosiscomplex in new world monkeys in Peru [J]. Ecohealth, 2015, 12(2): 288-297.
[5] 张钰, 黄韧, 刘香梅, 等. 猴结核病血清抗体检测方法的建立 [J]. 中国实验动物学报, 2006, 14(1): 63-66.
[6] Min FG, Zhang Y, Huang R, et al. Serum antibody responses to 10Mycobacteriumtuberculosisproteins, purified protein derivative, and old tuberculin in natural and experimental tuberculosis in rhesus monkeys [J]. Clin Vaccine Immunol, 2011.18(12): 2154-2160.
[7] Ryan TJ, Buddle BM, DeLisle GW. An evaluation of the gamma interferon test for detecting bovine tuberculosis in cattle 8 to 28 days after tuberculin skin testing [J]. Res Ver Sci, 2000, 69: 57-61.
[8] Aggarwal AN, Agarwal R, Gupta D, et al. Interferon gamma release assays for diagnosis of pleural tuberculosis: a systematic review and meta-analysis [J]. J Clin Microbiol, 2015, 53(8): 2451-2459.[9] Yu J, Wang ZJ, Chen LH, et al. Diagnostic accuracy of interferon-gamma release assays for tuberculous meningitis: a meta-analysis [J]. Int J Tuberc Lung Dis, 2016, 20(4): 494-499.
[10] Lahuerta-Marin A, Gallagher M, McBride S, et al. Should they stay, or should they go? Relative future risk of bovine tuberculosis for interferon-gamma test-positive cattle left on farms [J]. Vet Res, 2015, 46: 90.
[11] Vervenne RA, Jones SL, van Soolingen D, et al. TB diagnosis in non-human primates: comparison of two interferon-gamma assays and the skin test for identification ofMycobacteriumtuberculosisinfection [J]. Vet Immunol Immunopathol, 2004, 100(1-2): 61-71.
[12] Garcia MA, Yee J, Bouley DM, et al. Diagnosis of tuberculosis in macaques, using whole-blood in vitro interferon-gamma (PRIMAGAM) testing [J]. Comp Med, 2004, 54(1): 86-92.
[13] Parsons SD, de Villiers C, Gey van Pittius NC, et al. Detection ofMycobacteriumkansasiiinfection in a rhesus macaque (Macacamulatta) using a modified QuantiFERON-TB Gold assay [J]. Vet Immunol Immunopathol, 2010, 136(3-4): 330-334.
[14] 汪乾坤, 姜勇, 童胜涛, 等. 猕猴结核IFN-γ体外释放检测法的建立与初步应用 [J]. 中国兽医学报, 2015, 35(9): 1488-1494.
[15] 廖娟红. 新型牛结核IFN-γ体外释放检测法的建立和应用 [D]. 武汉: 华中农业大学, 2010: 38-44.
[16] 杨新婷, 杨扬, 杜凤娇, 等. 肺结核患者全血γ干扰素释放试验影响因素的探讨 [J]. 中国防痨杂志, 2013 ,35, (12 ): 1007-1012.
Performance of bovine-PPD based whole blood IFN-γ assay for rhesus macaques
MIN Fan-gui1, GUO Yu2, LUO Ting1, PAN Jin-chun1, LIU Zhu-hong1, HUANG Shu-wu1, ZHANG Yu1
(1. Guangdong Laboratory Animals Monitoring Institute, Guangdong Provincial Key Laboratory of Laboratory Animals, Guangzhou 510663, China; 2. Beijing Tiantan Biological Product Co. Ltd., Beijing 100176)
Objective To assess the potential of whole blood IFN-γ assay for diagnosing mycobacterium in rhesus macaques. Methods Firstly, basic serum IFN-γ concentrations of TST-negative and -positive rhesus macaques were detected. Then, heparinized whole blood from TST-negative and -positive rhesus macaques was incubated with PBS and 200 IU bovine-PPD (tuberculin purified protein derivative) for about 24 h, respectively. The supernatant plasma were harvested and used to determine the concentrations of IFN-γ. The results of plasma IFN-γ concentrations and stimulation index (SI) were used to analyze the diagnostic potential of the whole blood IFN-γ assay. Results The basic serum concentrations of IFN-γ for the TST-positive monkeys were significantly higher than that of the TST-negative macaques, showing a high coefficient of variation. There was no significant effect on the production of IFN-γ in the TST-negative macaques. While significantly elevation of IFN-γ concentrations was found in stimulated plasma of TST-positive macaques (P<0.01). The SI of TST-positive macaques was significantly higher than the TST-negative ones. ROC curve analysis revealed that IFN-γ concentrations and SI could be used as evaluation index of whole blood IFN-γ assay. Conclusions Based on a small sample experiment we have demonstrated that whole blood IFN-γ assay may be one possible auxiliary diagnostic method for tuberculin skin test.
Rhesus macaques;Whole blood IFN-γ assay;Tuberculin purified protein derivative, PPD;Mycobacterium; Diagnosis
广东省科技计划项目(2013B020307005;2015A030302029;2016A030303023);国家科技支撑计划(2013BAK11B01)。
闵凡贵(1980 - ),男,副研究员,硕士,研究方向: 实验动物与比较医学研究。
张钰(1970 - ),女,研究员,E-mail: zhangyugzh@hotmail.com。
R-33
A
1671-7856(2016)10-0005-04
10.3969.j.issn.1671-7856.2016.10.002
2016-03-19

