槲芪散对肝癌前病变端粒酶活性的调控作用
孟 霞,刘树红,李 霞,丰 平,卢 静,王学江
( 1. 首都医科大学实验动物部,北京 100069; 2. 首都医科大学病理生理教研室,北京 100069)
槲芪散对肝癌前病变端粒酶活性的调控作用
孟 霞1,刘树红2,李 霞2,丰 平2,卢 静1,王学江2
( 1. 首都医科大学实验动物部,北京 100069; 2. 首都医科大学病理生理教研室,北京 100069)
目的 探讨端粒酶在肝癌前病变形成和发展中的作用及方剂槲芪散(HQS)、君药槲寄生对其活性的调控机制。方法 将大鼠分为模型组、HQS大剂量组[8 g/(kg·d)]、小剂量组[4 g/(kg·d)]、槲寄生碱组[8 mg/(kg·d)] 及正常组。运用经典的Solt-Farber二步法复制大鼠肝癌前病变的模型,采用组织化学方法检测肝脏组织中γ-谷氨酰转肽酶活性的表达;免疫荧光的方法检测肝脏组织中AFP的表达;采用Quantitative Telomerase Detection Kit(QTD Kit)测定肝脏组织中端粒酶的活性;免疫组织化学方法检测肝脏组织中NF-κB P65蛋白的表达;Western blot的方法测定IκB-α在胞浆蛋白中的含量。结果 HQS和槲寄生总碱治疗后,肝脏中γ-GT阳性灶面积、AFP的阳性细胞数均较模型组明显减少(P<0.05);同时显示治疗组大鼠肝脏中NF-κB P65的阳性细胞数较模型组相比明显减少(P<0.05);治疗后IκB-α在胞浆中的蛋白含量与模型组相比有所增加,差异有显著性(P<0.05)。结论 HQS和槲寄生总碱能够抑制肝癌前病变组织端粒酶活性的表达,其作用是通过抑制凋亡相关基因NF-κB的过表达,增加IκB-α的表达,进而降低端粒酶的活性。
槲芪散;端粒酶;肝癌前病变; NF-ΚB P65;IκB-α;大鼠
由于端粒酶在恶性肿瘤中的广泛表达,将端粒酶作为靶点进行肿瘤治疗受到重视。中药通过调控端粒长度和端粒酶活性对肿瘤影响的研究也有了一定的进展。特别是中药复方可以通过对细胞异变的多阶段、多靶点干预作用,调节细胞凋亡和细胞增殖的平衡[1]。中药可通过作用于肿瘤基因以及抑制端粒酶活性等方面来诱导肿瘤细胞向正常细胞方向分化[2],从而达到预防或延缓癌变发生的目的[3]。
方剂槲芪散(HQS)是国家级名老中医钱英教授在临床应用多年的经验方,具有抗炎、逆转肝硬变的显著临床治疗作用。我们以往的实验观察到,HQS可减少肝癌前病变大鼠肝脏中γ-谷氨酰转肽酶阳性灶的数目和面积,抑制大鼠肝癌前病变灶中原癌基因的表达,阻断肝癌前病变的发生发展;HQS及其从君药槲寄生中提取的总碱和多糖可以在体外抑制肝癌细胞的增殖,促进其凋亡[4]。为探讨HQS、槲寄生总碱及多糖促进肝肿瘤细胞凋亡的机制,我们探究了端粒酶、端粒在肝癌形成过程中的作用,并观察了HQS、槲寄生总碱、多糖对端粒酶、端粒的影响,以期阐明HQS及槲寄生逆转肝癌前病变的机制。
1 材料和方法
1.1 中药HQS的制备
中药复方HQS由槲寄生、黄芪等八味中草药组成,所用中药一次备齐,经鉴定符合药典用药规定,由中日友好医院药剂科制成无糖颗粒备用,4℃保存。槲寄生总碱由北京市中医研究所提取制备。
1.2 主要试剂及仪器
羟乙基哌嗪乙硫磺酸(HEPES)、胰蛋白酶( trypsin)、噻唑蓝(MTT)、二甲基亚砜(DMSO)、乙二胺四乙酸二钠(EDTA)购自Sigma公司; Quantitative Telomerase Detection Kit (QTD Kit)为Allied Biotech, Inc。酶标仪SA1000奥地利Digiscan; Real-time PCR Bio-Rad 3000;Leica Qwin 图象分析处理系统(Leica)。
1.3 实验动物及肝癌前病变动物模型复制
实验所需动物由北京维通利华实验动物技术有限公司提供(实验动物生产许可证号:SCXK(京)2011-0011)。选用6周龄,健康、雄性Wistar大鼠50只,体重110~120 g;动物饲养于首都医科大学实验动物部屏障环境动物实验室(实验动物设施许可证号:SYXK(京)2010-0020)。
1.3.1 肝癌前病变动物模型: 采用Solt-Farber实验模型的选择程序。选用6周龄Wistar雄性大鼠,腹腔一次性注射二乙基亚硝胺(DEN)200 mg/Kg体重,作为启动剂,2周后进入选择性促进程序,即按经典术式施行大部肝切除术(PH),再饲以含0.015%二乙酰氨基芴(2-AAF)饲料5周。第7周末,所有实验大鼠禁食24 h后断颈椎处死。在每只大鼠肝脏右前叶、右后叶和尾叶规定部位取肝组织进行检测。
1.3.2 实验分组及药物处理: 实验分为5组,每组10只动物,即正常组、模型组、槲芪散大剂量(15 g/kg体重/d)治疗组、槲芪散小剂量(4g/kg体重/d)治疗组、槲寄生总碱治疗组(8 mg/kg体重/d)。除正常组外,其余各组在大部肝切除术(PH)1周后,用不同浓度槲芪散开始经胃饲给药,持续至实验结束,连续给药3周;正常组以等量生理盐水灌胃。第7周末,所有实验大鼠禁食24 h后断颈椎处死。在每只大鼠肝脏右前叶、右后叶和尾叶固定部位取肝组织,进行各种实验检测。
1.4 端粒酶的活性测定
采用Quantitative Telomerase Detection Kit(QTD Kit)进行端粒酶活性检测。取冻存的各组大鼠肝脏组织在液氮中研磨,加入lysis buffer制备肝组织悬液。阴性对照组:取25 μL的肝组织悬液上清,进行实时定量PCR检测,灭活端粒酶的活性作为阴性对照。阳性对照:取5个0.5 mL EP管,分别加入8 μL细胞裂解液,1号管加入端粒酶RNA(TSR)2 μL,2~4号管依次按照5:1稀释,使各管TSR浓度依次为0.1 amol/μL,0.02 amol/μL,0.004 amol/μL,0.0008 amol/μL, 0.00016 amol/μL。严格按照端粒酶检测试剂盒说明进行操作,上样后进行实时荧光PCR反应:变性( 30 s 95℃), 退火(30 s 60℃),延伸(30 s 72℃),循环数(35~40循环)。制作标准曲线,作为阳性对照反应的模板。用倍比稀释的TSR进行实时定量PCR检测,绘制标准曲线。根据标准曲线计算待测样品中由端粒酶催化合成的端粒重复序列的拷贝数,由此推算出端粒酶的活性。
1.5 常规方法制作病理切片
改良的Rutenberg法进行γ-GT阳性灶的组织化学染色;SABC-FITC免疫荧光方法测定大鼠肝脏组织中AFP的表达;链霉菌抗生物素蛋白-过氧化物酶连结(SP)法检测大鼠肝脏组织中NF-ΚB p65的基因蛋白表达;western blot方法检测IΚB的蛋白表达。
1.6 统计学方法
数值以mean±s表示,应用SPSS 11.5统计软件,采用F检验和χ2检验,P<0.05认为差异有统计学意义。
2 实验结果
2.1 病理变化
正常对照组,大鼠肝脏表面光滑,呈红褐色,质软,边缘锐利;模型对照组大鼠肝脏颜色浅淡,表面粗糙,出现散在的灰白色小结节,直径在1毫米左右,有的达2毫米,结节边缘界限清;治疗组较模型组相比肝脏表面点状结节明显减少,仅见少量散在小结节,肝脏颜色、质地、体积接近正常。镜下可见正常对照组肝小叶结构清晰完整,肝细胞呈多边形,肝细胞板以中央静脉为中心呈放射状排列(图1-1A);模型组肝细胞变性坏死明显,已出现较为明显的细胞增生灶,即嗜酸细胞灶、嗜碱细胞灶和透明细胞灶三种。这些病灶内肝细胞变大,有胞浆染色的改变、核亦稍大,有明显核仁,亦可见到呈核浓缩或溶解的细胞混杂其中,并可见嗜酸小体形成。增生灶细胞密集成团,对附近肝细胞并不产生压迫现象,但细胞丧失正常肝索结构,血窦不明显。(图1-1B);槲芪散治疗大、小剂量组和槲寄生总碱组肝细胞表现为部分细胞的脂肪变性、毛玻璃样变性,与模型组相比病灶数量明显减少和病变程度上有所减轻(图1-1C、1D、1E)。
2.2 γ-GT显示肝癌前病变
在正常组大鼠肝脏切片上肝细胞中几乎无γ-GT阳性灶出现,只在汇管区有少量表达(图2-2A);模型组肝组织中出现大量散在的γ-GT阳性灶,呈类圆形、棕红色,部分病灶周围肝细胞有明显的压迫现象(图2-2B)。各用药组阳性灶相对于模型组面积减少、主要集中在汇管区附近(图2-2C、2D、2E)。图3显示了槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏中γ-GT的影响,结果显示与模型组相比,HQS大、小剂量治疗组以及槲寄生总碱组都显著地减少了DEN导致的肝脏中γ-GT阳性灶的面积,以大剂量组的作用更显著。
2.3 AFP表达
正常组肝脏基本无AFP的表达(图3-A);模型组中表达明显增多,主要定位于胞浆,呈绿色荧光(图3-B);HQS大、小剂量治疗组和槲寄生总碱组中AFP的阳性细胞数明显减少(图3-C、D、E)。
2.4 端粒酶测定结果
正常组中基本无端粒酶活性的表达,模型组中端粒酶活性高表达,经治疗后端粒酶活性有所下降(图4),与模型组相比差异有统计学意义(P<0.01)。
2.5 NF-κB P65表达
正常肝脏组织中NF-κB P65基本无表达(图5-A);模型组中NF-κB P65在胞核和胞浆中表达显著增强,呈深棕褐色(图5-B),以胞核表达为主;而HQS的大小治疗组和槲寄生总碱组的大鼠肝脏中NF-κB P65在胞浆和胞核中均有表达,其中在胞核中的表达显著减弱(图5-C、D、E)结果显示NF-κB P65在HQS大小治疗组和槲寄生总碱组中的阳性细胞数与模型组相比差异有统计学意义(P<0.05)。2.6 IκB-α在胞浆中的蛋白表达
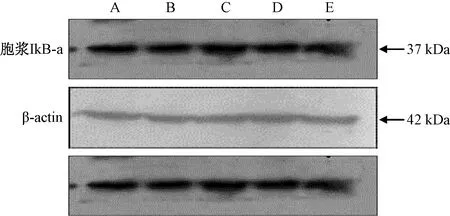
正常肝脏组织胞浆蛋白中有IκB-α蛋白的表达;模型组中IκB-α蛋白的表达有所减少,经HQS大小剂量组和槲寄生总碱组治疗后IκB-α蛋白有所增加,与模型组相比差异有统计学意义(P<0.05)(图6)。
3 讨论
癌前期肝细胞常伴有生化特性的改变和某些胚胎特性的重新获得,因此可以作为肝细胞发生癌变的标志物。肝脏组织化学染色AFP、γ-GT阳性酶变灶即为此标志物。是显示肝细胞增生病变最敏感而可靠的方法。它们在正常成年大鼠肝脏基本无活性,在癌前肝细胞增生灶中及肝癌细胞则活性增高,这是由于变异肝细胞反分化而类似胚胎期酶生成增多,同时刺激其周围的正常肝细胞使其合成增多。将它们作为癌变标志物有特异性,是实验性肝癌研究中检测癌前病变、观察癌变程度的常用指标。HQS及其君药槲寄生碱能够明显减少肝癌前病变大鼠肝脏中γ-GT阳性灶的面积和AFP阳性细胞数的表达;与模型组比较差异有显著性(P<0.005),说明该药能有效控制癌前病变的增长,对癌变过程的促癌阶段有阻断作用。这对临床上延长病人的生存时间(生存率)有较重要的意义。
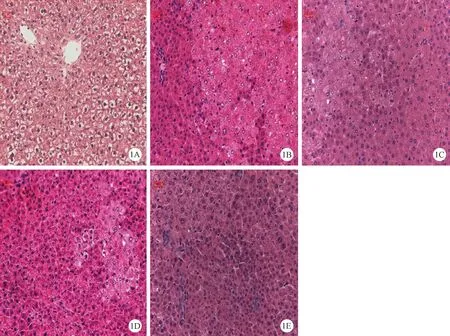
1A:正常组;1B:模型组 (DEN+2-AAF+PH); 1C:HQS大剂量治疗 [8 g/(kg·d)]; 1D:HQS小剂量疗组 [4 g/(kg·d)]; 1E:槲寄生总碱组 [8 mg/(kg·d)]. HE染色×200,图1 槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏改变。标尺=20 μmNote. IA: Normal control; IB: Model group (DEN+2-AAF+ PH)(1B); IC: High-dose HQS-treatment (8 g/kg·bw) group; ID:Low-dose HQS (4 g/kg b.w.) treatment group; IE: HQS and mistletoe alkali treatment group. Fig.1 DEN induced rat liver alterations treated with Huqi San and mistletoe alkali. HE Staning.
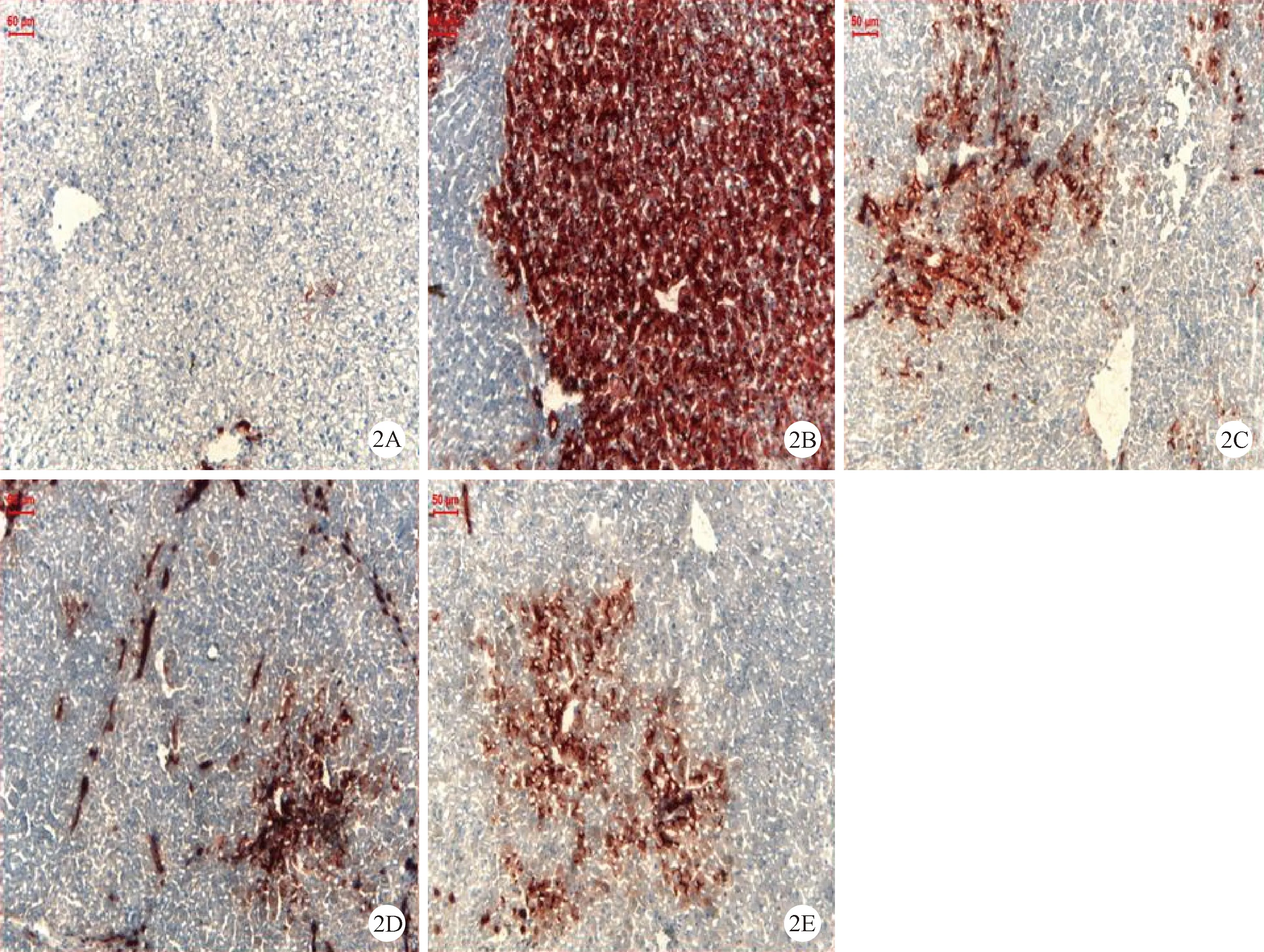
2A: 正常组,(标尺=60μm); 2B:模型组 (DEN+2-AAF+PH); 2C:HQS大剂量治疗组 [8g/(kg·d)](标尺=50μm); 2D:HQS小剂量治疗组 [4 g/(kg·d)]; 2E:槲寄生总碱组 [8 mg/(kg·d)]. ×100图2 槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏γ-GT的表达Note. 2A: Normal control; 2B: Model group (DEN+ 2-AAF+PH); 2C: High-dose HQS (8 g/kg. bw.) group; 2D: Low-dose (4 g/kg b.w.) HQS treatment group; 2E: HQS and mistletoe alkali treatment group. group. The red stained areas are the γ-GT-positive foci. For details see text.Fig.2 γ-GT expression in the rat liver tissues treated with HQS and mistletoe alkali

3A:正常组;3B:模型组(DEN+2-AAF+PH);3C:HQS大剂量治疗组[8 g/(kg·d)];3D:HQS小剂量治疗组[4 g/(kg·d)];3E:槲寄生总碱组[8 mg/(kg·d)]. 如图中所示AFP阳性表达为绿色荧光,主要定位于细胞浆,细胞核染为蓝色。×200图3 槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏中AFP的表达Note. 3A: Normal control; 3B: Model group (DEN+2-AAF+PH); 3C: High-dose HQS (8 g/kg b.w.)group; 3D: Low-dose HQS (4 g/kg b.wtreatment group; 3E: Mistletoe alkali treatment group.Fig.3 The expression of AFP in the DEN-induced rat liver tissues treated with HQS and mistletoe alkali. Green fluorescence indicates positive intracytoplasmic expression of AFP with blue-stained nuclei.
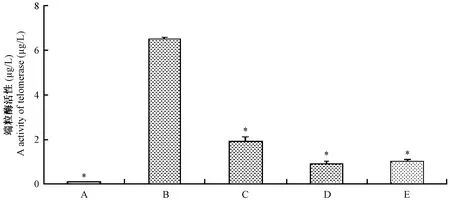
A:正常组;B:模型组(DEN+2-AAF+PH);C:HQS小剂量治疗组[4 g/(kg·d)];D:HQS大剂量治疗组[8 g/(kg·d)];E:槲寄生总碱组[8 mg/(kg·d)]。结果用均数±标准差表示. *代表与模型组相比差异有统计学意义(P<0.05)。图4 DEN诱导的大鼠肝脏组织中端粒酶活性的表达Note. A: Normal control; B: Model group (DEN+ 2-AAF+PH); C: Low-dose HQS(4 g/kg b.w.) treatment group; D: High-dose HQS (8 g/kg b.w.) group; E: HQS and Mistletoe alkali treatment group. Results are expressed as means±s. *P<0.05, compared with the model group.Fig.4 Effcct of HQS and mistletoe alkali on the expression of telomerase in DEN-induced rat liver tissues

5A:正常组;5B:模型组(DEN+2-AAF+PH);5C:HQS大剂量治疗组 [8 g/(kg·d)];5D:HQS小剂量治疗组[4 g/(kg·d)];5E:槲寄生总碱组 [8 mg/(kg·d)].图5 槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏中NF-κB P65的表达。×200,(标尺=20μm)Note. 5A: Normal control; 5B: Model group (DEN+2-AAF+PH); 5C: High-dose HQS (8 g/kg b.w.) treatment group; 5D: Low-dose HQS (4 g/kg.bw) treatment group; 5E: Mistletoe alkali treatment group. Fig.5 Expression of NF-κB P65 in the DEN-induced rat liver treated with HQS and mistletoe alkali
A 正常组;B模型组(DEN+2-AAF+PH);C HQS大剂量治疗组[8 g/(kg·d)]; D HQS小剂量治疗组[4 g/(kg·d)]; E槲寄生总碱组[8 mg/(kg·d)]. 图6 槲芪散及其君药槲寄生总碱对DEN诱导的大鼠肝脏组织胞浆蛋白中IκB-α的表达Note. A: Normal control; B: Model group (DEN+2-AAF+PH); C: High-dose HQS (8g/kg.bw) treatment group; D Low-dose HQS (4 g/kg.bw) treatment group; E: Mistletoe alkali treatment group. Fig.6 HQS and mistletoe alkali enhanced the expression of IκB-α in the liver tissue with DEN-induced alterations.
在恶性肿瘤的发生发展过程中,端粒酶的激活可能是细胞永生化的关键环节,是恶性肿瘤细胞得以无限增殖的必需条件[5]。端粒酶活性定量检测方法可从只有10 个细胞的标本中检测出端粒酶的活性,由于检测所需组织细胞量少,已广泛用于端粒酶活性的判断[6]。端粒酶具有逆转录酶的活性,是一种核糖核蛋白酶,能以自身携带的RNA为模板,不断合成新的端粒序列添加到染色体末端,维持端粒不缩短,使细胞永生化,获得无限增殖的能力[7]。端粒酶与引起肿瘤细胞凋亡的相关基因关系密切,它可能是已知的最为广谱的恶性肿瘤分子标记物[8]。HQS及其君药槲寄生碱能够明显降低肝癌前病变大鼠肝脏中端粒酶的活性;与模型组比较有显著性差异(P<0.005),说明该HQS及槲寄生碱能通过影响端粒酶的活性,进而抑制异型变的肝细胞端粒合成,对癌变过程的促癌阶段有阻断作用。
NF-κB作为一种转录刺激因子,主要起介导细胞质和细胞核之间的信号转导的作用[9]。它的主要包括P50和P65二个亚基,通常与其抑制蛋白IκB结合,以非活性形式存在于细胞质中[10]。IκB-α与P65 亚单位结合时使P65的空间构象改变,从而使与靶DNA结合的关键氨基酸残基被隐蔽,这样就抑制了NF-κB与靶DNA 调节区的特异性结合。当细胞受到胞外信号刺激时,通过一个或多个信号转导途径,激活一系列激酶,使IκB降解,NF-κB与IκB发生解离,并迅速从胞质易位到胞核,在胞核内与相关基因上的κB位点发生特异性结合,调控相关基因表达[11]。由于IκB-α启动区中存在κB 结合位点,NF-κB激活后IκB-α表达相应升高, 以防止NF-κB 过度激活[12]。本研究观察到端粒酶活性与NF-κB P65、IκB-α的蛋白表达在大鼠肝癌前病变中的分布基本相一致,进一步证实了端粒酶和NF-κB P65、IκB-α参与了槲芪散及其君药槲寄生总碱阻断肝癌前病变的过程。我们的实验结果只能说明端粒酶和NF-κB P65、IκB-α参与了肝癌前病变的形成,通过下调端粒酶的活性,抑制相关基因的表达,从而干预肝癌前病变的形成。但是NF-κB P65、IκB-α在调节端粒酶的活性的过程中以怎样的顺序依次出现,目前尚不是很清楚。
[1] 刘名昆, 李国庆. 石斛提取物抗肿瘤作用研究进展 [J]. 现代医药卫生, 2015, 31(23): 3571-3574.
[2] 洪卫, 马胜林, 冯建国, 等. 毛兰素对胃癌细胞 SGC-7901端粒酶活性的影响 [J]. 浙江实用医学, 2009, 14(3): 181-182.
[3] 吴红彦, 荣倩倩, 李海龙, 等. 当归贝母苦参丸含药血清对胃癌细胞SGC-7901抑制作用机制的研究 [J]. 中国实验方剂学杂志,2016, 22(2): 137-142.
[4] 王鹏雁, 安建多, 王池, 等. 槲芪散及槲寄生提取物对肝癌细胞内游离钙离子浓度的影响 [J]. 首都医科大学学报, 2012, 33(3): 291-296.
[6] Li PY, Wu ML, Jing Wang J, et al. NAC selectively inhibit cancer telomerase activity: A higher redox homeostasis threshold exists in cancer cells [J]. Redox Biol, 2016, 8: 91-97.
[7] Qian YQ, Yang LL, Cao S. Telomeres and telomerase in T cells of tumor immunity [J]. Cell Immunol, 2014, 289(1-2): 63-69.
[8] El-Mazny A, Sayed M, Sharaf S. Human telomerase reverse transcriptase messenger RNA (TERT mRNA) as a tumour marker for early detection of hepatocellular carcinoma [J]. Arab J Gastroenterol, 2014,15(2) :68-71.
[9] Chen J, Zhang JY, Cao JM, et al. Inflammatory MAPK and NF-κB signaling pathways differentiated hepatitis potential of two agglomerated titanium dioxide particles [J]. J Hazard Materials, 2016, 304: 370-378.
[10] Unger C, Kiss I, Vasas A, et al. The germacranolide sesquiterpene lactone neurolenin B of the medicinal plant Neurolaena lobata (L.) R.Br. ex Cass inhibits NPM/ALK-driven cell expansion and NF-κB-driven tumour intravasation [J]. Phytomedicine, 2015, 22( 9): 862-874.
[11] Wier EM, Fu K, Hodgson A, et al,. Caspase-3 cleaved p65 fragment dampens NF-κB-mediated anti-apoptotic transcription by interfering with the p65/RPS3 interaction [J]. FEBS Lett, 2015, 589(23:) 3581-3587.
[12] Manu KA, Shanmugam MK, Ramachandran L, et al. Isorhamnetin augments the anti-tumor effect of capecitabine through the negative regulation of NF-κB signaling cascade in gastric cancer [J].Cancer Lett, 2015,363(1): 28-36.
Regulatory effect of a Chinese medicine prescription Hu Qi Shan on the telomerase activity in hepatic precancerous lesions in rats
MENG Xia1, LIU Shu-hong2, LI Xia2, FENG Ping2, LU Jing1,WANG Xue-jiang2
(1. Department of Experimental Animals, 2. Department of Pathophysiology, Capital Medical University,Beijing 100069)
Objective To explore the possible mechanism of action of telomerase in hepatic precancerous lesions, and the regulatory effect of a Chinese medicine prescription HU Qi Shan (HQS) and its principal drug mistletoe alkali on the telomerase activity in rat liver tissues. Methods Rat model of hepatic precancerous lesions was established by Solt-Farber two-step protocol. The model rats were randomly divided into 5 groups, including the model group, high-dose HQS [8 g/(kg·d)] group, low-dose HQS [4 g/(kg·d)] group, and mistletoe alkali[8 mg/(kg·d)] group. γ-Glutamy-transpeptidase (γ-GT) was analyzed by immunohistochemistry. AFP was detected by immunofluorescence technique.The telomerase activity was detected using a quantitative telomerase detection kit. The expression of NF-κB P65 was detected by immunohistochemistry. The cytoplasmic protein IκB-α was detected by western blotting. Results After treated with HQS and mistletoe alkali, the areas of γ-GT-positive foci and number of AFP-positive cells in the liver tissus were significantly decreased than those of the model group (P<0.05 for both), the telomerase activity was decreased, the number of NF-κB P65-positive cells was also decreased (P<0.05), whereas the intracytoplasmic expression of IκB-α proteins was significantly increased (P<0.05). Conclusions HQS and mistletoe alkali can suppress the telomerase activity. Its possible mechanism may be through inhibition of the over-expressed apoptosis-related genes such as NF-κB P65 and increase the expression of IκB-α decreasing the telomerase activity.
HQS; Telomerase; Hepatocarcinogenesis; NF-kB; IκB-α; Rat
国家自然科学基金资助项目(81272757);北京市属高等学校创新团队建设与教师职业发展计划项目( IDHT20150502)。
孟霞(1973-),研究方向:动物实验及实验动物管理,E-mail:mengxia@ccmu.edu.cn。
卢静(1969-),女,副教授,研究方向:实验动物模型研究,E-mail: lujing@ccmu.edu.cn;王学江(1957-),女,教授。研究方向:肝脏肿瘤的发生发展机制研究,E-mail: xjwang@ccmu.edu.cn。
R-33
A
1671-7856(2016)10-0036-07
10.3969.j.issn.1671-7856. 2016.10.008
2016-06-20

