高效液相色谱-电化学法测定人尿液中儿茶酚胺的浓度
陈 静,丘宏强(1.泉州医学高等专科学校药学系,福建泉州 36000;.福建医科大学附属协和医院药学部,福州 350001)
高效液相色谱-电化学法测定人尿液中儿茶酚胺的浓度
陈 静1*,丘宏强2(1.泉州医学高等专科学校药学系,福建泉州 362000;2.福建医科大学附属协和医院药学部,福州 350001)
目的:建立测定人尿液中儿茶酚胺浓度的方法。方法:尿液样品经氧化铝提取后,以3,4-二羟基苄胺为内标,采用高效液相色谱-电化学法测定,色谱柱为Shim-Pack C18,流动相为混合溶液[每500 ml混合溶液中含离子对试剂(辛烷磺酸钠)0.5 mmol、甲醇10 ml、0.06 mmol/L二正丁胺50 μl、无水乙酸钠2.0 g、柠檬酸5.5 g、乙二胺四乙酸二钠60 mg和氯化钠584.4 mg,pH=3.5],流速为0.8 ml/min,柱温为30℃,电化学检测器检测电压为750 mV,进样量为40 μl。结果:去甲肾上腺素和肾上腺素的尿药浓度均在3.125~100 ng/ml范围内线性关系良好(r分别为0.998 5和0.999 2),定量下限均为3.125 ng/ml;日内、日间RSD均<10%;方法回收率分别为99.2%~101.6%、98.9%~100.5%,提取回收率分别为63.8%~66.8%、60.5%~62.6%。结论:本方法特异性强、灵敏度较高、检测成本低,可用于人尿液中儿茶酚胺浓度的测定。
儿茶酚胺;去甲肾上腺素;肾上腺素;高效液相色谱法;电化学检测器;尿液
去甲肾上腺素(Norepinephrine,NE)和肾上腺素(Epinephrine,E)是人体内重要的儿茶酚胺类(Catecholamines,CAs)物质,与人们的健康和疾病有着密切的关系[1]。人体内CAs水平不仅可作为嗜铬细胞瘤的诊断依据,也有助于原发性高血压的鉴别诊断[2];此外,嗜铬细胞瘤患者在药物麻醉、分娩及手术等情况下可能发生高血压或休克[3],故检测此类患者体内CAs水平具有重要的临床意义。目前,对体内CAs水平的检测多采用血液样本,而血液中儿茶酚胺的质量浓度易受多种因素(如紧张、应激及低血糖等)的影响,且采血时静脉穿刺引起的疼痛也可导致患者CAs血药浓度升高[4]。因此,临床通过检测患者CAs的尿药浓度,可获得更为稳定、可靠的结果[5]。本试验在此基础上,建立了一种适用于临床且操作简便的CAs尿药浓度检测方法,以期为临床提供参考。
1 材料
1.1 仪器
LC-20A型高效液相色谱(HPLC)仪,包括LC-20AB型溶剂泵、SIL-20A型自动进样器、CTO-10Asvp型柱温箱及DGU-20AB型自动脱气装置(日本岛津公司);Waters 2465型电化学检测器(美国Waters公司);CP 114型精密分析天平(奥豪斯仪器上海有限公司);TGL-16G型高速台式离心机(上海安亭科
学仪器厂)。
1.2 药品与试剂
NE对照品(批号:1001474257,纯度≥98%)、E对照品(批号:12325621,纯度≥98%)、3,4-二羟基苄胺对照品(DHBA,内标,批号:858781-250GM,纯度≥98%)均购自美国Sigma公司;离子对试剂[辛烷磺酸钠(IPR-B8),日本梯希爱(上海)化成工业发展有限公司,批号:5324845];氧化铝[上海阿拉丁化学试剂公司(碱性,200~300目)];无水乙酸钠、柠檬酸、氯化钠、乙二胺四乙酸二钠(EDTA-Na2)、硫代硫酸钠、盐酸、乙酸乙酯、二正丁胺等均为分析纯,甲醇为色谱纯,水为去离子水。健康尿液由本实验室工作人员(即健康志愿者)提供。
2 方法与结果
2.1 色谱条件
色谱柱:Shim-Pack C18(250 mm×4.6 mm,5µm);流动相:混合溶液(每500 ml混合溶液中含IPR-B8 0.5 mmol、甲醇10 ml、0.6 mmol/L二正丁胺50 μl、无水乙酸钠2.0 g、柠檬酸5.5 g、EDTA-Na260 mg、氯化钠584.4 mg,pH=3.5);流速:0.8 ml/min;柱温:30℃;电化学检测器检测电压:750 mV;进样量:40µl。
2.2 溶液的配制
分别精密称取NE对照品8.0 mg、E对照品2.0 mg,用0.02 mol/L盐酸(含0.1%硫代硫酸钠)溶解并稀释,分别配制成NE、E质量浓度分别为0.80、0.20 mg/ml的对照品贮备液。
精密称取内标对照品400 mg,用0.02 mol/L盐酸溶解并稀释,配制成质量浓度为400 ng/ml的内标溶液。
上述溶液均置于冰箱(2~8℃)中避光保存,备用。
2.3 氧化铝的活化
取氧化铝10 g,加入2 mol/L盐酸50 ml,加热至100℃,搅拌45 min,静置1.5 min后弃去黄绿色上清液与细颗粒;于70℃下,加入2 mol/L盐酸25 ml,搅拌10 min,静置,弃去上清液,重复上述操作1次;于50℃下,加入2 mol/L盐酸50 ml,搅拌10 min,冷却,弃去上清液及悬浮颗粒;最后,用去离子水反复冲洗,至pH接近7.0,于200℃下烘烤4 h,冷却后干燥保存,备用[6]。
2.4 尿液样品收集与处理
将健康尿液在碱性条件(pH=10)下于100℃煮沸,再用0.1 mol/L盐酸调节pH至4.0,即得空白尿液。取尿液5 ml,加入乙酸乙酯15 ml,振摇5 min,静置分层。取下层有机相0.5 ml至离心管中,依次加入内标溶液150 μl、0.1%硫代硫酸钠50 μl、1 mol/L三羟甲基氨基甲烷(Tris)500 μl和已活化的氧化铝60 mg,振荡5 min,以离心半径6 cm、转速10 000 r/min离心2 min,弃去上清液;沉淀依次用2 mol/L乙酸钠溶液2 ml洗涤1次、去离子水2 ml洗涤2次后,以离心半径6 cm、转速10 000 r/min离心2 min,弃去上清液;沉淀用吸水纸吸干,加入0.1 mol/L高氯酸200 μl,振荡5 min,以离心半径6 cm、转速13 000 r/min离心3 min后,吸取上清液40 μl进样分析。
2.5 专属性考察
在“2.1”项色谱条件下,内源性杂质对待测物无干扰,NE、E及内标的保留时间分别为6.818、8.709和11.638 min。HPLC图见图1。
2.6 标准曲线的制备
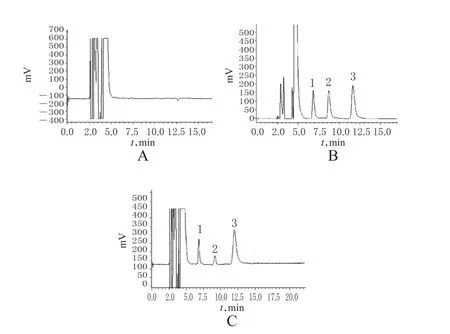
图1 高效液相色谱图A.空白尿样;B.空白尿样+NE+E+内标;C.健康志愿者尿样+内标;1. NE;2.E;3.内标Fig 1 HPLC chromatogramsA.blank urine;B.blank urine+NE+E+internal standard;C.urine sample from healthy volunteer+internal standard;1.NE;2.E;3.internal standard
精密吸取NE、E对照品贮备液及空白尿液各适量,配制成NE、E质量浓度均为100、50、25、12.5、6.25、3.125 ng/ml的系列尿液样品,按“2.4”项下方法处理后,进样分析,记录色谱图。以待测物与内标的峰面积比值(y)为纵坐标、待测物质量浓度(x)为横坐标进行线性回归,得NE、E的回归方程分别为:yNE=0.062 3xNE+0.097 6(r=0.998 5)、yE=0.041 8xE+0.076 2(r=0.999 2)。结果表明,NE、E尿药浓度均在3.125~100 ng/ml范围内线性关系良好,定量下限均为3.125 ng/ml。
2.7 精密度与回收率试验
2.7.1 精密度 分别配制NE低、中、高质量浓度(4、40、80 ng/ml,下同)的尿液样品和E低、中、高质量浓度(4、40、80 ng/ml,下同)的尿液样品,各5份,按“2.4”项下方法处理后,进样分析。于1日内分别测定5次,考察日内RSD;连续测定5 d,考察日间RSD。结果显示,两者日内、日间RSD<10%。精密度试验结果见表1。
表1 精密度与回收率试验结果(s,n=5)Tab 1 Results of precision and recovery tests(s ,n=5)

表1 精密度与回收率试验结果(s,n=5)Tab 1 Results of precision and recovery tests(s ,n=5)
理论质量浓度,ng/ml待测物方法回收率,%提取回收率,% NE 4 E 40 80 4 40 80日内精密度实测质量浓度,ng/ml 3.91±0.15 38.58±1.24 82.36±3.71 3.85±0.10 38.62±1.43 78.58±3.30 RSD,% 3.8 3.2 4.5 2.6 3.7 4.2日间精密度实测质量浓度,ng/ml 3.85±0.14 37.27±1.53 78.69±4.80 3.75±0.12 37.62±1.62 77.98±3.74 RSD,% 3.4 4.1 6.1 3.1 4.3 4.8 99.5 99.2 101.6 99.6 98.9 100.5 63.8 65.2 66.8 62.6 61.3 60.5
2.7.2 方法回收率 分别配制NE及E低、中、高质量浓度的尿液样品,各5份,按“2.4”项下方法处理后,进样分析,按当日标准曲线计算两者的实测质量浓度,与理论质量浓度比较,考察方法回收率。结果显示,NE、E的方法回收率分别为99.2%~101.6%、98.9%~100.5%。方法回收率试验结果见表1。
2.7.3 提取回收率 分别配制NE及E低、中、高质量浓度的尿液样品,各5份,按“2.4”项下方法处理后,进样分析,得峰面积A;另取空白尿液0.5 ml,各5份,按“2.4”项下方法处理后,分别加入NE、E对照品贮备液各适量,使最终质量终浓度与前者对应,进样分析,得峰面积B。提取回收率=A/B×100%。结果显示,NE、E的提取回收率分别为63.8%~66.8%、60.5%~62.6%。提取回收率试验结果见表1。
2.8 稳定性试验
分别配制NE及E低、高质量浓度的尿液样品,考察其在室
温(25℃)及4℃下放置的稳定性。各样品于室温25℃下避光保存,分别于0、1、3、6、12 h按“2.4”项下方法处理后,进样分析,重复操作3次;各样品于4℃冰箱中放置,隔日取出,室温融化,按“2.4”项下方法处理后,进样分析,重复操作3次,连续测定7 d。以0 h(25℃)或0 d(4℃)时NE或E的尿药浓度为100%,计算各样品中NE或E的相对百分含量,评价其稳定性。结果显示,在室温(25℃)下,各样品中NE和E的相对百分含量随时间的延长而明显下降,12 h后两者的相对百分含量均低于90%(NE、E分别降至85.2%和89.7%);而在4℃条件下,NE和E的相对百分含量虽有下降趋势,但5 d后两者的相对百分含量仍>95%,但放置7 d后,NE和E的相对百分含量分别降至94.2%和93.6%,提示各样品不宜在室温条件下保存,且在4℃冰箱中放置不宜超过5 d。
3 讨论
目前,多采取HPLC法检测人体内CAs水平,检测器多选用电化学检测器、荧光检测器和紫外检测器[7-8]。荧光、紫外检测器信号强度和灵敏度相对较低,而电化学检测器利用CAs可氧化的特性,通过电流信号放大,可检测出其他检测器无法监测到的物质,具有特异性强、灵敏度较高、检测成本低等特点。因此,高效液相色谱-电化学法被广泛应用于临床CAs质量浓度的监测[9]。
本实验在流动相中加入了离子对试剂(500 ml混合溶液中含0.5 mmol的IPR-B8),对NE和E具有良好的保留作用[10]。在流动相筛选过程中笔者发现,若减少了IPR-B8的加入量,NE色谱峰处会出现倒置的干扰峰,且难以通过调整流动相比例来消除其干扰,极大地影响了NE的定量分析。此外,若流动相中甲醇的比例过高,目标峰与杂质峰难以有效分离;而甲醇的比例过低,则会导致分析时间过长。故最终确定每500 ml混合溶液中甲醇的加入量为10 ml。
本试验采用氧化铝吸附提取尿液中的CAs,氧化铝的来源、粒径、酸碱性和干燥程度等均可影响CAs的提取效率[9]。笔者在前期试验中比较了不同来源氧化铝[天津市福晨化学试剂厂(中性,未注明目数)、西陇化工股份有限公司(中性,未注明目数)、上海阿拉丁化学试剂公司(碱性,100~200目或200~300目)]的提取效率,以选择最优类型氧化铝及其最佳用量。结果显示,上海阿拉丁化学试剂公司的碱性氧化铝(200~300目)的提取回收率最高(NE、E的提取回收率分别为65.2%、61.3%);当氧化铝用量为60 mg时,提取回收率最高(NE、E的提取回收率分别为65.7%、63.3%)。氧化铝的提取回收率虽不及文献报道的阳离子交换柱(可达90%)[10-11],但其在满足定量检测的基础上,成本较阳离子交换柱(仅可使用1次)低了很多。故本研究最终选择阿拉丁试剂公司的碱性氧化铝,并将其用量确定为60 mg。此外,在试验过程中,应注意保持氧化铝的干燥,防止其吸潮,影响提取效率。
尿液样品的pH会影响氧化铝的吸附活性,也会影响CAs的稳定性。氧化铝在pH为8.2~8.5条件下吸附CAs的能力最强,而CAs在碱性条件下却不稳定,两者存在矛盾[10]。前期试验以Tris缓冲液作为碱性媒介,对其浓度进行考察。结果显示,当Tris缓冲液浓度为1 mol/L时,提取回收率最高。此外,Tris缓冲液应尽快加入,以避免CAs在碱性条件下发生降解。
本研究考察了尿液样本常温下放置12 h和4.冰箱中放置7 d的稳定性。结果显示,室温放置12 h,尿液中的NE、E的相对百分含量分别降至85.2%和89.7%。4℃冰箱保存5 d后,NE、E的相对百分含量无明显变化,均维持在95%以上;而7 d后,NE、E的相对百分含量则下降至94.2%和93.6%。提示临床样本采样完毕后,应尽快送检,在冰箱中冷藏放置的时间也不宜超过5 d。
目前,采用尿液中CAs作为嗜铬细胞瘤的诊断标准并不统一。Lenders JW等[12]提出以24 h尿液中NE>198µg、E>31 µg作为确诊嗜铬细胞瘤的标准,而国内则以NE>100µg、E>50µg作为诊断标准[13]。本研究显示,NE及E的尿液浓度的线性范围均为3.125~100 ng/ml,以正常人平均24 h尿量1 000~2 000 ml计算,本方法可基本满足临床检测的要求。虽然本方法操作步骤较为烦琐,氧化铝也需定期活化,但本方法特异性强、灵敏度较高、检测成本低,适用于CAs尿药浓度监测。
[1] 李静娜,梁高道,朱其明,等.高效液相色谱电化学法测定人血清中的儿茶酚胺及5-羟色胺含量[J].中国卫生检验杂志,2009,19(8):1 722.
[2] 兰翠霞,刘雯馨.HPLC-ECD检测尿液儿茶酚胺含量[J].临床检验与医学,2007,18(2):35.
[3] 彭婕,方芸.内源性儿茶酚胺的测定在嗜铬细胞瘤诊断中的应用[J].药物与临床研究,2010,18(4):366.
[4] 常爱武,吴予明,吴拥军,等.24小时尿儿茶酚胺在儿童神经母细胞瘤早期诊断中的价值[J].临床荟萃,2005,20(23):1 359.
[5]彭颖斐,吴炯,郭玮,等.尿儿茶酚胺LC-MS/MS检测方法的建立[J].检验医学,2015,30(5):433.
[6] 邢艳霞,余卫平,任慕兰,等.HPLC-FD法检测尿儿茶酚胺[J].东南大学学报:医学版,2004,23(3):188.
[7] 夏国华,李子豪,陈晨,等.HPLC-FD测定大鼠尿液中儿茶酚胺类化合物[J].中国实验方剂学杂志,2014,20(23):125.
[8] 梁秋云,黄慧学,刘华钢,等.HPLC法测定自发性高血压大鼠血浆中去甲肾上腺素的含量[J].中国药房,2010,21(21):1 952.
[9] 李博,李川松.测定分析儿茶酚胺类物质方法的研究进展[J].四川生理科学杂志,2015,37(4):214.
[10] 吴朝阳,丘宏强,刘茂柏.阳离子交换-高效液相色谱-电化学法测定人血浆中儿茶酚胺的浓度[J].中国医院药学杂志,2015,35(14):1 278.
[11] 勾凌燕,刘景东,王憬,等.固相萃取-高效液相色谱电化学法检测大鼠血浆中儿茶酚胺[J].分析实验室,2006,25(1):90.
[12] Lenders JW,Eisenhofer G,Mannelli M,et al.Phaeochromocytoma[J].Lancet,2005,366(9 486):665.
[13] 吴予明,常爱武,张洪权,等.高效液相色谱法检测尿中儿茶酚胺及其临床应用[J].中国卫生检验杂志,2000,10(5):526.
(编辑:张元媛)
Concentration Determination of Catecholamine in Human Urine by HPLC-Electrochemistry
CHEN Jing1,QIU Hongqiang2(1.Dept.of Pharmacy,Quanzhou Medical College,Fujian Quanzhou 362000,China;2.Dept.of Pharmacy,Fujian Medical University Union Hospital,Fuzhou 350001,China)
OBJECTIVE:To establish a method for the concentration determination of catecholamines in human urine.METHODS:After extracted by aluminum oxide,using 3,4-dihydroxybenzylamine as internal standard,HPLC-electrochemistry was performed on the column of Shim-Pack C18with mixed solution[every 500 ml mixed solution containing ion-pairing reagents(octane sulfonate)0.5 mmol,methanol 10 ml,0.06 mmol/L Di-n-butylamine 50 μl,sodium acetate anhydrous 2.0 g,citric acid 5.5 g,EDTA-Na260 mg and sodium chloride 584.4 mg,pH=3.5]at a flow rate of 0.8 ml/min,column temperature was 30℃,detection voltage was 750 mV,and injection volume was 40 μl.RESULTS:The linear ranges were 3.125-100 ng/ml for both norepinephrine(r=0.998 5)and epinephrine(r=0.999 2),lower limits of quantitation were 3.125 ng/ml;RSDs of within days and daytime were lower than 10%,method recoveries were 99.2%-101.6%and 98.9%-100.5%,extraction recoveries were 63.8%-66.8%and 60.5%-62.6%.CONCLUSIONS:The method shows strong specificity,high sensitivity and low detection cost,and can be used for the concentration determination of catecholamines in human urine.
Catecholamines;Norepinephrine;Epinephrine;HPLC;Electrochemical detector;Urine
R917
A
1001-0408(2016)26-3627-03
2015-12-23
2016-06-04)
*讲师,硕士。研究方向:药理学。电话:0595-22783475。E-mail:825649654@qq.com
DOI 10.6039/j.issn.1001-0408.2016.26.08

