我院105例多西紫杉醇不良反应报告分析
江 彦,傅彦妍,宋洪涛(1.南京军区福州总医院药学科,福州 35005;.沈阳药科大学药学院,沈阳110016)
我院105例多西紫杉醇不良反应报告分析
江 彦1*,傅彦妍2,宋洪涛1#(1.南京军区福州总医院药学科,福州 350025;2.沈阳药科大学药学院,沈阳110016)
目的:了解我院多西紫杉醇不良反应(ADR)发生的特点及其影响因素,为临床合理用药及个体化给药提供参考。方法:通过医院信息系统(HIS)导出我院2014年4月-2015年10月所有使用多西紫杉醇进行抗肿瘤化疗患者的病历,从中调取多西紫杉醇相关ADR报告,通过回顾性分类统计法对ADR报告进行综合分析。结果:417份病例中,有105份多西紫杉醇相关ADR报告,其中50~69岁年龄段的患者有69例次,ADR发生频次最高;女性患者的ADR发生率高于男性患者(29.29%vs.19.66%);多西紫杉醇相关ADR及骨髓抑制发生率随给药剂量增加均呈升高趋势;乳腺癌的ADR发生频次最高(46.03%),其次为肺癌和胃癌(分别为37.25%和25.00%);联合用药方案中,多西紫杉醇+铂类化疗方案的ADR发生率最高(35.10%);ADR累及器官/系统以血液系统居首(55.65%)。结论:多西紫杉醇相关ADR的个体差异较大,且受到多种因素的影响,应及早根据患者的个体情况作出评估,减少不良反应的发生,促进临床合理用药。
多西紫杉醇;药品不良反应;影响因素
多西紫杉醇,又名多西他赛,是一种新型植物碱类半合成抗肿瘤化疗药,对多种化疗耐药性实体瘤有效,具有较高的抗肿瘤活性[1]。虽然多西紫杉醇的临床疗效确切,但其在杀灭肿瘤细胞的同时,对正常细胞也有很大的破坏作用,可能导致治疗期间药品不良反应(ADR)的发生[2]。个体的先天(遗传性)或后天(获得性)因素均可对多西紫杉醇的体内过程产生影响,使得相同剂量的药物在不同个体内的血药浓度不同,从而导致多西紫杉醇致ADR存在差异。笔者以我院2014年4月-2015年10月间使用多西紫杉醇并发生ADR的患者作为研究对象,进行回顾性分析,旨在为临床合理使用多血紫杉醇及个体化给药提供参考。
1 资料与方法
1.1 资料来源
通过医院信息系统(HIS)导出我院2014年4月-2015年10月所有使用多西紫杉醇进行抗肿瘤化疗患者的病历共417份,从中调取我院药品不良反应监测管理系统上报的多西紫杉醇相关ADR报告共105份。
1.2 方法
采用回顾性分类统计法,对使用多西紫杉醇的417例次患者的性别、年龄、体表面积、多西紫杉醇给药剂量、化疗方案、ADR累及器官/系统及原患肿瘤等关联性评价进行统计分析。ADR因果关系根据国家ADR监测中心的ADR判断标准进行评价。
1.3 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计数资料以率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果与分析
2.1 患者的性别、年龄分布
在提取的417份病历中,共有105份ADR报告,其中男性35例,女性70例,女性患者ADR发生率较男性患者高
(29.29%vs.19.66%)。患者年龄范围为25~89岁,其中50~69岁患者的ADR发生频次最高,共有69例次(28.87%),详见表1、表2。

表1 患者的性别分布(例次)Tab 1 Distribution of patients'gender(case number)

表2 患者的年龄分布(例次)Tab 2 Distribution of patients'age(case number)
由表1、表2可见,χ2检验表明,多西紫杉醇ADR发生频次在男性患者与女性患者间的差异有统计学意义(P<0.05),提示女性是多西紫杉醇ADR发生的危险因素。3个年龄组的ADR发生频次差异亦有统计学意义(P<0.05),提示50~69岁是多西紫杉醇ADR发生的高危年龄段。
2.2 患者的体表面积分布
105例次发生多西紫杉醇相关ADR患者的体表面积总体分布较为分散。体表面积<1.5 m2及体表面积处于1.5~<1.6 m2范围内的患者ADR发生频次较高,均达到25例次;而体表面积处于1.7~<1.8 m2范围内患者的ADR发生率最高,为29.51%,详见表3。

表3 患者体表面积分布(例次)Tab 3 Distribution of surface area of patients(case number)
由表3可知,多西紫杉醇ADR的发生频次在不同体表面积组间差异无统计学意义(P>0.05),表明体表面积与多西紫杉醇ADR的发生无显著相关性。这可能是由于体表面积只取决于患者的身高及体质量,与药物的体内过程并非直接相关。多西紫杉醇的个体药动学差异大,不同患者的药物代谢酶活性不同,从而导致对药物的代谢能力及敏感程度不同。临床上基于体表面积给药尚缺乏精准度,而血药浓度是直接衡量药物系统暴露水平的指标,这也反映了基于基因检测及血药浓度监测给药的必要性。
2.3 患者的原患肿瘤分布
在发生多西紫杉醇相关ADR患者的原患肿瘤中,乳腺癌的ADR发生频次居首位,共29例次;其次为肺癌,19例次;胃癌居第3位,为18例次。在这些癌种中,消化系统肿瘤(包括胃癌和食道癌)的ADR发生频次共计有31例次。从ADR发生率来看,乳腺癌和肺癌的ADR发生率最高,分别为46.03%和37.25%,详见表4。
由表4可见,χ2检验表明,多西紫杉醇的ADR发生频次在不同癌种中的差异有统计学意义(P<0.05)。其中,乳腺癌、肺癌及胃癌的ADR发生频次最高,提示这3个癌种是多西紫杉醇ADR发生的危险因素。这可能与多西紫杉醇的适用癌种、适用癌种的发病率及特定癌种的特定发病性别有关。

表4 患者原患癌种分布(例次)Tab 4 Distribution of original diseases(case number)
2.4 患者的给药剂量分布
从发生多西紫杉醇ADR患者的给药剂量分布来看,剂量<60 mg/m2患者的相关ADR发生率及骨髓抑制发生率均最低,分别为18.48%及7.61%,而剂量>75 mg/m2患者的相关ADR发生率及骨髓抑制发生率均最高,分别为35.71%及28.57%。由此可见,多西紫杉醇相关ADR及骨髓抑制发生率随给药剂量增加均呈升高趋势。我院多西紫杉醇的使用剂量与药品说明书推荐的75 mg/m2给药剂量有所差异,可能与医师基于患者自身状况进行剂量调整有关,详见表5。
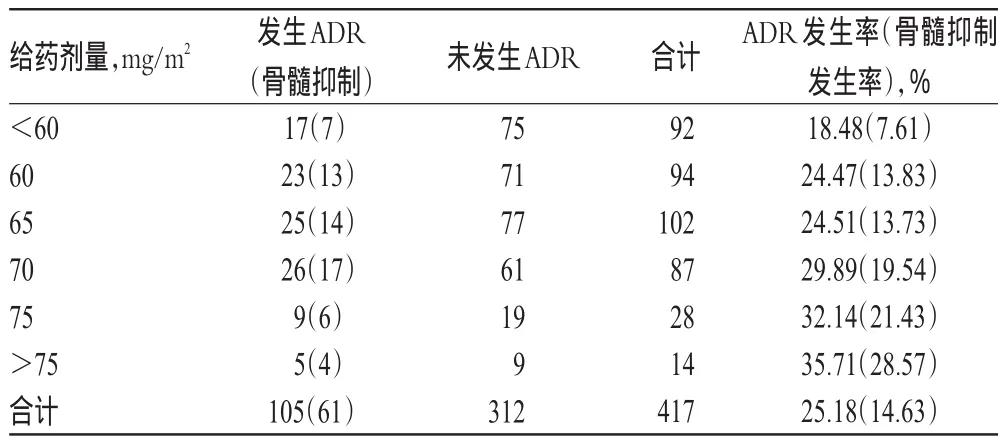
表5 患者的给药剂量分布(例次)Tab 5 Distribution of drug dosage(case number)
由表5可见,多西紫杉醇的ADR发生频次在不同剂量组间差异有统计学意义(P<0.05),说明多西紫杉醇给药剂量与ADR的发生相关。类似地,骨髓抑制的发生频次在不同剂量组间的差异也具有统计学意义(P<0.05),表明多西紫杉醇给药剂量越大,骨髓抑制发生的几率越大。这提示,若给予患者较高剂量的多西紫杉醇,则应及早地密切监测相关ADR的发生。
2.5 患者的化疗方案分布
105例次ADR中,患者的给药方式均为静脉滴注,其中有92例次为合并用药,有74例次为二联用药,其余为三联或四联用药。从发生ADR的化疗方案分布上看,多西紫杉醇适用的化疗方案较为多样,其中多西紫杉醇与铂类联用的ADR发生率最高,达到35.10%,详见表6。
由表6可见,χ2检验表明,多西紫杉醇的ADR发生频次在多个化疗方案间的差异有统计学意义(P<0.05)。其中,铂类药物与多西紫杉醇联用导致的ADR发生频次最高。这可能与该方案适用癌种的发病率较高、临床上基于经验使用该方案及配伍药物的毒副作用较大有关。
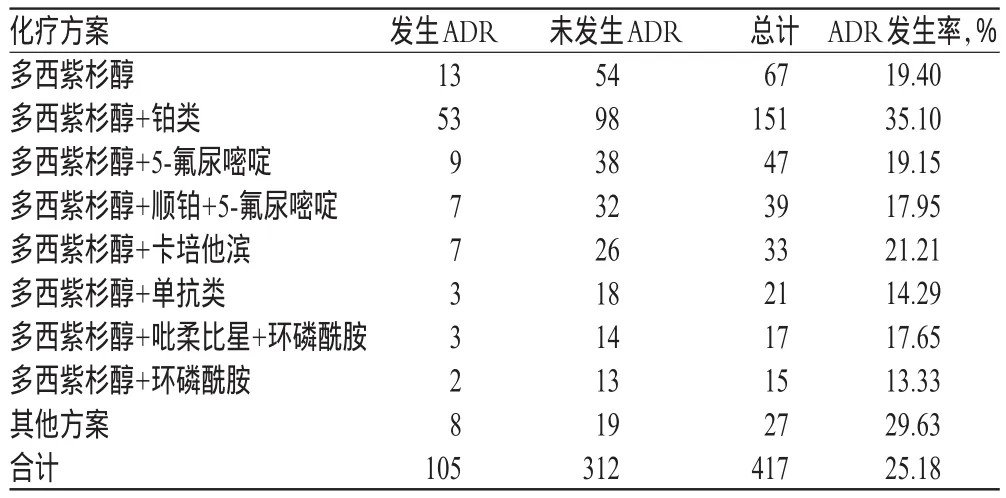
表6 患者化疗方案分布(例次)Tab 6 Distribution of chemotherapy regimens(case number)
2.6 ADR累及器官/系统及临床表现分布
多西紫杉醇相关ADR累及器官/系统以血液系统居多,共出现69例次,其中骨髓抑制发生例数占绝大多数,共61例次,其次是消化系统损害,达到17例次,详见表7。

表7 ADR累及器官/系统及临床表现分布情况Tab 7 Organs/systems involved by ADR and clinical manifestations
由表7可知,多西紫杉醇的血液学毒性是其最主要的剂量限制性毒性,其在杀伤肿瘤细胞的同时可杀伤正常组织的细胞,尤其是人体中生长发育旺盛的血液细胞、淋巴细胞等,这些细胞与组织是人体重要的免疫防御系统,故对于多西紫杉醇相关血液系统ADR的监测和处理至关重要。
3 讨论
3.1 患者因素与ADR的关系
105份ADR报告中,女性多于男性,主要原因是多西紫杉醇注射液临床上用于乳腺癌的治疗较多,也可能与女性患者体质较差,对ADR较为敏感有关。ADR的发生年龄大多集中在中老年人群中,其中50~69岁患者共有69例次,占到105份ADR报告的绝大多数。肿瘤流行病学研究显示[3],中老年人肿瘤发病率较高,因此该年龄段用药人数多,且中老年患者生理功能下降,影响了药物在体内的吸收、分布、代谢、排泄,使ADR更易发生。此外,老年人常患多种疾病,往往累及多个器官/系统,且常为慢性病,这使得老年人的用药机会和用药种类明显增加,进一步增加了ADR发生的风险[4]。因此,临床医师应根据中老年人的生理特点合理用药,同时密切监测用药过程中患者的反应。
3.2 药物联用与ADR的关系
105份ADR中,联合用药达92例次,其中与铂类药物联用的ADR发生率最高,为35.10%。铂类药物为细胞周期非特异性药,常见的ADR是肾脏毒性、消化系统毒性及骨髓抑制,铂类药物与其他骨髓抑制药物联用时可增加毒性,因此应减少用量。多西紫杉醇与铂类药物联用时,ADR发生比例较高是否与铂类药物有关还有待进一步观察;但二者联用时应注意给药顺序,做好给药前的预处理工作,同时做好整个化疗过程中ADR的监测,注意迟发性ADR的发生[5]。
3.3 累及器官/系统与ADR的关系
多西紫杉醇ADR累及器官/系统以血液系统为最多,其所致骨髓抑制为剂量限制性毒性,随着剂量的增加和疗程的推进,其血液学毒性加重,但可逆转且不蓄积[6]。建议用药过程中严密监测血常规,一旦发生严重的骨髓抑制,应及时调整剂量,使用对症支持治疗,并同时给予抗感染治疗。多西紫杉醇的消化系统ADR以恶心呕吐最为常见,这是因为多西紫杉醇可引起肠壁和呕吐中枢化学受体触发区(CTZ)内嗜铬细胞的5-氢色胺(HT)水平明显升高,激动5-HT3受体,刺激迷走神经经交感神经的传入纤维和/或CTZ而作用于呕吐中枢,进而引发呕吐[7]。严重呕吐可致水、电解质紊乱,使患者对化疗的耐受性降低,依从性下降,甚至使化疗不能正常进行。预先使用5-HT3受体拮抗药,如昂丹司琼、格拉司琼等作为预防治疗,可使症状减轻。体液潴留和血管神经性水肿是多西紫杉醇独特的ADR,具有可逆性。多疗程用药,累积剂量达400~500 mg/ m2以上可出现下肢体液潴留,甚至发展为全身性水肿,采用激素预处理可预防或减轻水肿的发生[8]。本研究统计结果显示,多西紫杉醇出现神经系统损害的比例较高,甚至高于皮肤及其附件损害,主要表现为头晕、耳鸣和视物模糊等,提示医务人员应加强相关ADR的监护。
3.4 基于血药浓度监测的个体化给药
与大部分化疗药物相似,目前主要是根据患者的体表面积确定多西紫杉醇的初始给药剂量,但是由于其治疗窗窄和个体间存在药动学差异,在治疗过程中容易发生因血药浓度过高而导致严重的ADR。基于体表面积制定给药剂量时,由于患者的个体药动学差异导致其药-时曲线下面积差异最高可达7倍,总清除率差异最高可达10倍[9]。有研究报道,多西紫杉醇的血药浓度高低与其ADR及临床疗效的发生风险相关[10]。此外,大量临床数据也证明,患者个体间及自身的药动学差异是引起化疗药物毒性过高或治疗失败的主要原因[9]。因此,基于体表面积给药法在化学药物治疗中具有较大的局限性,直接监测每例患者的多西紫杉醇药动学参数从而对其进行剂量调整可能是一种更为有效的方法。已有临床研究证明,多西紫杉醇的药-时曲线下面积可以用来预测其疗效及毒副作用[10];而对于单个患者的研究也表明[11],多西紫杉醇的药-时曲线下面积与患者接受静脉滴注的剂量成正比[11]。根据患者的药-时曲线下面积对其进行个体化剂量调整,对指导多西紫杉醇个体化用药具有一定的参考价值,有助于提高多西紫杉醇的疗效和降低毒副反应的发生。
4 结论
通过调取我院417份病例,并对其中105份ADR报告的综合分析发现,多西紫杉醇相关ADR的个体差异较大,且受到多种因素的影响。但因样本量有限,文中的数据分析内容可能还有局限性。通过分析得知,患者化疗前应尽早根据患者个体情况作出评估,对易发生多西紫杉醇相关ADR的患者进行
重点监测;在药物使用过程中,监测患者的血药浓度并适时调整给药剂量,能够有效降低药物潜在相互作用引起的血药浓度升高的风险。作为临床药师,还应充分发挥指导临床合理用药的职责,提高药物应用的安全性和有效性,促进临床合理用药。
[1] Kyu PK,Jin HA,Sung BK.Prospective evaluation of the drug-metabolizing enzyme polymorphisms and toxicity profile of docetaxel in Korean patients with operable lymph node-positive breast cancer receiving adjuvant chemotherapy[J].Cancer Chemother Pharmacol,2012,69(5):1 221.
[2]Stefanie DK,Howard LM,Daniel LH.Pharmacogenetics,enzyme probes and therapeutic drug monitoring as potential tools for individualizing taxane therapy[J].Pharmacogenomics,2013,14(5):555.
[3] 赵文华.恶性肿瘤流行趋势分析及预防的研究[J].天津科技,2006,33(3):38.
[4] Siegel R,Ma J,Zou Z,et al.Cancer statistics[J].CA,2014,64(1):9.
[5] 孙燕,石远凯.临床肿瘤内科手册[M].5版.北京:人民卫生出版社,2007:567.
[6] Alexandre J.Relationship between cytochrome 3A activity,inflammatory status and the risk of docetaxel-induced febrile neutropenia:a prospective study[J].Ann Oncol,2007,18(1):1 682.
[7] 瞿美霞,徐金中.抗肿瘤药物的不良反应分析与防治[J].医药导报,2010,29(3):394.
[8] Wasif SM,Adrienne C,Salvatore JS,et al.Pharmacokinetically guided dose adjustment of 5-fluorouracil:a rational approach to improving therapeutic outcomes[J].Natl Cancer Inst,2009,101(22):1 543.
[9] Gambacorti-Passerini C.Alpha 1 acid glycoprotein binds to imatinib(STI 571)and substantially alters its pharmacokinetics in chronic myeloid leukemia patients[J].Clin Cancer Res,2003,9(2):6 252.
[10] Bruno R,Vivier N,Veyrat-Follet C,et al.Population pharmacokinetics and pharmacokinetic-pharmacodynamic relationships for docetaxel[J].Invest New Drugs,2001,19(2):163.
[11] McLeod HL,Kearns CM,Kuhn JG,et al.Evaluation of the linearity of docetaxel pharmacokinetics[J].Cancer Chemother Pharmacol,2008,42(2):155.
(编辑:李 劲)
Analysis of 105 Docetaxel Related ADR Reports in Our Hospital
JIANG Yan1,FU Yanyan2,SONG Hongtao1(1.Dept.of Pharmacy,Fuzhou General Hospital of Nanjing Military Command,Fuzhou 350025,China;2.School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
OBJECTIVE:To investigate the characteristics and influential factors of adverse drug reactions(ADRs)of docetaxel in our hospital,and to provide suggestions for clinical rational drug use and individualized administration.METHODS:Medical records of patients receiving anti-tumor chemotherapy were extracted from hospital information system(HIS)of our hospital during Apr.2014 and Oct.2015,and Docetaxel related ADR reports were collected and comprehensively analyzed by retrospective classified statistics.RESULTS:Among 417 cases,105 cases of docetaxel related ADR were reported.There were 69 patients aged 50-69 with highest ADR frequency.The ADR incidence of female patients was higher than that of male patients(29.29%vs.19.66%). The incidence of docetaxel related ADR and arrest of bone marrow increased as the increase of drug dosage;the incidence of breast cancer ADR was the highest(46.03%),followed by lung cancer(37.25%)and gastric cancer(25.00%).The incidence of docetaxel+platinum chemotherapy plan ADR was the highest(35.10%).Main organs/system involved in ADR was hematological system(55.65%).CONCLUSIONS:The individual difference of docetaxal related ADR are great and affected by several factors. Individual physical condition of patients should be taken into consideration as early as possible,which can reduce the incidence of ADR and promote clinical rational drug use.
Docetaxel;Adverse drug reaction;Influential factors
R969.3
A
1001-0408(2016)26-3646-04
2015-10-24
2015-12-28)
*药师。研究方向:临床药学。电话:0591-22859853。E-mail:jyxdd@163.com
#通信作者:主任药师,教授,博士生导师。研究方向:临床药学、药剂学、药理学。电话:0591-22859459。E-mail:sohoto@vip.163.com
DOI 10.6039/j.issn.1001-0408.2016.26.14

