阿仑膦酸钠维D3对不同性别、年龄晚期肺癌患者T细胞免疫指标的影响Δ
李晓英,谢启超(1.重庆市渝北区人民医院肿瘤科,重庆 401120;2.第三军医大学第二附属医院肿瘤科,重庆 400037)
·药物与临床·
阿仑膦酸钠维D3对不同性别、年龄晚期肺癌患者T细胞免疫指标的影响Δ
李晓英1*,谢启超2#(1.重庆市渝北区人民医院肿瘤科,重庆 401120;2.第三军医大学第二附属医院肿瘤科,重庆 400037)
目的:探讨阿仑膦酸钠维D3对不同性别、年龄晚期肺癌患者T细胞免疫指标的影响。方法:选择晚期肺癌患者76例,按照肺癌类型分为非小细胞肺癌(NSCLC)组(n=40)和小细胞肺癌(SCLC)组(n=36),另选择38例健康受试者作为对照组。NSCLC组和SCLC组患者均在姑息治疗的基础上给予阿仑膦酸钠维D3片1片,po,qd,两组患者疗程均为1个月。比较两组患者治疗前、后及对照组受试者入组时的T细胞免疫指标,包括CD4+、CD8+和调节性T细胞(Treg)水平;观察两组患者不良发应发生情况。结果:治疗前,NSCLC组和SCLC组患者CD4+、CD8+、CD4+/CD8+及Treg水平与对照组比较,差异均有统计学意义(P<0.05);但NSCLC组和SCLC组间比较,差异无统计学意义(P>0.05)。治疗后,两组患者的CD4+、CD4+/CD8+水平均升高,且男性患者的变化水平明显大于女性,两组患者的CD8+、Treg水平均降低,且男性患者的变化水平大于女性患者,除NSCLC组的男、女性患者CD8+水平差异无统计学意义外(P=0.33),其余均有统计学意义(P<0.05);≤50岁患者的CD4+、CD4+/CD8+升高水平明显大于>50岁患者,CD8+、Treg降低水平明显大于>50岁患者,差异均有统计学意义(P<0.05)。两组患者均未见明显不良反应发生。结论:阿仑膦酸钠维D3可有效改善晚期肺癌患者的T细胞免疫指标水平,且男性及≤50岁的患者效果更佳,可考虑作为肺癌患者的常规辅助用药。
肺癌晚期;维生素D;T细胞;Treg;调节性T细胞;性别;年龄
肺癌是对人类健康和生命威胁最大的恶性肿瘤之一,其发病率和病死率迅速增长,均占所有恶性肿瘤的第一位[1]。肺癌的发病机制尚未完全明确,其早期并无明显的临床症状,无特异性的实验室及影像学检查指标,患者确诊时大多已进入疾病进展阶段,严重地影响着患者的治疗效果及预后。人体的免疫系统对癌变细胞具有清除作用。T细胞是细胞免疫的主要细胞,在受到抗原刺激后,T细胞增殖、分化、转化为致敏
T细胞,当相同抗原再次进入机体细胞时,致敏T细胞及其释放的细胞因子对抗原具有协同杀伤作用。不同类型的T细胞亚群具有对应的免疫调控作用。T细胞成熟后,根据表面CD分子的表达差异分为辅助型T细胞(CD3+CD8+T细胞)和杀伤型T细胞(CD3+CD4+T细胞)。T细胞亚群可反映人体的免疫功能[2]。维生素D参与钙、磷的代谢,是一类重要的免疫调节剂,对固有免疫和适应性免疫均有调节作用,维生素D不足可能导致异常反应(如感染和自身免疫性疾病),已被常规用于肿瘤的辅助治疗[3-4]。鉴于此,本研究观察了阿仑膦酸钠维D3对不同性别、年龄晚期肺癌患者T细胞免疫指标的影响。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)由病理学或细胞学检查结果确诊的非小细胞肺癌(NSCLC)或小细胞肺癌(SCLC)的晚期患者(根据国际抗癌联盟TNM分期标准);(2)Karnofsky功能状态(KPS)评分≥60分;(3)血常规、肝功能、肾功能、心电图等指标基本正常。
排除标准:(1)合并自身免疫疾病者,如风湿性骨关节病、系统性红斑狼疮等;(2)合并其他恶性肿瘤者;(3)1个月内接受糖皮质激素或免疫抑制治疗者[5]。
1.2 研究对象
选择重庆市渝北区人民医院和第三军医大学第二附属医院2014年1月-2016年1月就诊的晚期肺癌患者共76例,按照患者的肺癌类型分为NSCLC组(n=40)和SCLC组(n=36);另选择38例健康受试者作为对照组。NSCLC组患者男性22例,女性18例,年龄37~69岁,≤50岁24例,>50岁16例;SCLC组患者男性19例,女性17例,年龄35~72岁,≤50岁21例,>50岁15例;对照组男性16例,女性22例,年龄35~71岁,≤50岁26例,>50岁12例。3组受试者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,受试者均知情同意并签署知情同意书。
1.3 治疗方法
NSCLC组和SCLC组患者均接受姑息治疗,根据患者的个体情况制订个体化的姑息治疗方案,治疗原则以减轻患者症状为主,并在此基础上给予阿仑膦酸钠维D3片(英国Merck Sharp&Dohme Ltd.,注册证号:H20130840,规格:每片含阿仑膦酸钠70 mg和维生素D32 800 IU)1片,po,qd。两组患者疗程均为1个月。
1.4 观察指标
观察两组患者治疗前后及对照组受试者入组时的T细胞免疫指标,包括CD4+、CD8+和Treg水平。分别于晨间取血进行抗凝处理,取抗凝全血100 μl分别加入CD25-PE单克隆抗体(以下简称“单抗”)/CD4-FITC单抗、CD4-FITC单抗/CD8-PE单抗/CD3-PerCP单抗试剂(美国Beckman Coulter Inc.)及阴性对照单抗20 μl,避光室温放置30 min,加入溶血剂(北京美科美佳生物科技开发有限公司,批号:93231)2.0 ml后静置10 min,以转速1 500 r/min(离心半径10 cm)离心5 min,弃去上清液,加入磷酸盐缓冲溶液(PBS)0.5 ml,采用贝克曼库尔特流式细胞仪Gallios以及流式细胞技术(FCM)分析并获取T细胞免疫指标信息。观察两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0统计软件对数据进行统计分析。计量资料以s表示,采用t检验;计数资料以百分比表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组受试者T细胞免疫指标水平比较
治疗前,两组患者CD4+、CD8+、CD4+/CD8+及调节性T细胞(Treg)水平与对照组比较,CD4+、CD4+/CD8+水平显著低于对照组,而CD8+及Treg水平显著高于对照组,差异均有统计学意义(P<0.05);但两组患者组间比较,差异无统计学意义(P>0.05)。3组受试者入组时T细胞免疫指标比较见表1。
表1 3组受试者入组时T细胞免疫指标比较(s)Tab 1 Comparison of the T cell immune indexes among 3 groups when patients enrolling(s)

表1 3组受试者入组时T细胞免疫指标比较(s)Tab 1 Comparison of the T cell immune indexes among 3 groups when patients enrolling(s)
注:与对照组比较,*P<0.05Note:vs.control group,*P<0.05
Treg,% 5.82±2.45*6.23±3.08*3.71±1.89组别NSCLC组SCLC组对照组n 40 36 38 CD4+,% 49.36±4.55*48.68±4.74*58.76±5.12 CD8+,% 42.91±5.77*43.55±4.97*33.78±3.22 CD4+/CD8+1.16±0.19*1.11±0.21*1.62±0.30
2.2 两组患者治疗前T细胞免疫指标按性别比较
治疗前,NSCLC组患者的CD4+、CD8+和SCLC组患者CD8+水平按性别比较,男性患者与女性患者间差异均有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前T细胞免疫指标按性别比较(s)Tab 2 Comparison of the T cell immune indexes between 2 groups before treatment by different genders(s)
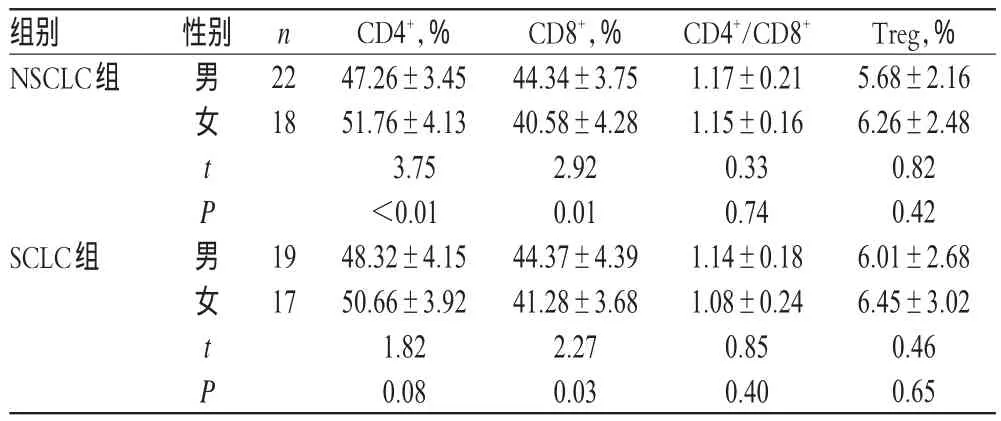
表2 两组患者治疗前T细胞免疫指标按性别比较(s)Tab 2 Comparison of the T cell immune indexes between 2 groups before treatment by different genders(s)
组别NSCLC组性别n男女t P男女t P 22 18 SCLC组19 17 CD4+,% 47.26±3.45 51.76±4.13 3.75<0.01 48.32±4.15 50.66±3.92 1.82 0.08 CD8+,% 44.34±3.75 40.58±4.28 2.92 0.01 44.37±4.39 41.28±3.68 2.27 0.03 CD4+/CD8+1.17±0.21 1.15±0.16 0.33 0.74 1.14±0.18 1.08±0.24 0.85 0.40 Treg,% 5.68±2.16 6.26±2.48 0.82 0.42 6.01±2.68 6.45±3.02 0.46 0.65
2.3 两组患者治疗前T细胞免疫指标按年龄比较
治疗前,两组患者CD4+、CD8+、CD4+/CD8+和Treg水平按年龄比较,≤50岁患者与>50岁患者间差异均有统计学意义(P<0.05),详见表3。
表3 两组患者治疗前T细胞免疫指标按年龄比较(s)Tab 3 Comparison of the T cell immune indexes betwwen 2 groups before treatment by different ages(s)
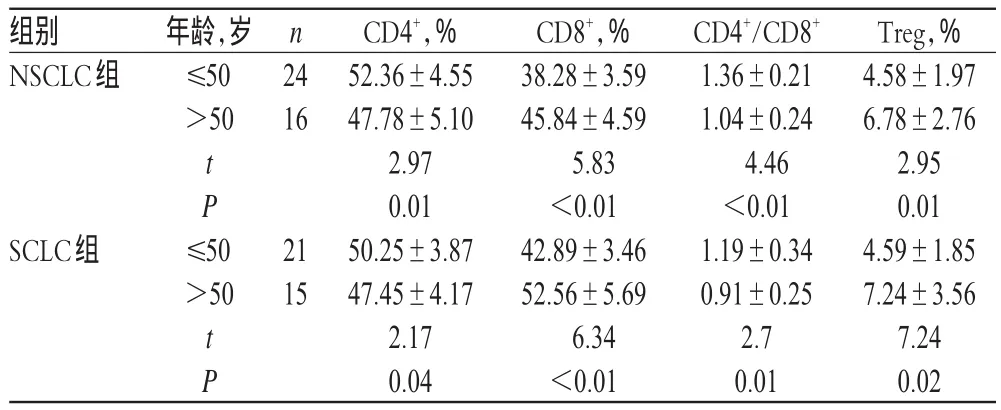
表3 两组患者治疗前T细胞免疫指标按年龄比较(s)Tab 3 Comparison of the T cell immune indexes betwwen 2 groups before treatment by different ages(s)
Treg,% 4.58±1.97 6.78±2.76 2.95 0.01 4.59±1.85 7.24±3.56 7.24 0.02组别NSCLC组年龄,岁≤50>50 n 24 16 t P SCLC组 ≤50>50 21 15 t P CD4+,% 52.36±4.55 47.78±5.10 2.97 0.01 50.25±3.87 47.45±4.17 2.17 0.04 CD8+,% 38.28±3.59 45.84±4.59 5.83<0.01 42.89±3.46 52.56±5.69 6.34<0.01 CD4+/CD8+1.36±0.21 1.04±0.24 4.46<0.01 1.19±0.34 0.91±0.25 2.7 0.01
2.4 两组患者治疗后T细胞免疫指标变化水平按性别比较
治疗后,两组患者的CD4+、CD4+/CD8+水平均升高,且男性患者的变化水平明显大于女性患者,差异均有统计学意义(P<0.05);两组患者的CD8+、Treg水平均降低,且男性患者的变化水平大于女性患者,除NSCLC组的男、女性患者CD8+水平差异无统计学意义外(P=0.33),其余差异均有统计学意义(P<0.05),详见表4。
2.5 两组患者治疗后T细胞免疫指标变化水平按年龄比较
治疗后,≤50岁患者的CD4+、CD4+/CD8+升高水平明显大于>50岁患者;≤50岁患者CD8+、Treg降低水平明显大于>50
岁患者,差异均有统计学意义(P<0.05),详见表5。
表4 两组患者治疗后T细胞免疫指标变化水平按性别比较(s)Tab 4 Comparison of the T cell immune indexes levels between 2 groups after treatment by different genders(s)

表4 两组患者治疗后T细胞免疫指标变化水平按性别比较(s)Tab 4 Comparison of the T cell immune indexes levels between 2 groups after treatment by different genders(s)
ΔTreg,% -1.28±0.52 -0.86±0.38 2.66 0.01 -1.35±0.62 -0.92±0.34 2.43 0.02组别NSCLC组性别n男女t P男女t P 24 16 SCLC组21 15 ΔCD4+,% 5.06±2.47 3.19±2.53 2.22 0.03 6.55±2.63 4.78±1.83 2.24 0.03 ΔCD8+,% -3.57±1.48 -2.58±1.05 2.22 0.33 -3.98±1.18 -2.84±1.09 2.94 0.01 ΔCD4+/ΔCD8+0.14±0.07 0.08±0.04 2.98 0.01 0.19±0.07 0.12±0.05 3.31<0.01
表5 两组患者治疗后T细胞免疫指标变化水平按年龄比较(s)Tab 5 Comparison of the T cell immune indexes levels between 2groups after treatment by different ages(s)
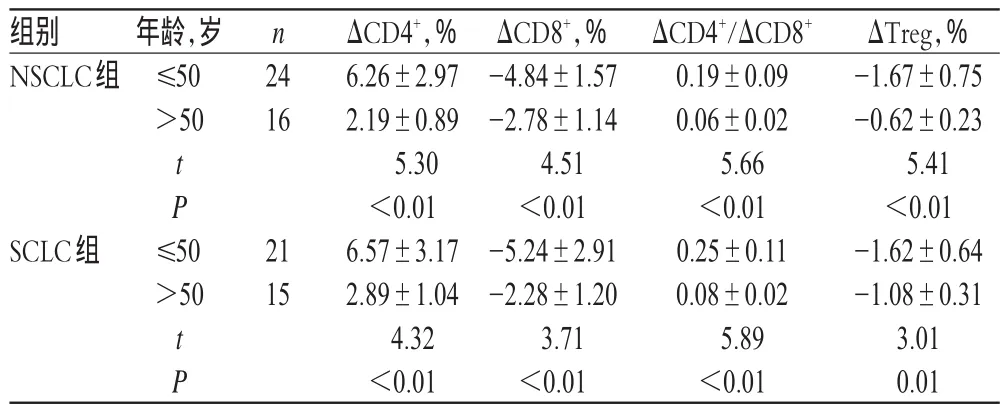
表5 两组患者治疗后T细胞免疫指标变化水平按年龄比较(s)Tab 5 Comparison of the T cell immune indexes levels between 2groups after treatment by different ages(s)
2.6 不良反应本研究两组患者均未见明显不良反应发生。
组别NSCLC组ΔTreg,% -1.67±0.75 -0.62±0.23 5.41<0.01 -1.62±0.64 -1.08±0.31 3.01 0.01年龄,岁≤50>50 n 24 16 t P SCLC组 ≤50>50 21 15 t P ΔCD4+,% 6.26±2.97 2.19±0.89 5.30<0.01 6.57±3.17 2.89±1.04 4.32<0.01 ΔCD8+,% -4.84±1.57 -2.78±1.14 4.51<0.01 -5.24±2.91 -2.28±1.20 3.71<0.01 ΔCD4+/ΔCD8+0.19±0.09 0.06±0.02 5.66<0.01 0.25±0.11 0.08±0.02 5.89<0.01
3 讨论
恶性肿瘤的生成和进展与人体免疫功能密切相关,细胞免疫在抗肿瘤治疗中至关重要,T细胞亚群比例均衡是维持免疫系统稳定的关键因素,T细胞亚群的检测被广泛应用于肿瘤进展的检测和预后的判断[6-7]。CD3+CD4+T细胞可分泌多种细胞因子,激活并诱导单核细胞、自然杀伤细胞(NK)和巨噬细胞对肿瘤发生免疫应答。CD4+T细胞还能产生白细胞介素(IL)2,作为CD8+T细胞的第二激活信号,协同参与抗肿瘤的免疫应答[9]。CD3+CD8+T细胞对免疫功能有抑制作用,可维持机体免疫系统的平衡。Xu L等[9]研究发现,肺癌患者免疫系统常受到多重免疫抑制。Sasada T等[10]纳入156例胃癌患者的研究发现,胃癌患者CD4+CD25+Treg水平高于正常值,尤以发生腹膜转移的患者CD4+CD25+Treg水平最高,显示CD4+CD25+Treg水平与预后呈负相关。王惠军等[11]的研究发现肺癌,患者的CD4+CD25+Treg水平[(13.71±2.59)%]明显高于正常值[(10.37±1.94)%]。齐红等[12]的研究发现,不同性别、年龄的肺癌患者的CD4+、CD8+水平存在差异。本研究结果显示,晚期NSCLC与SCLC患者T细胞亚群与健康受试者存在差异,男性及>50岁患者的免疫功能优于女性及≤50岁患者。
Mohr SB等[14]的研究分析了国际肿瘤研究机构数据库111个国家的肺癌患者数据,结合美国国家航空航天局(NASA)的户外紫外线(UVB)实测数据,发现各国的UVB与肺癌的发病率呈负相关。Wei Z等[15]的研究纳入了456例早期NSCLC患者,结果显示可通过选择高UVB季节(夏季)手术和摄入更多维生素D提高患者生存率,夏季手术患者的无复发生存期是冬季手术患者的3倍;维生素D摄取≥239 IU/d的患者的总生存率和无复发生存率明显优于维生素D摄取<239 IU/d的患者。Nunn JD等[15]研究发现,维生素D对单核噬菌T细胞有一定的调节作用。王茂峰等[16]的研究发现,肺癌患者血浆中维生素D水平与Treg水平呈负相关。而本研究按性别和年龄对患者的T细胞免疫指标进行比较可见,维生素D对晚期肺癌患者免疫系统有一定的调节作用,且对男性及≤50岁患者能起到更佳的调节作用。
综上所述,阿仑膦酸钠维D3可有效改善晚期肺癌患者的T细胞免疫指标水平,且男性及≤50岁的患者效果更佳,可考虑作为肺癌患者的常规辅助用药。但本研究未对不同性别和年龄晚期肺癌患者免疫细胞及癌细胞维生素D受体及相关信号通路作进一步分析来明确维生素D辅助治疗疗效的差异,有待后续的深入研究。
[1] Kim JL,Cho KH,Park EC,et al.A single measure of cancer burden combining incidence with mortality rates for worldwide application[J].APJCP,2014,15(1):433.
[2] 齐红,石虹,刘玉侠,等.253例恶性肿瘤患者外周血T细胞亚群的检测及其临床意义分析[J].中国实验诊断学,2009,13(11):1 589.
[3] Theresa S,Paula K,Michael L,et al.Vitamin D and breast cancer[J].Oncologist,2012,17(1):36.
[4] Kessler A.Higher vitamin D levels may increase survival rates for breast,lymphoma,and colon cancer patients[J]. Life Extension,2014,20(8):1.
[5]Yu DP,Han Y,Zhao QY,et al.CD3+CD4+and CD3+CD8+lymphocyte subgroups and their surface receptors NKG2D and NKG2A in patients with non-small cell lung cancer[J].APJCP,2014,15(6):2 685.
[6] Coe D,Addey C,White M,et al.Distinct in vivo CD8 and CD4 T cell responses against normal and malignant tissues [J].Cancer Immunol Immun,2013,62(1):101.
[7] 任秀红,刘莉,刘平平,等.恶性肿瘤患者T细胞亚群变化及其与肿瘤分期的关系[J].第三军医大学学报,2006,28(18):1 906.
[8] Xia YH,Wang ZM,Chen RX,et al.T-cell apoptosis induced by intratumoral activated hepatic stellate cells is associated with lung metastasis in hepatocellular carcinoma [J].Oncol Rep,2013,30(3):1 175.
[9] Xu L,Chen D,Lu C,et al.Advanced lung cancer is associated with decreased expression of perforin,CD95,CD38 by circulating CD3+CD8+T lymphocytes[J].Ann Clin Lab Sci,2015,45(5):528.
[10] Sasada T,Kimura M,Yoshida Y,et al.CD4+CD25+regulatory T cells in patients with gastrointestinal malignancies [J].Cancer,2003,98(5):1 089.
[11] 王惠军,刘波,金秀国,等.肺癌患者CD4+CD25+Treg的检测及临床意义[J].中国免疫学杂志,2007,23(1):42.
[12] 齐红,刘玉侠,任林广,等.肺癌患者外周血淋巴细胞亚群与性别、年龄及临床分期的关系[J].中国实验诊断学,2012,16(11):2 034.
[13] Mohr SB,Garland CF,Gorham ED,et al.Could ultraviolet B irradiance and vitamin D be associated with lower incidence rates of lung cancer?[J].J Epidemiol Community Health,2008,62(1):69.
[14] Wei Z,Suk R,Liu G,et al.Vitamin D is associated with improved survival in early-stage non-small cell lung cancer patients[J].Cancer Epidem Biomar,2005,14(10):2 303.
[15] Nunn JD,Katz DR,Barker S,et al.Regulation of human tonsillar T-cell proliferation by the active metabolite of vitamin D3[J].Immunology,1986,59(4):479.
[16] 王茂峰,王攀,应俊,等.肺癌患者外周血Th17/Treg细胞与维生素D检测的临床价值[J].医学研究杂志,2014,43(6):81.
Effects ofAlendronate Sodium and Vitamin D3on T Cell Immune Indexes in Patients with Different Genders and Ages withAdvanced Lung Cancer
LI Xiaoying1,XIE Qichao2(1.Dept.of Oncology,the People's Hospital of Yubei District,Chongqing 401120,China;2.Dept.of Oncology,the Second Affiliated Hospital of Third Military Medical University,Chongqing 400037,China)
OBJECTIVE:To explore the effect of alendronte sodium and vitamin D3on the T cell immune indexes in patients with different genders and ages with advanced lung cancer.METHODS:76 patients with advanced lung cancer were divided into nonsmall cell lung cancer(NSCLC)group(n=40)and small cell lung cancer(SCLC)group(n=36),and another 38 healthy volunteers were control group.Based on palliative care,all patients received Alendronte sodium and vitamin D3tablet 1 tablet,po,qd,for 1 month.T cell immune indexes(CD4+,CD8+and Treg levels)in 2 groups before and after treatment,and when volunteers enrolling the control group were compared;and the incidence of adverse reactions were observed.RESULTS:Compared with control group,there were significant differences in CD4+,CD8+,CD4+/CD8+and Treg levels(P<0.05);but there was no significant difference between NSCLC group and SCLC group(P>0.05).After treatment,CD4+and CD4+/CD8+levels in NSCLC group and SCLC group increased,changes of male were greater than female,CD8+and Treg levels decreased,changes of male were greater than female,except for CD8+level in NSCLC group(P=0.33),there were significant differences in others(P<0.05);CD4+and CD4+/CD8+levels in patients≤50 years old increased more than patients>50 years old,CD8+and Treg levels decreased more than patients>50 years old,the differences were statistically significant(P<0.05).No obvious adverse reactions were found.CONCLUSIONS:Alendronte sodium and vitamin D3can effectively improve the T cell immune indexes in patients with advanced lung cancer,especially for male and patients≤50 years old,which can be considered as conventional adjuvant drugs for patients with lung cancer.
Advanced lung cancer;Vitamin D;T cell;Treg;Gender;Age
R734
A
1001-0408(2016)26-3652-04
2016-04-13
2016-07-25)
(编辑:陶婷婷)
重庆市卫生和计划生育委员会医学科研计划项目(No.20142181)
*主治医师。硕士。研究方向:肿瘤免疫。电话:023-67821037。E-mail:215736595@qq.com
#通信作者:副主任医师,博士。研究方向:肿瘤免疫。电话:023-68774701。E-mail:626105562@qq.com
DOI 10.6039/j.issn.1001-0408.2016.26.16

