西妥昔单抗联合NP方案同期放化疗用于晚期非小细胞肺癌的临床观察Δ
陈类吉,谢羽婕,陈昌洪,张 弛,张智慧(四川医科大学附属第一医院肿瘤内科,四川泸州 646000)
西妥昔单抗联合NP方案同期放化疗用于晚期非小细胞肺癌的临床观察Δ
陈类吉*,谢羽婕,陈昌洪,张 弛,张智慧#(四川医科大学附属第一医院肿瘤内科,四川泸州 646000)
目的:探讨西妥昔单抗联合NP方案同期放化疗用于晚期非小细胞肺癌(NSCLC)的临床疗效及安全性。方法:选取晚期NSCLC患者76例,依据治疗方法的不同分为对照组和观察组,各38例。对照组患者给予NP方案(顺铂25 mg/m2+长春瑞滨12.5 mg/m2)化疗+胸腔调强放疗;观察组患者在对照组基础上加用西妥昔单抗400 mg/m2(第1天),每周维持剂量250 mg/m2,持续13周。比较两组患者的近期临床疗效、生存情况及治疗前后T淋巴细胞亚群、辅助性T细胞(Th)1、Th2、免疫球蛋白(Ig)及补体水平,并记录不良反应发生情况。结果:观察组患者总有效率为86.84%,显著高于对照组的65.79%,差异有统计学意义(P<0.05)。观察组患者的平均生存时间为18.70个月,2年生存率为55.26%,显著长于/高于对照组的14.75个月和31.58%,差异均有统计学意义(P<0.05)。观察组患者生存质量稳定提高率为94.74%,显著高于对照组的68.42%,差异有统计学意义(P<0.05)。治疗后,两组患者CD4+、CD4+/CD8+和IgG的水平明显增高,CD8+、补体C3、Th1、Th2及Th1/Th2显著下降,且观察组显著优于对照组,差异均有统计学意义(P<0.05);两组患者CD3+、IgA、IgM及补体C4水平比较,差异无统计学意义(P>0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:西妥昔单抗联合NP方案同期放化疗能显著提高晚期NSCLC患者的临床疗效,改善生存质量,延长生存时间,促进Ig、补体和T淋巴细胞水平的恢复,且安全性较好。
非小细胞肺癌;西妥昔单抗;免疫球蛋白;补体;T淋巴细胞;NP方案
肺癌多发生于肺支气管黏膜上皮,可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两种类型,其中NSCLC约占肺癌总数的80%~85%[1]。目前,针对NSCLC的治疗主要包括手术、化疗、放疗或生物靶向治疗等[2]。西妥昔单抗是表皮生长因子受体(EGFR)特异性抑制剂,可阻断细胞内信号转导途径,遏制肿瘤细胞增殖,诱导其凋亡,是治疗转移性结肠癌的有效靶向药物[3]。然而,西妥昔单抗联合同期放化疗的疗效尚不明确。因此,本研究探讨了西妥昔单抗联合NP方案同期放化疗治疗NSCLC的临床疗效及对免疫球蛋白、补体和T淋巴细胞水平的影响,以期为临床提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合2011年版《原发性肺癌诊疗规范》诊断标准者[4];(2)符合国际肺癌研究协会(IASLC)2009年第7版
分期标准Ⅲ期[5];(3)符合实体肿瘤疗效评价标准(RECIST)[6];(4)可客观测量的肿瘤病灶,临床病史资料完整;(4)血液生化常规、心电图、肝肾肺功能检查均无明显异常。排除标准:(1)既往恶性肿瘤史、冠心病、高血压和糖尿病等其他慢性疾病者;(2)严重感染或伴有合并症和并发症者;(3)患有西妥昔单抗、NP治疗方案禁忌证,且预计生存期<6个月者。
1.2 资料来源
选取2010年8月-2013年9月我院肿瘤内科收治的NSCLC患者76例,依据治疗方案的不同分为对照组和观察组,各38例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
表1 两组患者一般临床资料比较(s)Tab 1 Comparison of general information between 2groups(s)
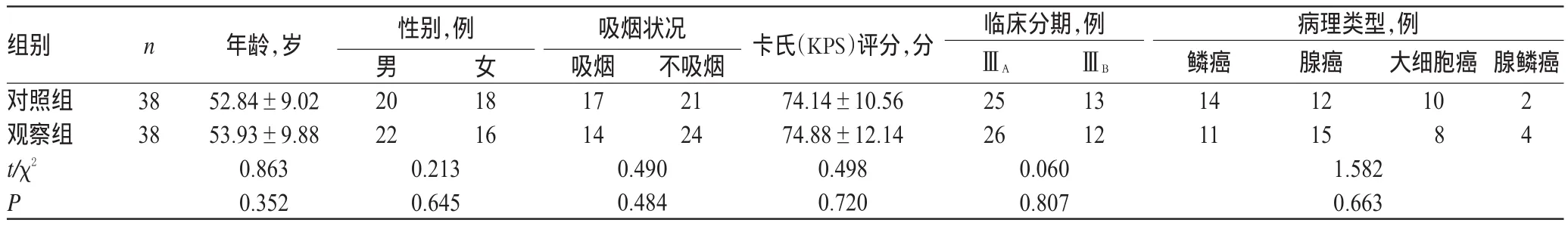
表1 两组患者一般临床资料比较(s)Tab 1 Comparison of general information between 2groups(s)
组别对照组观察组t/χ2P n临床分期,例年龄,岁52.84±9.02 53.93±9.88 0.863 0.352性别,例男20 22 0.213 0.645女ⅢAⅢB腺鳞癌38 38 18 16吸烟状况吸烟17 14 0.490 0.484不吸烟21 24卡氏(KPS)评分,分74.14±10.56 74.88±12.14 0.498 0.720 25 26 13 12腺癌12 15大细胞癌10 8 2 4 0.060 0.807病理类型,例鳞癌14 11 1.582 0.663
1.3 治疗方法
对照组患者予以注射用顺铂(齐鲁制药有限公司,批准文号:国药准字H20023460,规格:10 mg)75 mg/m2+注射用酒石酸长春瑞滨(山西普德药业股份有限公司,批准文号:国药准字H20041467,规格:10 mg)25 mg/m2方案诱导化疗,以3周为1个周期,化疗2个周期;再给予NP方案(顺铂25 mg/m2+注射用酒石酸长春瑞滨12.5 mg/m2)化疗2个周期,在同期化疗的基础上给予胸腔调强放疗1.8~2.0 Gy/次/d,总剂量60~66 Gy;观察组患者在对照组基础上给予西妥昔单抗注射液(德国默克公司,注册证号:S20130004,规格:100 mg/20 ml/瓶)首次剂量400 mg/m2,每周维持剂量250 mg/m2,持续13周。
1.4 观察指标及疗效评价
(1)根据实体瘤疗效评价标准RECIST进行近期疗效评价[6]。完全缓解(CR):肿瘤完全消失且无新病灶出现,持续时间大于1月;部分缓解(PR):肿瘤最大直径和最大垂直直径乘积缩小大于50%,并持续1月以上,其他病变无明显进行性加重;稳定(SD):肿瘤最大直径和最大垂直直径乘积缩小<50%,且增大≤25%;进展(PD):肿瘤最大直径和最大垂直直径乘积增大>25%。总有效率=(CR例数+PR例数)/总例数× 100%。(2)观察两组患者生存时间及生存率。(3)采用KPS评分对两组患者治疗前后予以评估,改善:KPS评分增加>10分;恶化:KPS评分值减少>10分;稳定:KPS评分增加或减少均<10分。稳定提高率=(改善例数+稳定例数)/总例数× 100%。(4)检测两组患者治疗前后T淋巴细胞亚群指标水平、辅助性T细胞(Th)1、Th2、免疫球蛋白(Ig)A、IgM、IgG及补体C3、C4水平。(5)观察两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 18.0软件对数据进行统计分析。计量资料两组间比较采用独立样本t检验,治疗前后比较采用配对t检验;计数资料的两组间比较则运用χ2检验;采用Kaplan-Meier法分析总体生存时间,Log Rank检验比较组间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者近期临床疗效比较
观察组患者总有效率为86.84%,显著高于对照组的65.79%,差异有统计学意义(P<0.05)。两组患者近期临床疗效比较见表2。
2.2 两组患者生存情况比较
观察组患者的平均生存时间为18.70个月,2年生存率为55.26%,显著长于/高于对照组的14.75个月和31.58%,差异均有统计学意义(P<0.05)。两组患者生存情况比较见图1。

表2 两组患者近期临床疗效比较[例(%%)]Tab 2 Comparison of short-term efficacy between 2 groups [case(%%)]
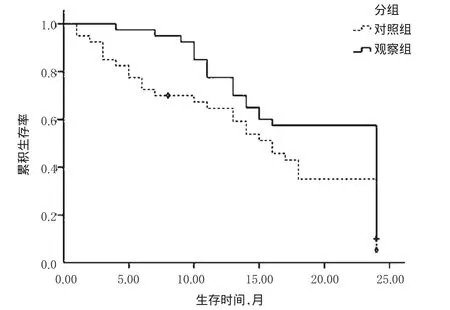
图1 两组患者生存情况比较Fig 1 Comparison of survival situation between 2groups
2.3 两组患者生存质量稳定提高率比较
观察组患者生存质量的稳定提高率为94.74%,显著高于对照组的68.42%,差异有统计学意义(P<0.05)。两组患者生存质量稳定提高率比较见表3。

表3 两组患者生存质量稳定提高率比较[例(%%)]Tab 3 Comparison of improvement rate of survival quality between 2groups[case(%%)]
2.4 两组患者治疗前后T淋巴细胞亚群指标比较
治疗前,两组患者CD3+、CD4+、CD4+/CD8+、CD8+水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD4+和CD4+/CD8+的水平显著增高,CD8+显著下降,且观察组显著优于对照组,差异均有统计学意义(P<0.05);而两组CD3+水平比较,差异无统计学意义(P>0.05)。两组患者治疗前后T淋巴细胞亚群指标比较见表4。
2.5 两组患者治疗前后Th1、Th2水平比较
两组患者治疗前Th1、Th2及Th1/Th2比值比较,差异均无统计学意义(P>0.05);治疗后,两组患者Th、Th2及Th1/Th2比值均明显降低,且观察组显著优于对照组(P<0.05)。两组患者治疗前后Th1、Th2水平比较见表5。
表4 两组患者治疗前后T淋巴细胞亚群指标比较(s)Tab 4 Comparison of T lymphocyte subsets between 2groups(s)

表4 两组患者治疗前后T淋巴细胞亚群指标比较(s)Tab 4 Comparison of T lymphocyte subsets between 2groups(s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组CD3+,%治疗前42.11±5.43 43.09±5.26治疗后44.49±5.06 44.25±5.18 CD4+,%治疗前16.14±3.00 16.22±3.61治疗后29.51±4.28*40.18±5.79*#CD8+,%治疗前57.12±6.24 56.73±6.08治疗后36.94±3.88*21.72±3.06*#CD4+/CD8+治疗前0.34±0.04 0.33±0.07治疗后0.88±0.16*1.55±0.24*#
表5 两组患者治疗前后Th1、Th2水平比较(s)Tab 5 Comparison of Th1and Th2between 2groups(s)

表5 两组患者治疗前后Th1、Th2水平比较(s)Tab 5 Comparison of Th1and Th2between 2groups(s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组Th1,%Th2,%治疗后1.64±0.10*1.21±0.05*#治疗前7.21±1.24 7.13±1.20治疗后4.81±0.41*1.71±0.38*#治疗前3.31±0.51 3.24±0.46治疗后2.22±0.65*1.35±0.27*#Th1/Th2治疗前2.15±0.08 2.04±0.05
2.6 两组患者治疗前后体液免疫指标比较
治疗前,两组患者IgA、IgM、IgG、补体C3及补体C4的比较,差异均无统计学意义(P>0.05)。治疗后,两组患者IgG水平明显升高,补体C3水平明显降低,且观察组显著优于对照组,差异均有统计学意义(P<0.05);而其他指标组间比较,差异均无统计学意义(P>0.05)。两组患者治疗前后体液免疫指标比较见表6。
2.7 不良反应
表6 两组患者治疗前后体液免疫指标比较(s,g/L)Tab 6 Comparison of immune indexes between 2groups(s,g/L)

表6 两组患者治疗前后体液免疫指标比较(s,g/L)Tab 6 Comparison of immune indexes between 2groups(s,g/L)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组IgA治疗前2.23±1.16 2.28±1.20治疗后2.56±1.01 2.73±1.21 IgM治疗前1.10±0.18 1.07±0.20治疗后1.18±0.23 1.21±0.22 IgG治疗前10.76±1.71 10.21±1.66治疗后15.21±2.82*22.75±3.13*#补体C3(g/L)治疗前1.54±0.22 1.58±0.24治疗后0.91±0.17*0.33±0.10*#补体C4治疗前0.36±0.07 0.35±0.08治疗后0.30±0.08 0.27±0.09
两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。两组患者不良反应发生率比较见表7。
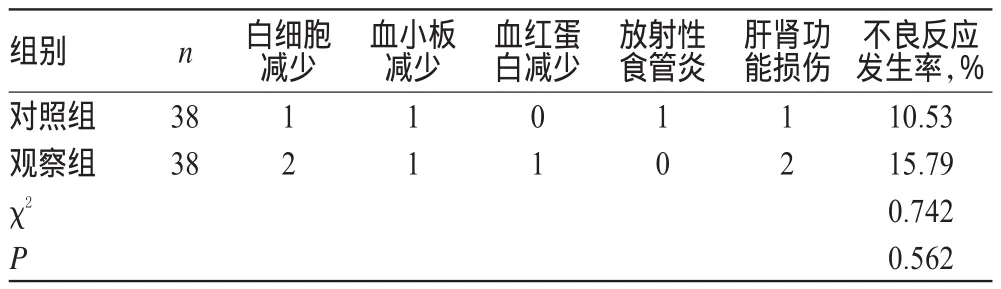
表7 两组患者不良反应发生率比较(例)Tab 7 Comparison of the incidence of ADR between 2 groups(case)
3 讨论
目前,造成NSCLC治疗失败的原因主要是局部复发和肿瘤的恶性转移,常规NP、吉西他滨联合顺铂(GP)等方案的化疗可以减少乏氧细胞,改善肿瘤组织的血流供应,提高放射敏感性;而放疗则可针对不同肿瘤细胞亚群,降低远处转移或推迟转移的发生。化疗与放疗的联合应用具有相互协同、相互补充和加强临床疗效的重要作用[7]。随着NSCLC肿瘤病理分子机制研究的深入和生物靶向治疗技术的发展,以EGFR为靶点的单克隆抗体类药物逐步被应用于NSCLC的治疗中[8]。本研究结果显示,观察组患者的临床总有效率、生存质量稳定提高率、平均生存时间、2年生存率均显著高于对照组,提示西妥昔单抗联合NP同期放疗的策略具有明显的优势。原因可能有:化疗药物增加了肿瘤细胞对放疗的敏感性,同时放疗也在一定程度上增强了化疗药物对肿瘤细胞的毒性,加上西妥昔单抗特异性的靶向阻断作用,提高了肿瘤细胞的凋亡水平;NP方案是当前国际上治疗NSCLC较为通用的化疗方案,能够使细胞停留在对射线最敏感的G2、M期[9],一方面显著提高了放疗的治疗效果,另一方面,西妥昔单抗是以表皮生长因子为靶点的分子治疗药物,由于该信号途径参与控制肿瘤细胞的存活与增殖,因此抑制表皮生长因子的水平也可提高对肿瘤细胞的杀伤能力[10]。
虽然西妥昔单抗治疗NSCLC的研究逐渐增多,治疗的安全性和有效性也被临床试验证实,但是其治疗相关的分子标志物仍未被阐明。免疫功能紊乱是诱发肿瘤的关键因素,同时,免疫功能也可反映肿瘤治疗效果和疾病预后[11]。本研究测定了两组患者治疗前后Ig、补体和T淋巴细胞水平,结果显示,两组患者治疗后CD4+、CD4+/CD8+和IgG的水平均显著升高,补体C3、CD8+、Th1、Th2和Th1/Th2均显著降低,且观察组显著优于对照组,提示西妥昔单抗可能通过调节IgG水平、促进T淋巴细胞恢复和降低补体C3,从而增强对晚期NSCLC患者的治疗效果。本研究结果还显示,两组患者治疗前后CD3+、IgA、IgM及补体C4水平无明显变化,一方面提示西妥昔单抗联合NP方案同期放化疗的综合治疗措施对免疫功能的调节康复效应具有明显的靶向特异性,另一方面说明并不是所有的免疫功能指标都适用于反映西妥昔单抗的疗效或预后。
综上所述,西妥昔单抗联合NP方案同期放化疗能显著提高晚期NSCLC患者的临床疗效,改善生存质量,延长生存时间,促进Ig、补体和T淋巴细胞水平的恢复,且安全性较好。但本研究属一项小样本的临床观察研究,仍有待后续多中心、大样本的研究深入验证。
[1] Xue C,Hu Z,Jiang W,et al.National survey of the medical treatment status for non-small cell lung cancer(NSCLC)in China[J].Lung Cancer,2012,77(2):371.
[2] Pao W,Girard N.New driver mutations in non-small-cell lung cancer[J].Lancet Oncol,2011,12(2):175.
[3] Pirker R,Pereira J R,von Pawel J,et al.EGFR expression as a predictor of survival for first-line chemotherapy plus cetuximab in patients with advanced non-small-cell lung cancer:analysis of data from the phase 3 FLEX study[J]. Lancet Oncol,2012,13(1):33.
[4] 支修益,吴一龙,马胜林,等.原发性肺癌诊疗规范:2011年版[J].中国肺癌杂志,2012,15(12):677.
[5] Goldstraw P,Ball D,Jett JR,et al.Non-small-cell lung cancer[J].Lancet,2011,378(9 804):1 727.
[6] 刘秋华,林榕波.实体瘤疗效评价标准(RECIST)指南:1.1版[C].全国临床肿瘤大会暨CSCO学术年会论文集.厦门:中国抗癌协会,2009:451.
[7] Gore EM,Bae K,Wong SJ,et al.PhaseⅢcomparison of prophylactic cranial irradiation versus observation in patients with locally advanced non-small-cell lung cancer:primary analysis of radiation therapy oncology group study RTOG 0214[J].J Clin Oncol,2011,29(3):272.
[8] Soria JC,Shepherd FA,Douillard JY,et al.Efficacy of everolimus(RAD001)in patients with advanced NSCLC previously treated with chemotherapy alone or with chemotherapy and EGFR inhibitors[J].Ann Oncol,2009,20(10):1 674.
[9] Kakil Ibrahim R,Kerr DJ.Targeted therapies:cetuximab plus chemotherapy in patients with advanced NSCLC[J]. Nat Rev Clin Oncol,2009,6(9):499.
[10] Wang LH,Shen F.Elemene emulsion combined with NP chemotherapy in the treatment of advanced NSCLC patients[J].China Oncol,2010,20(7):547.
[11] She J,Yang P,Hong Q,et al.Lung cancer in China:challenges and interventions[J].Chest J,2013,143(4):1 117.
Clinical Observation of Cetuximab Combined with NP Regimen and Radiotherapy in the Treatment of Advanced NSCLC
CHEN Leiji,XIE Yujie,CHEN Changhong,ZHANG Chi,ZHANG Zhihui(Dept.of Internal Medicine-Oncology,the First Affiliated Hospital of Sichuan Medical University,Sichuan Luzhou 646000,China)
OBJECTIVE:To explore the clinical efficacy and safety of cetuximab combined with NP regimen and radiotherapy in the treatment of advanced non-small cell lung cancer(NSCLC).METHODS:76 cases of advanced NSCLC were selected and randomly divided into control group and observation group according to different therapy methods,with 38 cases in each group. Control group received NP regimen(cisplatin 25 mg/m2+navelbine 12.5 mg/m2)+thoracic IMRT;observation group was additionally given cetuximab 400 mg/m2(first day),with maintenance dose of 250 mg/m2weekly and last for 13 weeks.Short-term efficacy,survival situation were compared between 2 groups as well as the levels of T lymphocyte,Th1,Th2,immuneglobulin(Ig)and complement.The occurrence of ADR was recorded.RESULTS:The total effective rate of observation group was 86.84%,which was significantly higher than that of control group(65.79%),with statistical significance(P<0.05).Average survival period and 2-year survival rate of observation group were 18.70 months and 55.26%,which were significantly longer or higher than those of control group(14.75 months,31.58%),with statistical significance(P<0.05).The improvement rate of survival quality was 94.74% in observation group,which was significantly higher than 68.42%in control group,with statistical significance(P<0.05).After treatment,the levels of CD4+,CD4+/CD8+and IgG were significantly increased in 2 groups,while the levels of CD8+,Th1,Th2 and Th1/Th2 were significantly decreased;the observation group was better than the control group,with statistical significance(P<0.05);there was no statistical significance in the levels of CD3+,IgA,IgM and complement 4 between 2 groups(P>0.05). There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Cetuximab combined with NP regimen and radiotherapy can improve clinical efficacy of advanced NSCLC,improve survival quality,prolong survival time and promote the recovery of Ig,complement and T lymphocyte,with good safety.
Non-small cell lung cancer;Cetuximab;Immunoglobulin;Complement;T lymphocyte;NP Regimen
R734.2
A
1001-0408(2016)26-3662-04
2015-11-23
2016-07-28)
(编辑:黄 欢)
四川省卫生和计划生育委员会2015年科研课题立项重点项目(No.150068)
*住院医师,硕士。研究方向:肿瘤耐药与肿瘤免疫治疗。电话:0830-2292040。E-mail:chenleijicz@sina.com
#通信作者:主任医师,硕士生导师。研究方向:肿瘤耐药与肿瘤免疫治疗。电话:0830-2292040。E-mail:zhihuizhanglz@tom.com
DOI 10.6039/j.issn.1001-0408.2016.26.19

