二氢杨梅素抑制脂多糖诱导后BV2细胞HMGB1的核质转位和释放
刘 祎, 徐 运, 曹 翔
二氢杨梅素抑制脂多糖诱导后BV2细胞HMGB1的核质转位和释放
刘 祎, 徐 运, 曹 翔
目的 探索二氢杨梅素(Ampelopsin,AMP)对脂多糖(LPS)刺激的小胶质细胞BV2高迁移率族蛋白B1(HMGB1)核质转位和释放的影响。方法 不同浓度的二氢杨梅素(10 μmol/L,30 μmol/L,50 μmol/L)联合LPS处理BV2细胞,用Elisa法检测HMGB1的分泌水平;细胞核质分离方法检测HMGB1核/质转位;免疫共沉淀检测HMGB1磷酸化的表达情况;免疫印迹检测JAK2、STAT3磷酸化水平。结果 不同浓度的二氢杨梅素显著抑制了LPS引起的BV2细胞HMGB1释放,减少了LPS诱导的HMGB1由细胞核到细胞质的转位。免疫共沉淀和免疫印迹结果表明:二氢杨梅素可减少HMGB1磷酸化水平,抑制LPS诱导的JAK2-STAT3信号通路激活。结论 二氢杨梅素可以抑制LPS介导的BV2细胞HMGB1的转位和释放,其主要机制可能是通过降低HMGB1的磷酸化以及抑制JAK2-STAT3信号途径。
二氢杨梅素; 脂多糖; BV2细胞; 高迁移率族蛋白B1
小胶质细胞是中枢神经系统(central nervous system,CNS)固有的免疫效应细胞,在缺血性卒中后炎症反应起着十分重要的作用[1,2]。病理条件下,小胶质细胞数量显著增加并开始活化,激活的小胶质细胞通过释放白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、一氧化氮(nitric oxide,NO)、趋化因子(chemokine)和神经生长因子(nervegrowthfactor,NGF)等细胞因子发挥细胞毒性效应,导致继发性脑损伤[3,4]。大量研究证实,抑制小胶质细胞的激活,可以减轻炎症因子对神经组织的损伤,因此,抑制小胶质细胞的激活,将成为一种有效治疗缺血性卒中的策略。高迁移率族蛋白B1(High mobility group protein box 1,HMGB1)是一种高度保守的细胞核内非组蛋白,具有广泛的生物学效应。核内的HMGB1能稳定核小体,参与DNA修复、DNA重组等生命活动,然而分泌到胞外的HMGB1可通过激活其他炎症介质,放大炎症反应,加剧缺血性脑损伤。临床研究发现,HMGB1在脑缺血后表达量明显升高并持续数周,其升高程度与脑缺血程度呈正相关[5]。在大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)动物模型和氧糖剥夺(oxygen glucose deprivation,OGD)细胞模型中,HMGB1表达水平也出现增高[6~8],并且与脑缺血程度有一定相关性。颅内注射HMGB1特异性抗体则显著减少大鼠脑的梗死面积,降低血脑屏障损害[9]。因此,抑制HMGB1的激活可能成为缺血性卒中患者更为有效的治疗手段。二氢杨梅素(Ampelopsin,AMP)是从蛇葡萄属多年野生藤本植物茎叶中提取出来的有效成分,具有抗肿瘤、抗脂质过氧化、保肝护肝等作用[10,11]。目前,对二氢杨梅素的抗炎机制研究较少,有文献报道了其对RAW264.7鼠巨噬细胞株早期炎症因子的影响[12],然而对于二氢杨梅素是否可以减轻小胶质细胞介导的晚期炎症因子HMGB1的释放,尚未见文献报道。在本研究中,我们利用BV2细胞,探究二氢杨梅素对脂多糖(Lipopolysaccharide,LPS)诱导HMGB1释放的抑制作用,并探讨其潜在作用机制,寻找缺血性卒中的潜在临床治疗手段。
1 材料和方法
1.1 试剂 二氢杨梅素(CAS号27200-12-0,纯度98%)、LPS购自美国Sigma公司,BV2细胞株购买自中国科学院细胞库。HMGB1和磷酸化丝氨酸(serine)抗体购于Abcam公司,JAK2、STAT3、p-JAK2和p-STAT3抗体均购自美国Cell Signaling公司,GAPDH、Lamin B、细胞核质分离试剂盒购于巴傲得生物科技有限公司。CCK-8试剂盒购自碧云天公司。HMGB1检测Elisa试剂盒购于武汉华美生物试剂公司。蛋白A/G偶联的琼脂糖磁珠购自Millipore公司。
1.2 细胞培养 BV2细胞用含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的高糖DMEM完全培养基,置于37 ℃、CO2体积分数为5%的培养箱中常规培养。每天换液,每2 d传代1次,实验使用均为对数生长期的细胞。
1.3 CCK-8法检测细胞活性 将BV2细胞以每孔4×103个细胞的密度接种于96孔板,待细胞生长过夜贴壁后,与不同浓度二氢杨梅素(10 μmol/L,30 μmol/L,50 μmol/L)共孵育24 h,然后每孔加入10 μl CCK-8工作液,37 ℃孵育2 h,于450 nm波长下检测光密度值。
1.4 酶联免疫吸附(Elisa)法检测HMGB1含量 将BV2细胞接种于12孔板中,待细胞生长过夜贴壁,用不同浓度的二氢杨梅素(10 μmol/L,30 μmol/L,50 μmol/L)预处理细胞2 h,继而用LPS(500 ng/ml)刺激或不刺激细胞18 h,收取细胞培养液上清,3000 r/min离心10 min去除细胞碎片。释放的HMGB1表达水平用双抗夹心法测定,具体的操作步骤按照试剂盒说明书进行。最后根据标准品,确定样品中HMGB1的含量。
1.5 细胞核质分离 将药物处理的细胞用PBS(4 ℃)洗涤2遍,弃去PBS后加入细胞质裂解液(RLA),冰上孵育20 min,3000 r/min离心15 min,所得上清液为胞质蛋白。利用RLA洗涤沉淀,反复3次后,加入核裂解液(RIPA),冰上孵育20 min,每隔5 min涡旋振荡30 s,12500 rpm/min离心15 min,上清液为核蛋白。
1.6 免疫印迹与免疫共沉淀 将药物处理的细胞用预冷PBS(4 ℃)洗涤2遍,弃去PBS后加入细胞裂解液(含蛋白酶抑制剂)冰上裂解30 min,接着用细胞刮板将细胞完全刮下,4 ℃,12500 r/min离心15 min,吸取上清蛋白。500 mg总蛋白中加入5 μg HMGB1抗体进行免疫共沉淀分析,然后在旋转混合器4 ℃过夜孵育,次日加入10%体积的预处理的蛋白 A/G 偶联的琼脂糖磁珠,旋转混合器4 ℃孵育3 h,6000 r/min离心5 min,收集沉淀,利用细胞裂解液洗涤沉淀3次,最后利用上样缓冲液打断目的蛋白与磁珠之间的二硫键,得到上清蛋白。
每组样品取等量蛋白上样,进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳约2 h后100 V恒压120 min转膜,接着用5%脱脂奶粉封闭1 h,4 ℃一抗孵育过夜。次日用含0.05%Tween-20的TBS溶液洗膜3次,再用相应种属来源的二抗室温孵育1 h,TBST清洗3次,化学发光法显影,用Image J图像分析系统分析实验结果。
2 结 果
2.1 低浓度的二氢杨梅素对BV2细胞活性无显著影响 细胞活性的检测结果如表1所示,与对照组相比,1~50 μmol/L的二氢杨梅素对BV2小胶质细胞活性影响无统计学差异(P>0.05),但是高浓度的二氢杨梅素(80 μmol/L和100 μmol/L)显著降低了BV2细胞活性。因此,本实验所用的剂量在50 μmol/L范围内。
2.2 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1的释放 Elisa实验结果表明,LPS能显著引起BV2细胞HMGB1的释放,而不同浓度二氢杨梅素预处理组HMGB1的释放明显低于LPS刺激组,并且抑制效应呈浓度依赖性(见图1)。
2.3 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1的核/质转位 核质分离的实验结果显示(见图2),LPS刺激BV2细胞12 h,大量的HMGB1蛋白由细胞核转位至细胞质,而二氢杨梅素预处理组的BV2细胞,细胞核内的HMGB1蛋白含量明显高于LPS组,而转位至细胞质的HMGB1含量显著低于LPS组,说明二氢杨梅素有效的抑制了LPS诱导的BV2细胞HMGB1的核/质转位。
2.4 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1的磷酸化 免疫共沉淀的结果发现,随着LPS刺激时间的延长,HMGB1自身的磷酸化水平也随之增高,4 h磷酸化水平达到最高点,而二氢杨梅素预处理显著抑制了HMGB1的磷酸化(见图3)。
2.5 二氢杨梅素抑制LPS诱导的BV2细胞JAK2-STAT3信号通路激活 LPS刺激BV2细胞后,JAK2、STAT3磷酸化增加,用二氢杨梅素预处理BV2细胞2 h,然后用LPS处理1 h,免疫印迹结果显示,二氢杨梅素组细胞p-JAK2、p-STAT3水平明显下调(见图4)。
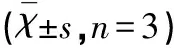
表1 二氢杨梅素对BV2细胞活性的影响
与对照组比较,*P<0.05 ,**P<0.01

与对照组比较,*P<0.05,**P<0.01
图1 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1释放

与LPS组比较,**P<0.01
图2 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1的核/质转位

图3 二氢杨梅素抑制LPS诱导的BV2细胞HMGB1的磷酸化

与对照组比较,**P<0.01;与LPS组比较,##P<0.01
图4 二氢杨梅素对LPS诱导的BV2细胞JAK2-STAT3信号通路激活的影响
3 讨 论
从发现HMGB1至今已有30余年的历史,因其分子质量小,在SDS-PAGE电泳时泳动速度快而得名。Wang等首次发现HMGB1是内毒素血症的炎性介质,与IL-1β、TNF-α这些经典的早期炎症因子相比,有表达高峰晚且持续时间长的特点[13]。近来的研究发现:HMGB1可以直接诱导细胞凋亡,扩大MCAO大鼠的梗死面积,并且加剧神经功能损伤[14,15]。临床研究显示,脑缺血患者血浆HMGB1水平显著高于对照组,与缺血性卒中严重程度以及1年时功能转归密切相关[16]。利用HMGB1的单克隆抗体或者干扰RNA能显著减少MCAO模型大鼠的脑损伤[9]。因此,充分了解HMGB1在脑缺血中的作用机制,寻找可靠有效的HMGB1抑制剂,有望为缺血性卒中的治疗带来新的方向。
小胶质细胞是介导神经炎症最主要的细胞,同时也是中枢神经系统第一道免疫防线,过度激活的小胶质细胞会释放包括HMGB1在内的大量炎性因子,导致神经元坏死与凋亡,引发严重的神经损伤[3,17]。体外OGD细胞模型研究中还发现,HMGB1能由神经元分泌,继而通过识别小胶质细胞上的HMGB1受体激活小胶质细胞,进一步促进并加重缺血再灌注损伤[15]。BV2细胞经LPS刺激后能够生成NO等炎症因子,激活NF-κB信号通路,能与T细胞、神经元相互作用[18]。
二氢杨梅素是一种具有药用价值的黄酮类物质,近年的研究发现其具有抗肿瘤、抗氧化、解酒护肝、抗病原微生物、抗炎等药理作用,在LPS诱导RAW264.7细胞中,其通过抑制IκB磷酸化、NF-κB的核转运抑制炎症反应[12]。本研究主要探讨了二氢杨梅素对LPS诱导后BV2细胞HMGB1核/质转位及释放的作用,并对其可能的机制进行了探究。结果发现,二氢杨梅素能抑制LPS诱导的HMGB1释放,并且抑制效应呈现剂量依赖性。研究发现,HMGB1的核/质转位是其由细胞释放到胞外的前提,实验中我们利用核质分离观察二氢杨梅素对HMGB1转位的影响,结果发现二氢杨梅素能够抑制HMGB1从细胞核向细胞质的转位。研究指出,HMGB1的转位和释放以自身磷酸化为前提[19],同时Youn等发现细胞质中磷酸化的HMGB1不能自由的入核[20]。我们进一步的实验结果证实,二氢杨梅素的预处理能显著减少LPS诱导后BV2细胞HMGB1的磷酸化水平。研究证实JAK2-STAT3信号途径参与HMGB1的释放,该通路的抑制剂AG490被证实具有减少HMGB1从巨噬细胞中释放的能力[21,22],我们进一步检测了JAK2-STAT3信号通路的变化。实验结果发现二氢杨梅素可抑制LPS激活的JAK2-STAT3信号通路。这些结果说明,二氢杨梅素可以抑制LPS诱导后BV2细胞HMGB1核/质转位和释放,其潜在机制可能与HMGB1的磷酸化以及JAK2-STAT3信号通路有关。
本研究初步证实二氢杨梅素预处理能抑制LPS诱导的BV2细胞HMGB1的释放,提示二氢杨梅素具有抗神经炎症的作用。通过潜在机制的探究,为临床治疗缺血性卒中的神经炎性反应提供了一定的理论依据。本研究只涉及BV2细胞的体外研究,在动物模型上的进一步探讨将是我们未来研究的重点。
[1]Graeber MB. Changing face of microglia[J]. Science,2010,330(6005):783-788.
[2]Griffiths M,Neal JW,Gasque P. Innate immunity and protective neuroinflammation:new emphasis on the role of neuroimmune regulatory proteins[J]. Inter Rev Neurobiol,2007,82:29-55.
[3]Lucas SM,Rothwell NJ,Gibson RM. The role of inflammation in CNS injury and disease[J]. Brit J Pharmacol,2006,147(Suppl 1):232-240.
[4]Block ML,Zecca L,Hong JS. Microglia-mediated neurotoxicity:uncovering the molecular mechanisms,Nature reviews[J]. Neuroscience,2007,8(1):57-69.
[5]Goldstein RS,Gallowitsch-Puerta M,Yang L,et al. Elevated high-mobility group box 1 levels in patients with cerebral and myocardial ischemia[J]. Shock,2006,25(6):571-574.
[6]Muhammad S,Barakat W,Stoyanov S,et al. The HMGB1 receptor RAGE mediates ischemic brain damage[J]. J Neurosci,2008,28(46):12023-12031.
[7]Xiong XX,Gu LJ,Shen J,et al. Probenecid protects against transient focal cerebral ischemic injury by inhibiting HMGB1 release and attenuating AQP4 expression in mice [J]. Neurochem Res,2014,39(1):216-224.
[8]Kim JB,Lim CM,Yu YM,et al. Induction and subcellular localization of high-mobility group box-1 (HMGB1) in the postischemic rat brain [J]. J Neurosci Res,2008,86(5):1125-1131.
[9]Kim JB,Sig Choi J,Yu YM,et al. HMGB1,a novel cytokine-like mediator linking acute neuronal death and delayed neuroinflammation in the postischemic brain [J]. J Neuroscie,2006,26(24):6413-6421.
[10]Ni F,Gong Y,Li L,et al. Flavonoid ampelopsin inhibits the growth and metastasis of prostate cancer in vitro and in mice [J]. PloS One,2012,7(6):e38802.
[11]Murakami T,Miyakoshi M,Araho D,et al. Hepatoprotective activity of tocha,the stems and leaves of Ampelopsis grossedentata,and ampelopsin [J]. Bio Factors,2004,21(1):175-178.
[12]Qi S,Xin Y,Guo Y,et al. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/NF-kappaB signaling pathways [J]. Inter Immunopharmacol,2012,12(1):278-287.
[13]Wang H,Bloom O,Zhang M,et al. HMG-1 as a late mediator of endotoxin lethality in mice [J]. Science,1999,285(5425):248-251.
[14]Liu K,Mori S,Takahashi HK,et al. Anti-high mobility group box 1 monoclonal antibody ameliorates brain infarction induced by transient ischemia in rats [J]. FASEB J,2007,21(14):3904-3916.
[15]Faraco G,Fossati S,Bianchi ME,et al. High mobility group box 1 protein is released by neural cells upon different stresses and worsens ischemic neurodegeneration in vitro and in vivo [J]. J Neurochem,2007,103(2):590-603.
[16]Huang JM,Hu J,Chen N,et al. Relationship between plasma high-mobility group box-1 levels and clinical outcomes of ischemic stroke [J]. J Critic Care,2013,28(5):792-797.
[17]Shin JH,Lee HK,Lee HB,et al. Ethyl pyruvate inhibits HMGB1 phosphorylation and secretion in activated microglia and in the postischemic brain [J]. Neurosci Let,2014,558:159-163.
[18]Henn A,Lund S,Hedtjarn M,et al. The suitability of BV2 cells as alternative model system for primary microglia cultures or for animal experiments examining brain inflammation [J]. Altex,2009,26(2):83-94.
[19]Oh YJ,Youn JH,Ji Y,et al. HMGB1 is phosphorylated by classical protein kinase C and is secreted by a calcium-dependent mechanism [J]. J Immunol,2009,182(9):5800-5809.
[20]Youn JH,Shin JS. Nucleocytoplasmic shuttling of HMGB1 is regulated by phosphorylation that redirects it toward secretion [J]. J Immunol,2006,177(11):7889-7897.
[22]Liu H,Yao YM,Yu Y,et al. Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages [J]. Shock,2007,27(1):55-60.
Inhibitory effects of ampelopsin on translocation and secretion of HMGB1 in BV2 microglial cells induced by LPS
LIU Yi,XU Yun,CAO Xiang.
(Department of Neurology,Drum Tower Hospital of Nanjing University Medical School,Nanjing,Jiangsu 210008,China)
Objective To investigate the effects of ampelopsin (AMP) on the nuclear/cytosolic translocation and secretion of high mobility group box1 (HMGB1) in BV2 cells induced by lipopolysaccharide (LPS). Methods Different concentrations of ampelopsin (10 μmol/L,30 μmol/L,50 μmol/L) were added to LPS-treated BV2 cells. The secretion level of HMGB1 was examined by specific Elisa assays. We further investigated whether ampelopsin could block HMGB1 translocation from nuclear to cytoplasm during LPS treatments. The effect of ampelopsin on HMGB1 phosphorylation was detected by co-immunoprecipitation. The expression of phosphorylated JAK2 and STAT3 were detected by Western blotting. Results Ampelopsin at the dose of 50 μmol/L markedly attenuated HMGB1 secretion after LPS treatment. The levels of nuclear HMGB1 were decreased and HMGB1 was accumulated in the cytoplasm after LPS. However,ampelopsin treatment obviously inhibited nucleus to cytoplasm translocation of HMGB1.Co-immunoprecipitation results showed that ampelopsin pretreatment blocked HMGB1 phosphorylation. Western blotting revealed that ampelopsin significantly down-regulated the phosphorylation of JAK2-STAT3 pathway in LPS-stimulated BV2 cells. Conclusion Pretreatment with ampelopsin before LPS suppressed HMGB1 secretion from activated microglia and its nuclear/cytosolic translocation through interfering with both JAK2/STAT3 signaling pathways and HMGB1 phosphorylation.
Ampelopsin; Lipopolysaccharide; BV2 cells; High mobility group box1
1003-2754(2016)11-0969-04
2016-09-15;
2016-10-04
国家自然科学基金(No. 81230026);南京大学中央高校基本科研项目(No. 021414380132);江苏省博士后科研资助计划(No. 1601009C)
(南京大学医学院附属鼓楼医院神经内科,江苏 南京 210008)
曹 翔,E-mail:xiangcao1988@163.com
R966
A

