基于高效液相色谱-四极杆/静电场轨道阱高分辨率质谱的寡糖轮廓分析用于蜂蜜中淀粉糖浆的掺假鉴别研究
张 睿,刘 芸*,丁 涛,吴 斌,沈崇钰,费晓庆,桂茜雯,王 艳,郭 玲,季美泉,王栩璐,邓晓军,郭德华
(1.江苏出入境检验检疫局,江苏 南京 210001;2.上海出入境检验检疫局,上海 200135)
基于高效液相色谱-四极杆/静电场轨道阱高分辨率质谱的寡糖轮廓分析用于蜂蜜中淀粉糖浆的掺假鉴别研究
张 睿1,刘 芸1*,丁 涛1,吴 斌1,沈崇钰1,费晓庆1,桂茜雯1,王 艳1,郭 玲1,季美泉1,王栩璐1,邓晓军2,郭德华2
(1.江苏出入境检验检疫局,江苏 南京 210001;2.上海出入境检验检疫局,上海 200135)
采用高效液相色谱-四极杆/静电场轨道阱高分辨率质谱(HPLC-Q/Orbitrap MS)建立了寡糖轮廓分析的方法。通过对纯天然蜂蜜和淀粉类糖浆中的麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖进行定性定量分析,发现淀粉类糖浆中含有未被酶解完全的微量麦芽类寡糖,且麦芽七糖在所有检测样本中干扰小,对结果的定量无影响,而其他寡糖类物质的定性和定量结果会存在干扰。最终选择麦芽七糖作为蜂蜜中掺入淀粉糖浆的典型标志物。在实际样品分析中,根据麦芽七糖的保留时间和离子对的相对丰度比可以定性判断蜂蜜中是否掺有淀粉糖浆;通过标准曲线法可以定量测定样液中麦芽七糖的含量。在20,50,100 mg/kg 3个加标水平下,麦芽七糖的平均回收率为75%~82%,相对标准偏差(RSD,n=5)为3.1%~6.7%,方法检出限为0.1 μg/mL。应用该方法可在10 min内完成整个分析过程,且样品前处理简单,结果可靠,灵敏度高,可用于纯天然蜂蜜中掺入淀粉糖浆的快速确证和检测。
蜂蜜掺假;寡糖轮廓分析;高效液相色谱-四极杆/静电场轨道阱高分辨率质谱
蜂蜜具有较高的营养价值和独有的芳香气味,因此,比其他甜味食品具有更高的价格。有些不法生产者为了获得更多的经济利益,而在纯天然蜂蜜中掺入其他糖类物质,消费者很难辨别真假。纯天然蜂蜜中掺入淀粉类糖浆(大米糖浆、玉米糖浆)是蜂蜜掺假中普遍存在的一种现象[1-2]。淀粉糖浆是红薯、玉米等植物淀粉通过水解、脱色等工业手段加工而成的粘稠液体,其糖分组成为葡萄糖、低聚糖等[3-4]。淀粉的水解在工业上称为转化,淀粉糖浆转化过程中通过采用不同的酸、酶或酸酶合并的工艺可以控制转化的葡萄糖和果糖的比例,可以与蜂蜜极为相似,从而达到以假乱真的程度。与天然蜂蜜相比,淀粉糖浆的价格却极为低廉。
针对蜂蜜中淀粉类糖浆的鉴定,现有的检测方法有稳定碳同位素法[5-7]、薄层色谱法[8-9]、离子色谱法[10-11]和气相色谱法[12-13]等。但现有检测标准方法在鉴定蜂蜜中的淀粉类糖浆时存在一定的缺陷,如稳定碳同位素法无法检测大米糖浆等C3植物糖浆的掺假;薄层色谱法测试样品的周期较长,且需检验员人为地通过比对颜色的深浅判断结果,客观性较大,易造成较大的偏差;离子色谱法则需测定蜂蜜中的寡糖从而判断蜂蜜中是否掺入淀粉类糖浆,其样品首先需要除去蜂蜜中的单糖,然后富集寡糖进行分析,前处理相当复杂,且离子色谱法的分析时间较长,分离度和灵敏度均较低,由于蜂蜜基质中杂质干扰较多,使得测定结果不够准确。因此很有必要建立能够高通量、简单、快速、高灵敏度和高准确度的方法筛查蜂蜜中是否掺入淀粉类糖浆。
本研究通过对纯天然蜂蜜和糖浆中的寡糖轮廓进行分析,以期找出灵敏的标志物用于准确判断蜂蜜中是否掺入淀粉类糖浆。但在寡糖轮廓分析的测定中存在几个问题:寡糖在蜂蜜中含量较低,且存在结构相似的碳水化合物和其它大量单糖的干扰。本研究所采用的高效液相色谱-四极杆/静电场轨道阱高分辨质谱,具有高灵敏度和强抗干扰能力的优势[14-16],蜂蜜样品经过简单的前处理后,直接对其中的寡糖轮廓进行分析,从而找到蜂蜜中掺入淀粉类糖浆的典型寡糖标记物。本方法具有前处理过程简便、分析时间短、测定结果准确等特点,可以准确、快速地判断蜂蜜中是否掺入淀粉糖浆。
1 实验部分
1.1 试剂与仪器
麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖(纯度均大于99.9%,Aldrich-Sigma公司);乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);乙腈、甲酸(色谱纯,德国Merck公司)。
四极杆静电场轨道阱高分辨质谱仪Q-Exactive(赛默飞世尔科技ThermoFisher Scientific公司),配备有HESI-Ⅱ源,液相色谱系统为Dionex Ultimate 3000高压液相色谱,自动进样器;X Calibur 2.2 软件用于仪器控制;Q Exactive(Tune)2.1 软件用于质谱控制,LC quanTM2.7软件用于后续的数据分析。所有实验用水均来自Milli-Q超纯水系统(美国);XW-80A型涡旋混合器(上海医科大学仪器厂);高速离心机(德国Sigma公司)。
1.2 标准溶液的配制
分别精密称取一定量的寡糖标准品,用纯水溶解,配制成1 mg/mL的标准储备液,密封保存于4 ℃冰箱中。分别精密量取上述5种单标准储备液适量,用乙腈-水(1∶1)稀释成5个标准浓度的工作溶液,于4 ℃冰箱中贮存,用于液相色谱和质谱条件的优化。
1.3 样品前处理
对无结晶的蜂蜜和糖浆样品,将其搅拌均匀,对有结晶的样品,在密闭情况下,置于不超过60 ℃的水浴中温热,振荡,待样品全部融化后搅匀,迅速冷却至室温。准确称取融化后的样品1.0 g(精确至0.01 g)置于适当刻度容器中,用水定容至10.0 mL,涡旋至溶解,适量上层清液与等体积乙腈混合均匀后,取混合溶液经0.22 μm的滤膜过滤至进样瓶中,供高效液相-四极杆静电场轨道阱高分辨质谱仪测定。
1.4 实验条件
色谱条件:色谱柱为Carbohydrate色谱柱(150 mm×4.6 mm,5 μm);流动相为0.1%甲酸水溶液(A)和乙腈(B),梯度洗脱程序为:0~2 min,35% A;2~2.5 min,35%~50% A;2.5~8.0 min,50% A;8.0~9.0 min,50%~35% A;9.0~12.0 min,35%A。流速:1.20 mL/min;进样量:25 μL;样品室温度:25 ℃。
质谱条件:可加热的电喷雾离子源(HESI-Ⅱ);毛细管温度为350 ℃,加热温度为320 ℃,鞘气(N2)流速50 psi,辅助气(N2)流速6 psi,吹扫气(N2)流速3 psi;喷雾电压为3 kV,透镜电压为50 V;采用正离子扫描的Target-MS2模式;Target-MS2扫描中分辨率R=17 500;AGC target:2×105;最大驻留时间:100 ms;分辨率:70 000;分离窗口:2.0m/z;强度阈值:4×104。
2 结果与讨论
2.1 液相色谱条件的优化
由于本研究是分析蜂蜜中的寡糖类化合物,寡糖类物质为高极性、多羟基类化合物,因此选择对大极性物质保留较好的色谱柱进行比较。以水和乙腈为流动相,分别对比了Agilent Carbohydrate柱(150 mm×4.6 mm×5 μm)、Phenomenex NH2柱(250 mm×4.6 mm×5 μm)和Agilent HILIC Plus(2.1 mm×100 mm,3.5 μm) 3种色谱柱对寡糖的分离能力。结果表明,在相同的液相色谱条件下,寡糖类物质在3种色谱柱上均有较好的保留,但Phenomenex NH2柱和HP Amide柱的耐用性相对较差,大批量样品分析后寡糖的色谱峰形和保留时间重现性下降,定性和定量准确性降低。因此,最终尝试Carbohydrate柱(150 mm×4.6 mm×5 μm)作为分析色谱柱。由于寡糖类化合物的极性均较强,首先采用乙腈-水流动相进行优化,发现寡糖类物质色谱峰峰形拖尾。进而采用乙腈-5 mmol/L乙酸铵溶液、乙腈-0.1 %甲酸作为流动相来优化寡糖分离条件。当流动相中加入适量乙酸铵溶液时,能够增强寡糖类物质在色谱柱上的保留,但峰形会拖尾;当流动相中加入少量甲酸时,寡糖的保留时间有所减弱但峰形更对称,正离子化效率明显增强,检测灵敏度提高,因此最终选用乙腈-0.1%甲酸作为流动相。
2.2 质谱条件的优化
通过流动注射方式(FIA)将5种寡糖类标准溶液直接注入质谱仪,对寡糖标准品进行全扫描检测,从而得到一级质谱图和准分子离子峰,准分子离子峰分别为[M+H]+和[M+Na]+,用准确质量数提取目标化合物的谱峰,结果发现[M+Na]+的信号响应值高于[M+H]+峰,最终选择[M+Na]+作为目标化合物的母离子进行分析,其准确分子质量如表1所示。实际分子量与理论分子质量偏差均小于5 ppm,表明Q-Orbitrap 高分辨质谱在理论质量数和实验质量数之间可以提供高的可信度。
采用Target-MS2模式进行分析,碰撞能量设置为30 eV,由Orbitrap质量分析器检测碎片离子,选取信号强度最强的两个离子碎片作为定性和定量离子。为得到寡糖类目标物的最高仪器响应值,基于所分析物质的色谱峰形,进行了质谱参数分辨率的优化。实验结果表明,在质量窗口设置为5 ppm 内,分辨率70 000为最佳的分析条件。最终优化后的母离子、定性和定量离子见表1。基于上述色谱质谱条件,麦芽三、四、五、六和七糖的提取离子流色谱图如图1A所示。

表1 麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖的质谱信息
*quantitative ion

2.3 蜂蜜和糖浆中寡糖的结果分析
纯天然蜂蜜的主要成分为葡萄糖、果糖和少量蔗糖,而掺假蜂蜜常使用淀粉类糖浆如大米糖浆和玉米糖浆,由于生产工艺的问题,会存在未水解完全的麦芽类寡糖,因此当天然蜂蜜中掺入淀粉类糖浆时,会有痕量的麦芽类寡糖存在。在检测分析时,麦芽类寡糖可作为掺假蜂蜜的特种标志物。采用上述优化的液相色谱-质谱条件,对纯天然蜂蜜、大米及玉米糖浆中的麦芽类寡糖进行检测。纯天然蜂蜜的提取离子流色谱图如图1B所示。
2.3.1 淀粉类糖浆中寡糖的检测分析 对实验室收集的10种大米糖浆和2种玉米糖浆,按照“1.3”的样品前处理步骤和“1.4”的实验条件进行分析。结果如表2所示,大米和玉米糖浆中麦芽三、四、五、六和七糖均有检出,其含量约在900~8 000 mg/kg之间,由于工艺中酶解温度、时间均会对淀粉糖浆生产过程中残留的麦芽寡糖含量产生影响,因此其含量在不同生产工艺和不同类型的淀粉类糖浆中并无规律性的趋势和变化。
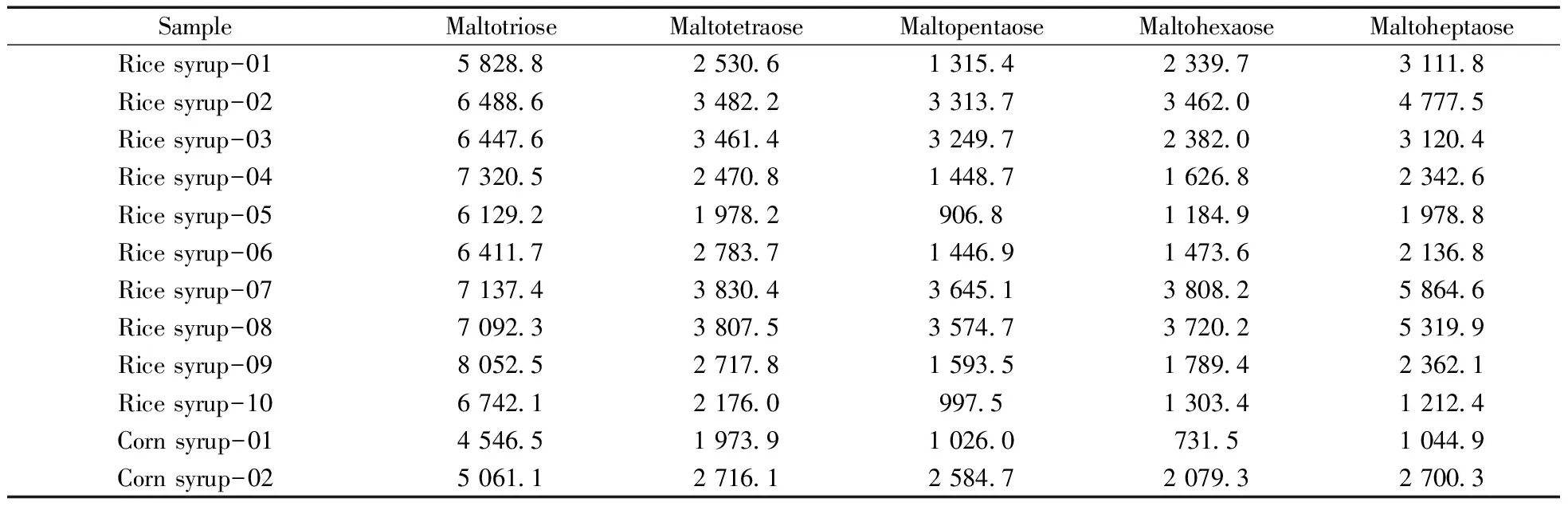
表2 大米糖浆和玉米糖浆中寡糖的含量分布(mg/kg)
2.3.2 纯天然蜂蜜中寡糖的检测分析 对来自新疆、内蒙、河南、江苏、山东、辽宁、四川、吉林、陕西、湖北和河北等地的油菜、洋槐、椴树、荆条和葵花共93个天然蜂蜜样本进行检测。结果发现上述天然蜂蜜中存在一些糖类的干扰物质,对麦芽三糖、四糖、五糖和六糖的定性和定量存在干扰,因此麦芽三糖、四糖、五糖和六糖无法作为是否掺入淀粉类糖浆的标志性物质进行定性和定量分析,而麦芽七糖在所有检测蜂蜜样本中干扰最小,对结果的定量分析基本无影响,因此实验最终选择麦芽七糖作为蜂蜜中外源性淀粉糖浆掺假鉴别的指标。
2.4 方法学的考察
2.4.1 线性范围及检出限 配制麦芽七糖的质量浓度分别为0.5,1.0,2.0,5.0,10,20 μg/mL的混合标准溶液,按优化实验条件进行测定,外标法定量。以麦芽七糖特征离子的质量色谱峰面积(y)为纵坐标,质量浓度(x,μg/mL)为横坐标,绘制标准曲线。结果显示,在0.5~20 μg/mL范围内,麦芽七糖的浓度与响应值呈良好的线性关系,线性方程为y=7.98×104x+2.67×102,相关系数(r2)为0.999。在空白天然蜂蜜样品中添加低浓度的目标化合物,麦芽七糖的检出限(S/N=3)为0.1 μg/mL,定量下限(S/N=10)为0.3 μg/mL。
2.4.2 回收率与精密度 在空白的天然油菜蜜、洋槐蜜和椴树蜜3种蜂蜜样品中添加麦芽七糖(20,50,100 mg/kg)标准溶液进行添加回收和精密度实验,每个水平制备9个平行样,结果见表3。结果表明,3种蜂蜜在3个水平的加标回收率为75%~82%,相对标准偏差(RSD,n=6)为3.1%~6.7%。说明该方法对不同品种和类型的蜂蜜样品均能够达到蜂蜜掺假鉴别的分析要求。
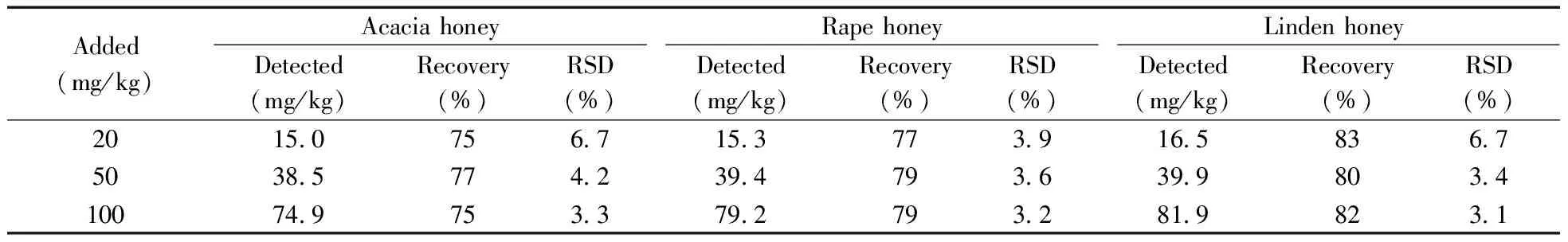
表3 3种蜂蜜中麦芽七糖的加标回收率及相对标准偏差(n=6)
2.5 实际蜂蜜样品掺入淀粉类糖浆的检测
采用上述高效液相色谱-四极杆/静电场轨道阱高分辨率质谱方法,通过对大量不同蜜种和不同产地蜂蜜中麦芽七糖含量的分析,发现有些蜂蜜会有微量麦芽七糖。在大量样本的基础上,同时结合仪器的检出限,确定该方法的判定限为3 μg/mL,设定为此浓度水平时不会导致假阳性。测定了实验室日常送检和抽检的50个蜂蜜样品,其中包括成熟蜂蜜和非成熟蜂蜜、单花蜜和多花蜜及不同蜜种和产地的蜂蜜。检出含有麦芽七糖的样品有32批,占64.0%。可见蜂蜜中非法添加淀粉糖浆的现象普遍存在,该方法可有效检出蜂蜜中是否掺有淀粉类糖浆。
3 结 论
本文针对目前造假蜂蜜中普遍使用淀粉类糖浆,以及缺乏准确和有效的检测方法,难以对市场进行有效监管的问题,建立了高效液相色谱-四极杆/静电场轨道阱高分辨率质谱联用的寡糖轮廓分析方法,通过测定淀粉类糖浆中未被酶解完全的微量麦芽类寡糖,从而找到了以麦芽七糖作为蜂蜜中掺入淀粉糖浆的标志物。样品经提取溶剂提取后直接进样测定,避免了复杂的前处理过程,应用本方法可在10 min内完成整个检测过程,大大提高了检测效率。在实际样品分析中,根据麦芽七糖的保留时间和离子对的相对丰度比可以定性判断蜂蜜中是否掺有淀粉糖浆,通过标准曲线法可以定量测定样液中麦芽七糖的含量。该方法完整性强、专属性好、可控性强、准确性高,可用于蜂蜜中淀粉糖浆的快速鉴别检测。
[1] Fei X Q,Wu B,Shen C Y,Ding T,Li L H,Lu Y.Chin.J.Chromatogr.(费晓庆,吴斌,沈崇钰,丁涛,李丽华,路颖.色谱),2011,29(1):15-19.
[2] Sivakesava S,Irudayaraj J.Int.J.FoodSci.Technol.,2002,37(4):351-360.
[3] Zeng Z H,Xu Z K,Zhou Y B,Xu J R.Mod.FoodSci.Technol.(曾洲华,徐正康,周彦斌,许建荣.现代食品科技),2005,21(2):171-179.
[4] Swallow K W,Low N H.J.Assoc.Off.Anal.Chem.,1994,77:695-702.
[5] Ordella C,Antinelli J F,Aurieres C,Faucon J P,Carbol-Bass D,Sbirrazzuoli N.J.Agric.FoodChem.,2012,50(1):203-208.
[6] White J W.J.AOACInt.,1992,75(3):543-548.
[7] Padovan G J,Jong D D,Rodrigues L P,Marchini J S.FoodChem.,2003,82(4):633-636.
[8] Liang Y,Wang S Y,Deng J S,Wu H.ApicultureChina(梁瑜,王圣义,邓劲松,吴辉.中国蜂业),2011,62(1):36-39.
[9] Shen C Y,Wu B,Fei X Q,Ding T,Li S Y.ApicultureChina(沈崇钰,吴斌,费晓庆,丁涛,李宋钰.中国蜂业),2011,(S7):61-64.
[10] Morales V,Corzo N,Sanz M L.FoodChem.,2008,107(3):922-928.
[11] Cordella C B,Militao J S,Clement M C,Cabrolbass D.J.Agric.FoodChem.,2003,51(11):3234-3242.
[12] Serra M L,Sanz J,Martinez-Castro I.J.Chromatogr.A,2004,1059(7):143-148.
[13] Lazaridou A,Biliaderis C G,Bacandritsos N,Sabatini A G.J.FoodEng.,2004,64(3):9-21.
[14] Gómez-Pérez M,Plaza-Bolaos P,Romero-González R,Martínez-Vidal J L,Garrido-Frenich A.J.Chromatogr.A,2012,1248(27):130-138.[15] Denisov E,Damoc E,Lange O,Makarov A.Int.J.MassSpectrom.,2012,325(3):80-85.
[16] Shi F,Guo C,Gong L,Li J,Dong P,Zhang J,Cui P,Jiang S,Zhao Y,Zeng S.J.Chromatogr.A,2014,1344(8):91-98.
Identification of Starch Syrup in Honey Adulteration Based on Oligosaccharide Profiling Test by High Performance Liquid Chromatography-Quadrupole/Electrostatic Field Orbitrap High Resolution Mass Spectrometry
ZHANG Rui1,LIU Yun1*,DING Tao1,WU Bin1,SHEN Chong-yu1,FEI Xiao-qing1,GUI Qian-wen1,WANG Yan1,GUO Ling1,JI Mei-quan1,WANG Xu-lu1,DENG Xiao-jun2,GUO De-hua2
(1.Jiangsu Entry-Exit Inspection and Quarantine Bureau,Nanjing 210001,China;2.Shanghai Entry-Exit Inspection and Quarantine Bureau,Shanghai 200135,China)
A method of oligosaccharide profiling test was developed based on high performance liquid chromatography-quadrurpole/ electrostatic field orbitrap high resolution mass spectrometry(HPLC-Q/Orbitrap MS).Through qualitative and quantitative analysis of maltotriose,maltotetraose,maltopentaose,maltohexaose and maltoheptaose in pure natural honey and starch syrup,trace of malt oligosaccharides that was not totally enzymatic hydrolyzed were found in starch syrup.Furthermore,the interference of maltoheptaose in all test samples was the smallest and had no impact on the quantitative analysis results.While,the qualitative or quantitative analysis of other oligosaccharides were interfered more or less.In the analysis of real samples,the starch syrup in honey adulteration could be judged by the retention time and relative abundance ratio of maltoheptaose,therefore the content of maltoheptaose in sample solution could be quantitatively determined through standard curve method.By adding standard test,the average recoveries of maltoheptaose at three spiked levels of 20,50 and 100 mg/kg were in the range of 75%-82% with relative standard deviations(RSD,n=5) of 3.1%-6.7%.The detection limit of this method was 0.1 μg/mL.The whole analysis time could be limited in 10 min.The method had the advantages of simple processing procedure,high accuracy,reliability,sensitivity,therefore it could be applied in the rapid detection of starch syrup in honey.
honey adulteration;oligosaccharide profiling test;high performance liquid chromatography-quadrurpole/electrostatic field Orbitrap high resolution mass spectrometry
2016-05-27;
2016-07-20
江苏出入境检验检疫局科技计划(2016KJ05);上海长三角科技合作项目(15395810100)
10.3969/j.issn.1004-4957.2016.12.020
O657.63;S896.1
A
1004-4957(2016)12-1628-06
*通讯作者:刘 芸,博士,高级工程师,研究方向:食品质量控制和掺假鉴别,Tel:025-52345183,E-mail:liuy4@jsciq.gov.cn

