大乌泡根总黄酮提取工艺优选*
孟 鑫, 刘 瑶, 陈 瑞, 蔡 进, 毛政益, 刘珈伲, 刘丽娜, 黄 静*
(贵州医科大学 药学院, 贵州 贵阳 550025)
大乌泡根总黄酮提取工艺优选*
孟 鑫**, 刘 瑶, 陈 瑞, 蔡 进, 毛政益, 刘珈伲, 刘丽娜, 黄 静***
(贵州医科大学 药学院, 贵州 贵阳 550025)
目的: 考察大乌泡根总黄酮的提取工艺。方法: 选取料液比、乙醇浓度、提取时间、提取温度为考察因素,以总黄酮得率为评价指标,采用正交试验对提取工艺进行优化,并用紫外分光光度法对大乌泡根总黄酮含量进行测定。结果: 大乌泡根总黄酮最佳提取工艺参数为料液比为1∶10,乙醇溶液体积分数为60%,提取时间为2 h,提取温度为70 ℃;该条件下测定大乌泡根总黄酮含量为4.8%。结论: 大乌泡根总黄酮含量的测定方法简便,准确可靠,为大乌泡药材质量控制提供基础。
中草药; 植物提取物; 大乌泡; 总黄酮; 正交试验
大乌泡为蔷薇科悬钩子属(RubusmultibroacteatusLevl&Vant.),以根及全株入药,性苦、凉,入脾、肝二经,全国大部分地区均有分布,主产于四川、云南、贵州等地,具清热解毒、祛风除湿、凉血、止血,接骨的功效,多用于治痢疾、腹泻、风湿痹痛、咳血、妇女倒经,骨折等[1-3]。目前,大乌泡已是上市中药制剂龋齿宁中的一味重要药材,用来治疗龋齿痛,牙周炎,牙龈炎[4]。大乌泡为苗药的常用药,曾有其总黄酮的含量测定[5]及大乌泡抗炎活性筛选[6]的报道,并从大乌泡正丁醇部位中分离出4个黄酮类化合物[7],黄酮类成分作为中草药重要的活性物质,具有抗氧化,抗炎,抗菌、抗病毒、保护心血管系统等方面的疗效[8-10]。目前尚未见对其根部总黄酮提取工艺条件研究的报道,本研究对大乌泡根总黄酮进行提取,通过正交实验方法对提取工艺进行探讨,同时对其总黄酮含量进行测定,为临床应用和产地加工提供科学依据。
1 材料与方法
1.1 材料
1.1.1 大乌泡 药材于2013年6月采自贵州凯里市,各试验样本由贵州医科大学中药学教研室龙庆德副教授鉴定为蔷薇科悬钩子属大乌泡(RubusmultibroacteatusLevl&Vant.)的干燥根。
1.1.2 仪器与试剂 UV-1750紫外分光光度计(岛津仪器有限公司), DFT-200手提式高速中药粉碎机(温岭市大得中药机械有限公司),EL204电子天平(梅特勒-托利多仪器上海有限公司),HH-2数显恒温水浴锅(常州澳华仪器有限公司),SHB-Ⅲ循环式多用真空泵(郑州长城科工贸易有限公司),SEF-OBR型回旋蒸发器(上海申生科技有限公司),D2F-OB型真空干燥箱(上海跃进医疗器械有限公司),芦丁标准品(中国食品药品鉴定所,批号100080-200707),其他试剂均为分析纯。
1.2 大乌泡根总黄酮含量测定
1.2.1 供试品溶液的制备 取大乌泡根茎适量,用手提式高速中药粉碎机粉碎成粉末,称定3.0 g,回流提取,减压浓缩(60 ℃)并定容至50 mL容量瓶中,得供试品溶液。
1.2.2 对照品溶液的制备 根据文献[11-12]和前期试验发现大乌泡根中含有黄酮类成分芦丁,故采用芦丁为标准品测定其所含黄酮类成分的含量。精密称取芦丁对照品10 mg,置于50 mL的容量瓶中,加入60%的乙醇溶解,定容至刻度,摇匀静置,即得芦丁对照品溶液。
1.2.3 测定波长的选择 称取芦丁对照品2 mg,置于10 mL容量瓶中,制成0.2 g/L的芦丁标准品溶液,之后采用加NaNO2-Al(NO3)3-NaOH染色法测定其最大波长,以相应试剂为空白,在400~700 nm波长范围内扫描以确定最大吸收波长。吸取样品溶液0.5 mL,同样采用NaNO2-Al(NO3)3-NaOH法测定大乌泡根中总黄酮吸收波长。最终结果显示芦丁与大乌泡根中总黄酮的最大吸收波长均为512 nm,其他成分对测定无干扰,故选择512 nm为最终大乌泡根总黄酮测定波长。
1.2.4 线性关系的考察 分别吸取上述芦丁标准溶液0.0、0.25、0.5、1.0、1.5及2.0 mL于6只10 mL的容量瓶中,先加入5 %亚硝酸钠溶液0.3 mL,摇匀,放置6 min;再加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min;然后加入1.0 mol/L氢氧化钠溶液4.0 mL,用60 %的乙醇稀释至10 mL,摇匀,放置10~15 min后,在512 nm波长处测定吸光度A。以芦丁溶液浓度C(mg/mL)为横坐标,分光光度法测定的吸光度A为纵坐标,绘制标准曲线。
1.3 方法学考察
1.3.1 精密度试验 精密吸取一定量标准品溶液,按“1.2.4项”同法操作,测定其吸光度值,并重复测定6次。
1.3.2 重复性试验 精密吸取一定量某一供试品溶液6份,按“1.2.4项”方法进行显色和测定,测定其吸光度。
1.3.3 稳定性试验 精密吸取一定量同一供试品溶液,按“1.2.4项”方法进行显色和测定,分别在15、30、45、60、90及150 min测定其吸光度。
1.3.4 加样回收率试验 精密称取芦丁对照品适量,加入已知含量的样品,称取样品6份,每份约30 mg,精密称定,按供试品溶液制备方法制成溶液6份,精密吸取供一定量供试品溶液,按“1.2.4项”方法测定总黄酮,计算其回收率。
1.4 正交试验优选提取工艺
根据文献报道[13-14]及大生产实际情况,影响黄酮提取效率的主要因素为提取溶剂的种类、浓度、提取温度与提取次数。依据黄酮的理化性质,选择影响提取的主要因素料液比、乙醇溶液体积分数、提取时间、 提取温度4个因素,每个因素选取3个水平,采用L9(34)正交试验,以总黄酮含量为考察指标。每个试验重复3次进行,正交试验因素水平见表1。

表1 大乌泡根总黄酮提取的因素及水平Tab.1 Factors and levels of flavonoids extraction in Rubus multibracteatus Levl & Vant.
1.5 样品黄酮含量
吸取供试品溶液0.2 mL,置于10 mL容量瓶中,参照“1.2.4项下”于512 nm处测定总黄酮。计算大乌泡根总黄酮含量(mg/g)=(C×V×N)/W。C为测量液总黄酮浓度(mg/mL),N为稀释倍数,V为粗提液体积(mL),W为药材干重(g)。
2 结果
2.1 线性关系考察
以芦丁溶液浓度C(mg/mL)为横坐标,分光光度法测定的吸光度A为纵坐标,绘制标准曲线,得回归方程为A=0.011×C-0.009,R2=0.999,表明芦丁对照品溶液浓度为10.9~87.2 g/L ,呈良好的线性关系。
2.2 方法学考察
精密度试验中,测定其吸光度值为0.405、0.403、0.416、0.394、0.395、0.401,相对标准偏差(RSD)为1.41%,表明仪器精密度良好。重复性试验中,其样品含量为4.68%、4.82%、4.78%、4.75%、4.60%、4.79%,相对标准偏差(RSD)为1.33%,表明试验重复性好。稳定性试验中,在15、30、45、60、90、150 min的吸光度值为0.405、0.403、0.416、0.394、0.495、0.401,相对标准偏差(RSD)值为1.41%,表明供试品在150 min内稳定。加样回收率实验结果见表2,平均加样回收率为99.22%,RSD值为1.02%,表明准确度符合试验要求。
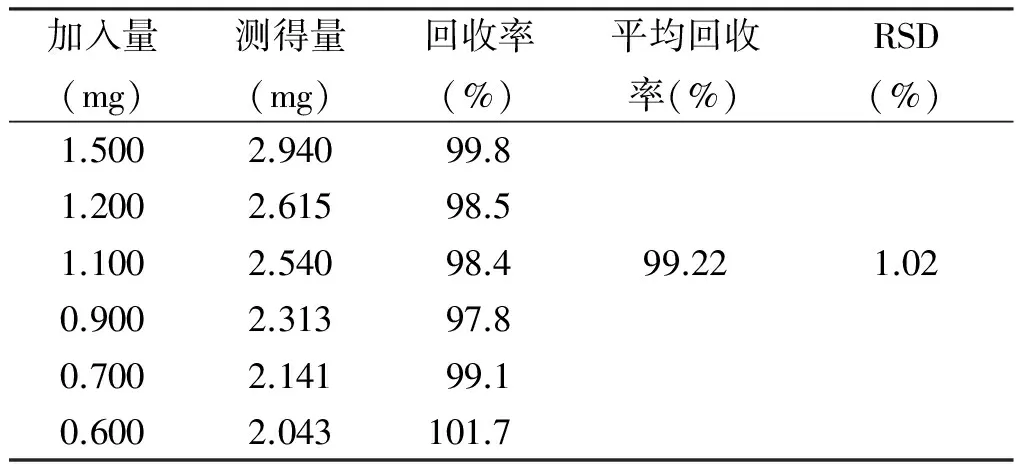
表2 加样回收率试验结果Tab.2 The results of spotting recovery
2.3 正交试验结果及样品黄酮含量
对正交试验设计表中的9个试验都分别进行3次的平行试验,并对试验提取所得的27份提取液中的总黄酮进行测定,见表3和表4。

表3 正交试验结果Tab.3 The results of orthogonal text

表4 正交试验方差分析Tab.4 ANOVA of orthogonal experiment
注:F0.05(2,18)=3.55 ,F0.01(2,18)=6.01(1)表示差异非常显著,F>F0.01(2,18)
结果表明,提取时间是影响提取条件的最主要因素,料液比影响次之,由直观分析确定并综合经济性和实验室条件等各因素考虑,最终确定最优方案为用料液比为1∶10,乙醇溶液体积分数为60%,提取时间为2 h,提取温度为70 ℃。并计算大乌泡根中总黄酮含量为4.8%。
3 讨论
正交试验法在研究药材有效部位提取工艺中有广泛应用,正交试验可以在最短时间,最节约成本的前提下简便有效的测定出药用植物的最佳提取工艺。本课题亦选用正交试验法对大乌泡根总黄酮的乙醇提取工艺进行筛选,以大乌泡根中总黄酮含量为指标对其乙醇加热回流提取工艺进行了筛选,实验结果显示大乌泡根总黄酮的最佳提取工艺为用料液比为1∶10,乙醇溶液体积分数为60%,提取时间为2 h,提取温度为70 ℃。大乌泡作为贵州苗族地区的常用药,但并没有被中国药典收录,本试验对大乌泡根中总黄酮的提取方法进行了考察并验证了其方法的可靠性,为大乌泡产地的种植及药用价值的开发提供依据,并为今后大乌泡质量标准的建立奠定了基础。
[1] 邱德文,杜江.中华本草苗药卷[M].贵阳:贵州科技出版社, 2005:62.
[2] 贵州省药品监督管理局编委.贵州省中药材、民族药材质量标准[M].贵阳:贵州科技出版社, 2003:30.
[3] 汪毅,司晓文,夏同珩,等.中国苗族药物彩色图集[M].新疆:新疆科学技术出版社, 2003:57.
[4] 徐树芸.贵州十种民族药的应用研究[J].世界科学技术-中医药现代化, 2006(6):73-78.
[5] 程伟,秦文杰,陈索红,等.大乌泡叶中总黄酮含量测定[J].中国中医药信息杂志, 2009(9):42-43.
[6] 李天平,张彦民,李淼,等.大乌泡抗炎活性成分的筛选及GC/MS分析[N].2009年药物分析论文汇总, 2009:221-225.
[7] 熊山.中药楮实子及大乌泡的化学成分研究[D].贵州:贵阳中医学院, 2009:1-3.
[8] 聂彝,余陈欢,王芳芳,等.石荠芋总黄酮抗炎作用及其机制研究[J].时珍国医国药, 2008(1):65-66.
[9] 宣以巍,刘英,江萍,等.柑橘类黄酮的生理活性及其研究现状[J].科技通报, 2008(4):494-497.
[10]陈丛瑾,王琪,李欣.黄酮类化合物抗氧化和抑菌生物活性研究进展[J].中国药房, 2011(35):3346-3348.
[11]刘文丽,余鲁海,马燕.紫外分光光度法在黄酮类化合物含量测定中的应用[J].新疆中医药, 2006(3):85-86.
[12]王向军.两头毛中总黄酮提取工艺[J].中国实验方剂学杂志, 2011(13):50-52.
[13]陈琦.正交试验优化羊蹄总黄酮提取工艺[J].中国医药指南, 2010(25):12-13.
[14]徐保利,管慧洁,王冰,等.棉灯笼果实总黄酮提取工艺[J].中国实验方剂学杂志, 2011(21):33-35.
(2016-09-13收稿,2016-11-26修回)
中文编辑: 刘 平; 英文编辑: 刘 华
Technology Optimization for Extracting Total Flavonoids from the Root ofRubusmultibracteatusLevl & Vant.
MENG Xin, LIU Yao, CHEN Rui, CAI Jin, MAO Zhengyi, LIU Jiani, LIU Lina, HUANG Jing
(CollegeofPharmacy,GuizhouMedicalUniversity,Guiyang550025,Guizhou,China)
Objective: To explore the extraction process of total flavonoids in the root ofRubusmultibracteatusLevl & Vant. Methods: The solid-liquid ratio, ethanol concentration, extraction time, extraction temperature were selected as factors and the yield of total flavonoids as evaluation index. The extraction process was optimized by orthogonal test, and the content of total flavonoids in the root ofRubusmultibracteatusLevl & Vant was determined by UV spectrophotometry. Results: The optimum parameters of extraction process of total flavonoids from the root ofRubusmultibracteatusLevl & Vant was a follow: solid-liquid ratio 1∶10, ethanol volume fraction 60%, extraction time 2 h, extraction temperature 70 ℃. Under above condition, the content of total flavonoids from the root ofRubusmultibracteatusLevl & Vant was 4.8%. Conclusion: The method is practical, accurate and reliable, and can be used as quality control method ofRubusmultibracteatusLevl & Vant.
drug,Chinese herbal; plants extracts;RubusmultibracteatusLevl & Vant.; total flavonoids; orthogonal experiment
贵州省科技厅中药攻关项目[黔科合ZY(2011)3005]
时间:2016-12-15
http://www.cnki.net/kcms/detail/52.1164.R.20161215.1534.001.html
R285.1
A
1000-2707(2016)12-1411-04
10.19367/j.cnki.1000-2707.2016.12.010
**贵州医科大学2012级硕士研究生
***通信作者 E-mail:huangjgy@sohu.com

