miR⁃29s家族对人脑胶质瘤干细胞生物学行为的影响
奚卓,薛一雪,马珺,刘云会
(中国医科大学1.附属盛京医院神经外科,沈阳 110004;2.基础医学院神经生物学教研室,沈阳 110122)
miR⁃29s家族对人脑胶质瘤干细胞生物学行为的影响
奚卓1,薛一雪2,马珺2,刘云会1
(中国医科大学1.附属盛京医院神经外科,沈阳 110004;2.基础医学院神经生物学教研室,沈阳 110122)
目的 研究miR⁃29s家族在胶质瘤干细胞(GSCs)中的表达水平,以及对GSCs生物学行为的影响是否存在差异。方法8例胶质瘤患者术中取肿瘤标本,制备成GSCs。应用实时PCR方法检测miR⁃29a、miR⁃29b和miR⁃29c的内源性表达。CCK⁃8方法检测GSCs增殖,Transwell小室方法检测GSCs的迁移侵袭,流式细胞仪检测GSCs的凋亡。结果 miR⁃29a、miR⁃29b和miR⁃29c在GSCs中低表达,外源性提高表达量后,可以抑制GSCs的增殖、迁移和侵袭能力,促进GSCs的凋亡。结论 miR⁃29s家族在GSCs中起抑癌基因的作用,家族成员中以miR⁃29a的抑癌能力最强且起到主导作用。
胶质瘤干细胞;miR⁃29a;miR⁃29b;miR⁃29c;生物学行为
多形性胶质母细胞瘤是胶质瘤中恶性程度最高、侵袭性最强、最易复发的一种[1],目前标准的治疗方法是手术切除联合放、化疗,但患者的5年生存率仍不足5%[2]。胶质瘤干细胞(glioma stem cells,GSCs)是胶质瘤细胞中的少数亚群细胞,具有自我更新、多向分化及无限增殖的能力。
miR⁃29s家族有miR⁃29a、miR⁃29b和miR⁃29c,在不同肿瘤组织中作用不同[3⁃4]。在人脑胶质瘤组织中,miR⁃29s为抑癌基因,miR⁃29a和miR⁃29c可以抑制胶质瘤细胞的增殖、迁移和侵袭能力[5]。因为GSCs与胶质瘤的复发及侵袭性生长存在密切关系,所以本研究希望通过检测miR⁃29s在GSCs中的表达以及其家族成员对GSCs生物学行为的影响,为研究GSCs的靶向治疗提供更多的理论依据。
1 材料与方法
1.1 组织来源
8例胶质瘤组织均取自2015年中国医科大学附属盛京医院第一神经外科手术患者,其中男5例,女3例,年龄26~67岁,4例位于顶叶,2例位于额叶,2例位于颞叶。术后病理:5例为多形性胶质母细胞瘤,3例为间变性星形细胞瘤。所有患者均为首次发病,术前未接受放、化疗,手术均为开颅切除,术中选择未坏死、未囊变的肿瘤组织。术后病理均由中国医科大学附属盛京医院病理科诊断。8例患者针对手术及研究均签署知情同意书,研究方案由中国医科大学附属盛京医院伦理委员会审查通过。
1.2 GSCs的分离和培养
胶质瘤组织术中取出后,放入PBS缓冲液,于冰盒中转运至实验室。无菌条件下取肿瘤组织(约1 cm3),反复PBS冲洗,剪切成碎块至乳糜状,胰酶消化、过滤,后予以1 000g5 min离心,弃上清。组织团块应用GSCs培养液重悬,并放入悬浮培养瓶中继续培养。GSCs培养液包括:无血清的DMEM/F12培养液,其中添加20 ng/mL碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),20 ng/mL表皮生长因子(epidermal growth factor,EGF)和2%B27。细胞置于37℃、5%CO2恒温培养箱中培养。经过近2周的培养,细胞球形成,而残留在瓶中的未形成细胞球的细胞为非胶质瘤干细胞(non⁃glioma stem cells,non⁃GSCs)。目前研究[6]已经针对干细胞的分化和增殖能力进行鉴定,因为实验方法相同,本研究未再进行鉴定。
1.3 RNA的提取和实时荧光定量PCR
总RNA应用Trizol reagent从GSCs及non⁃GSCs中提取,RNA样品稀释后测定RNA浓度。然后应用Taqman MicroRNA Reverse Transcription Kit将RNA反转录,应用TaqMan Universal Master MixⅡ和Taq⁃Man MicroRNA Assay(miR⁃29a、miR⁃29b、miR⁃29c和U6)进行实时荧光定量PCR。应用7500 Fast Real⁃Time PCR System测定CT值,以U6为内参照,以2-ΔΔCt表示mRNA的相对表达量。
1.4 miR⁃29s的瞬时转染
miR⁃29a、miR⁃29b和miR⁃29c对应的miRNA激动剂和其阴性对照(nonsense scrambled sequence,Scr)均由上海吉玛公司合成。应用Lipofectamine 3000 reagent(Life Technologies Corporation,Carls⁃bad,CA,USA)将miR⁃29s miRNA激动剂和其阴性对照转染至GSCs中,得到过表达miR⁃29s的GSCs,然后应用qRT⁃PCR检测miR⁃29a、miR⁃29b和miR⁃29c的转染效率,实验分为:未转染的GSCs组(Control组),转染阴性对照的GSCs组(Scr组),转染miR⁃29a miRNA激动剂组(pre⁃miR⁃29a组),转染miR⁃29b miRNA激动剂组(pre⁃miR⁃29b组),转染miR⁃29c miRNA激动剂组(pre⁃miR⁃29c组)。
1.5 GSCs增殖能力检测
应用CCK⁃8方法(Cell Counting Kit⁃8,中国南通碧云天公司),检测过表达miR⁃29a、miR⁃29b和miR⁃29c后,GSCs增殖能力的变化。将成球的GSCs应用胰酶消化成单细胞悬液,以100 μL、3 000/孔接种于96孔悬浮细胞培养板中,每组设5个副孔,转染48 h后每孔加入10 μL的CCK⁃8溶液,避光孵育3 h,在450 nm波长处检测光密度值。
1.6 GSCs迁移侵袭能力的检测
GSCs的迁移和侵袭能力实验应用Transwell小室(8 μm孔径)进行检测。瞬转48 h的GSCs,应用胰酶消化成单球,1 000g5 min离心,弃上清,用100 μL GSCs培养液重悬,细胞计数20 000/mL,并加入小室的上室,下室则加入600 μL含10%胎牛血清的培养基。细胞置于37℃、5%CO2的恒温培养箱中培养24 h。后将小室取出,PBS中轻轻涮洗小室,小室内面用棉签轻轻擦拭。配置固定液:甲醇∶冰乙酸= 3∶1。将小室于固定液中固定30 min,再次应用PBS涮洗,吉姆萨染色30 min。然后将小室洗净,置于倒置显微镜下观察,并计数5个随机视野的细胞数做均值计数。GSCs侵袭实验中,步骤与迁移实验步骤相似,但小室上室铺细胞之前需要涂盖500 ng/μL的Matrigel胶,37℃放置4 h。
1.7 GSCs凋亡能力的检测
应用流式细胞仪检测miR⁃29s过表达后对GSCs凋亡能力的影响。瞬转48 h后的GSCs以1 000g5 min离心,然后用PBS洗涤2次,相同转数离心,弃上清。然后用Annexin V⁃FITC/PI kit凋亡检测试剂盒进行检测,首先加入500 μL工作液重悬细胞,然后加入5 μL FITC及PI,室温,避光反应15 min。最后使用流式细胞仪分析样品,使用CELLQuest 3.0软件分析实验数据。统计分析时采用右侧上、下象限百分数的和代表总的凋亡率。
1.8 统计学分析
数据以x±s表示。采用SPSS 18.0统计软件对实验数据进行统计分析。2组间采用t检验,多组间采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR⁃29s在正常胶质细胞中的表达
在正常胶质细胞中,相对于miR⁃29a,miR⁃29b和miR⁃29c的表达量显著减少(P均<0.01),见图1A。
2.2 miR⁃29s在GSCs中低表达
与non⁃GSCs比较,miR⁃29a、miR⁃29b和miR⁃29c在GSCs中均呈低表达(P<0.01,P<0.01,P<0.05),且将non⁃GSCs的表达统一后,miR⁃29a在GSCs中的表达相对于其他2个家族成员,表达量更低。但与正常胶质细胞比较,miR⁃29a、miR⁃29b和miR⁃29c在non⁃GSCs中的表达无统计学差异,见图1B。
2.3 过表达miR⁃29s后转染效率的验证
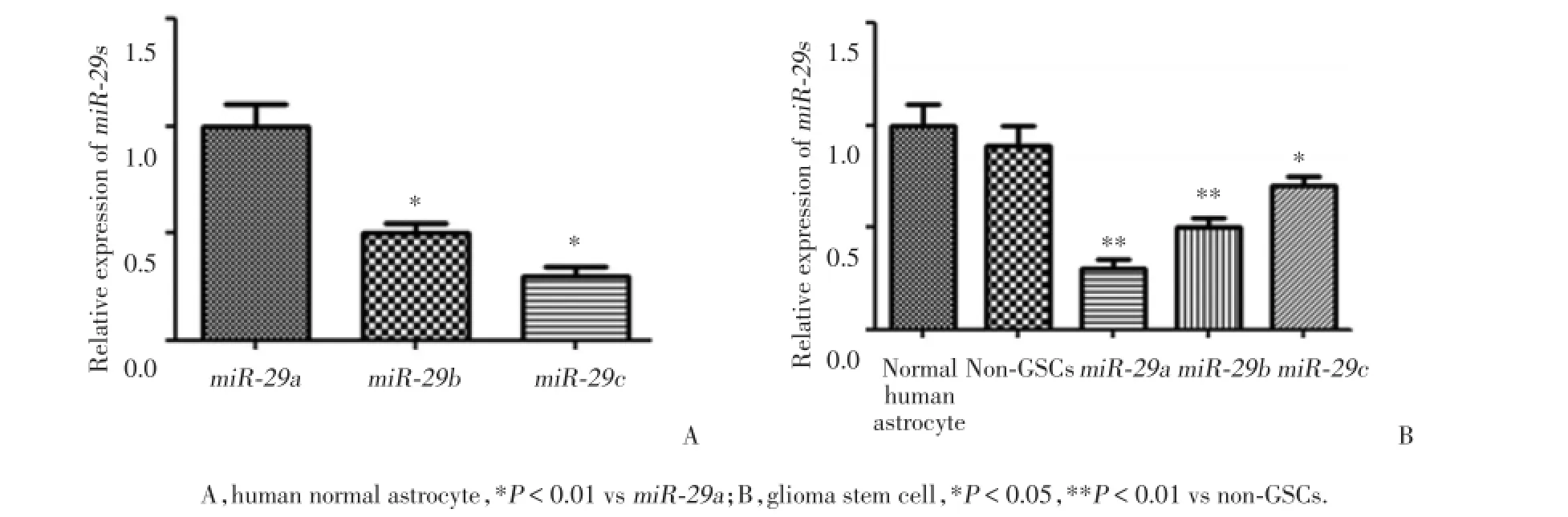
图1 miR⁃29a,miR⁃29b和miR⁃29c在正常胶质细胞和GSCs中的内源性表达(n=5)Fig.1 The expression of miR⁃29a,miR⁃29b and miR⁃29c in the human normal astrocytes and glioma stem cell(n=5)
瞬时转染miR⁃29a、miR⁃29b和miR⁃29c各自对应的miRNA激动剂以及共同的阴性对照Scr后,应用实时PCR进行转染效率的验证,结果显示转染48 h后,转染效率最高,见图2A。
2.4 过表达miR⁃29s后抑制GSCs的增殖
相对于Scr组,过表达miR⁃29a、miR⁃29b和miR⁃29c后均可抑制GSCs的增殖能力(P<0.01,P<0.01,P<0.05),且以miR⁃29a抑制的最明显,而Con⁃trol组与Scr组之间无统计学差异。见图2B。
2.5 过表达miR⁃29s后抑制GSCs的迁移侵袭
当GSCs中miR⁃29a、miR⁃29b和miR⁃29c外源性表达升高后,GSCs的迁移(P均<0.01)和侵袭(P<0.01,P<0.01,P<0.05)能力均受到抑制,且家族成员中仍以miR⁃29a的抑制效果最明显,miR⁃29c的抑制能力最差。见图2C。
2.6 过表达miR⁃29s后促进GSCs的凋亡
将miR⁃29a、miR⁃29b和miR⁃29c各自的miRNA激动剂转染至GSCs中,使细胞中miR⁃29a、miR⁃29b和miR⁃29c的表达量升高后,会明显促进GSCs的凋亡(P均<0.01),且以miR⁃29a促进的最明显(36%),相对于Scr组(11.8%),提高了(24.2%)。见图2D。
3 讨论
很多研究者认为,miRNAs在GSCs中的异常表达以及它们对GSCs生物学行为的影响可能与胶质瘤的发生发展有关,例如miR⁃101、miR⁃152、miR⁃330和miR⁃145等[7⁃10]。在不同肿瘤组织中,miR⁃29s家族功能不同,甚至在同一疾病中的功能也不相同[11⁃12]。在人脑胶质瘤中,miR⁃29s家族为低表达,且均起抑癌基因的作用,但miR⁃29s家族在GSCs中的表达以及家族成员之间对GSCs生物学行为的影响尚不明确。本研究结果发现相对于non⁃GSCs,miR⁃29s家族各个成员在GSCs中也为低表达,且以miR⁃29a表达下降最为明显,此结果与miR⁃29s家族在胶质瘤细胞系中的表达一致。外源性增强miR⁃29a、miR⁃29b和miR⁃29c的表达后,GSCs的增殖、迁移、侵袭能力受到抑制,而GSCs凋亡受到促进,结果说明miR⁃29s家族在GSCs中确实起到抑癌基因的作用。
本研究结果显示,相对于miR⁃29b和miR⁃29c,外源性提高miR⁃29a的表达后,可以更明显的抑制GSCs的增殖、迁移侵袭,促进细胞凋亡。说明miR⁃29a在GSCs中的抑癌作用更显著。为了解释这个现象,在人正常胶质细胞中检测了miR⁃29a、miR⁃29b和miR⁃29c的内源性表达,结果显示miR⁃29a的表达明显高于miR⁃29b和miR⁃29c。与本研究结果相同,miR⁃29a被证实在正常乳腺细胞中主要表达,且功能上在miR⁃29s家族中也起主导作用[13]。所以,在GSCs中,miR⁃29a在miR⁃29s家族的抑癌作用中起主导作用。在miR⁃29s家族影响胶质瘤细胞生物学行为机制研究方面,目前针对miR⁃29a、miR⁃29b和miR⁃29c的研究很多,如miR⁃29a和miR⁃29c可以通过影响CDC42的表达来抑制细胞的增殖、迁移、侵袭[14⁃15],但在GSCs中的机制研究暂时没有。
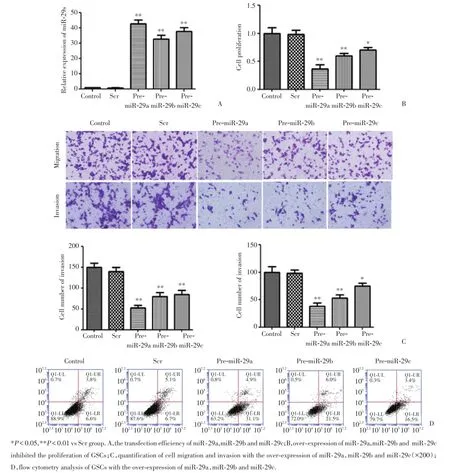
图2 miR⁃29a、miR⁃29b和miR⁃29c转染效率的验证及过表达miR⁃29a、miR⁃29b和miR⁃29c后对GSCs生物学行为的影响(n=5)Fig.2 The transfection efficiency of miR⁃29a,miR⁃29b,miR⁃29c and over⁃expression of miR⁃29a,miR⁃29b and miR⁃29c influence the bi⁃ological behaviors of GSCs(n=5)
综上所述,miR⁃29s家族在GSCs中低表达,且发挥抑癌基因的作用,家族成员中以miR⁃29a的抑癌能力最强且发挥主导作用。但miR⁃29s家族影响GSCs生物学行为的机制,还需在后续的实验中进行研究。希望目前的研究可以为进一步研究miR⁃29s家族在胶质瘤发生发展过程中所起的作用提供参考,并为研究GSCs的功能提供理论支持。
[1]LOUIS DN,OHGAKI H,WIESTLER OD,et al.The 2007 WHO classification of tumors of the central nervous system[J].Acta Neuropathol,2007,114(2):97-109.DOI:10.1007/s00401⁃007⁃0278⁃6.
[2]DAVIS ME.Glioblastoma:overview of disease and treatment[J]. ClinJOncolNurs,2016,20(5):S2-8.DOI:10.1188/16.CJON.S1.2⁃8.
[3]MUNIYAPPA MK,DOWLING P,HENRY M,et al.miRNA⁃29a reg⁃ulates the expression of numerous proteins and reduces the invasive⁃ness and proliferation of human carcinoma cell lines[J].Eur J Can⁃cer,2009,45(17):3104-3018.DOI:10.1016/j.ejca.2009.09.014.
[4]GEBESHUBER CA,ZATLOUKAL K,MARTINEZ J.miR⁃29a sup⁃presses tristetraprolin,which is a regulator of epithelial polarity and metastasis[J].EMBO Rep,2009,10(4):400-405.DOI:10.1038/ embor.2009.9.
[5]XU H,SUN J,SHI CJ,et al.miR⁃29s inhibit the malignant behavior of U87MG glioblastoma cell line by targeting DNMT3A and 3B[J]. Neurosci Lett,2015,17(590):40-46.DOI:10.1016/j.neulet.2015. 01.060.
[6]YAO YL,MA J,XUE YX,et al.miR⁃449a exerts tumor⁃suppressive functions in human glioblastoma by targeting myc⁃associated zinc⁃finger protein[J].Mol Oncol,2015,9(3):640-656.DOI:10.1016/ j.molonc.2014.11.003.
[7]YAO YL,MA J,WANG P,et al.miR⁃101 acts as a tumor suppres⁃sor by targeting Kruppel⁃like factor 6 in glioblastoma stem cells[J]. CNS Neurosci Ther,2015,21(1):40-51.DOI:10.1111/cns.12321.
[8]MA J,YAO Y,WANG P,et al.miR⁃152 functions as a tumor sup⁃pressor in glioblastoma stem cells by targeting Kruppel⁃like factor 4[J].Cancer Let,2014,355(1):85-95.DOI:10.1016/j.canlet.2014. 09.012.
[9]SHI L,WANG Z,SUN G,et al.miR⁃145 inhibits migration and inva⁃ sion of glioma stem cells by targeting ABCG2[J].Neuromolecular Med,2014,16(2):517-528.DOI:10.1007/s12017⁃014⁃8305⁃y.
[10]YAO Y,XUE Y,MA J,et al.miR⁃330⁃mediated regulation of SH3GL2 expression enhances malignant behaviors of glioblastoma stem cells by activating ERK and PI3K/AKT signaling pathways[J].PLoS One,2014,9(4):e95060.DOI:10.1371/journal.pone. 0095060.
[11]ZHAO JJ,LIN J,LWIN T,et al.microRNA expression profile and identification of miR⁃29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma[J].Blood,2010,115(13):2630-2639.DOI:10.1182/blood⁃2009⁃09⁃2431 47.
[12]HAN YC,PARK CY,BHAGAT G,et al.microRNA⁃29a induces aberrant self⁃renewal capacity in hematopoietic progenitors,biased myeloid development,and acute myeloid leukemia[J].J Exp Med,2010,207(3):475-489.DOI:10.1084/jem.20090831.
[13]WU ZL,HUANG XN,HUANG X,et al.The inhibitory role of mir⁃29 in growth of breast cancer cells[J].J Exp Clin Cancer Res,2013,1(32):98.DOI:10.1186/1756⁃9966⁃32⁃98.
[14]石翠娟,王影,于士柱,等.胶质瘤miR⁃29c表达异常减少及其对肿瘤细胞增殖的影响[J].中国肿瘤临床,2015,42(1):47-52. DOI:10.3969/j.issn.1000⁃8179.20141817.
[15]王影,孙静,李艳艳,等.miR⁃29a对胶质瘤细胞CDC42表达及迁移和侵袭的影响[J].中国肿瘤临床,2013,40(11):629-633. DOI:10.3969/j.issn.1000⁃8179.2013.11.004.
(编辑 于 溪)
Effects of miR⁃29s Family on the Biological Behaviors of Glioma Stem Cells
XI Zhuo1,XUE Yixue2,MA Jun2,LIU Yunhui1
(1.Department of Neurosurgery,Shengjing Hospital,China Medical University,Shenyang 110004,China;2.Department of Neurobiology,College of Basic Medical Science,China Medical University,Shenyang 110122,China)
Objective To investigate the expression of miR⁃29s in the glioma stem cells,and explore how the members of miR⁃29s affect the bio⁃logical behaviors of glioma stem cells.Methods Eight patient specimens were used to culture glioma stem cells.Real⁃time PCR was adopted to test the expression of miR⁃29s.CCK⁃8 analysis was performed to test the proliferation,Transwell was used to test cell migration and invasion,and flow⁃cytometry analysis was carried out to test apoptosis.Results miR⁃29a,miR⁃29b and miR⁃29c were decreased in glioma stem cells.Over⁃ex⁃pression of miR⁃29s could inhibit the proliferation,cell migration and invasion,but promote apoptosis of glioma stem cells.Conclusion miR⁃29s acts as a cancer suppressor gene in the glioma stem cells,and miR⁃29a plays the dominant functional role in the family.
glioma stem cells;miR⁃29a;miR⁃29b;miR⁃29c;biological behaviors
R739.41
A
0258-4646(2017)03-0201-04
10.12007/j.issn.0258⁃4646.2017.03.003
国家自然科学基金(81672511,81573010);辽宁省科学技术计划(2015225007);中国医科大学附属盛京医院自由研究者计划(201304)
奚卓(1984-),男,主治医师,博士.
刘云会,E-mail:liuyh_cmuns@163.com
2016-09-26
网络出版时间:

