急性心肌梗死患者血浆胸腺素β4水平动态变化的临床意义
周新润,张明超,柯永胜,贾亮亮,田塬,王纯田
急性心肌梗死患者血浆胸腺素β4水平动态变化的临床意义
周新润,张明超,柯永胜,贾亮亮,田塬,王纯田
目的:观察急性心肌梗死(AMI)患者在干预治疗下发病后15天内血浆胸腺素β4(Tβ4)水平动态变化趋势,探讨AMI患者血浆Tβ4水平与其临床预后的关系。
心肌梗死;胸腺素;预后
(Chinese Circulation Journal, 2017,32:31.)
胸腺素β4(Tβ4)是一种由43个氨基酸残基组成的小分子水溶性蛋白,由Low等[1]最早从小牛胸腺中提取出来,以N-acetyl-seryl-aspartyl-lysylproline(AcSDKP)为其N-端代表结构。Tβ4在β族胸腺素中含量最多、分布最广,广泛分布于除红细胞外的所有真核细胞中[2]。大量研究已经证实,Tβ4具有促进干细胞分化、增强细胞增殖、迁移能力、抗细胞凋亡、促进血管形成等多种生物学功能,与组织再生、血管生成、创伤愈合、肿瘤转移、角膜、神经及心肌修复等生物学反应均有密切联系。在心血管领域,Tβ4能促进内皮细胞增殖、分化、迁移及血管形成,对改善缺血心肌供血、减轻心肌损伤、促进心肌组织修复等方面均发挥重要作用[3,4]。然而有关Tβ4在心脏保护方面的临床研究仍然相对较少,急性心肌梗死(AMI)患者血浆Tβ4水平的动态变化趋势以及体内Tβ4的表达水平与AMI的临床预后之间的关系均鲜见报道。本研究旨在探讨AMI患者在干预治疗下其内源性Tβ4表达水平的变化趋势及Tβ4高表达的临床意义,为进一步深入研究Tβ4对缺血心肌的保护作用提供理论基础。
1 资料与方法
1.1 研究对象
入选2013-10至2014-06入住皖南医学院弋矶山医院心内科并明确诊断为AMI的患者69例作为实验组,男52例,女17例,年龄36~84岁,平均年龄(62.4±9.7)岁。其中,接受直接经皮冠状动脉介入治疗(pPCI)者32例,接受延期经皮冠状动脉介入治疗(dPCI)者26例,给予优化药物治疗(OMT)者11例。另选取胸痛但经冠状动脉造影(CAG)明确排除冠状动脉狭窄的患者33例作为对照组,男16例,女17例,年龄31~77岁,平均年龄(56.5±9.7)岁。所有研究对象均签署知情同意书。
排除对象:(1)合并有慢性阻塞性肺病、慢性肾功能不全、甲状腺功能亢进、结缔组织病、肿瘤等其它疾病者;(2)合并有肺原性心脏病、风湿性心脏病、心脏瓣膜病、甲亢性心脏病、先天性心脏病、心肌炎、心肌病等心原性疾病者;(3)入院前1个月内有急性脑梗死病史、外伤史或行外科手术者;(4)住院期间死亡者;(5)住院期间及随访期内未按医嘱规范化治疗者。
1.2 研究方法
记录两组患者的住院号、联系方式、姓名、性别、年龄、吸烟史、家族史(是否有高血压病、糖尿病、脑梗死、高脂血症等合并症),入院时第2天清晨检测空腹血糖(FPG)、甘油三脂(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血尿酸(BUA)等生化指标及体重指数(BMI)、左心室射血分数(LVEF)等基本信息。收集所有受试者入院时及实验组患者发病15天内每天清晨空腹静脉血3 ml于5 ml真空肝素钠抗凝采血管中。所有血液标本在室温下用高速离心机以3 000 r/min离心20 min后提取上清液(血浆),并采用酶联免疫吸附法(ELISA)检测血浆Tβ4水平。采用电话随访或门诊随访的方式对实验组患者进行为期18个月的随访。随访终点为出院后18个月或随访期内发生主要不良心脏事件(MACE)。MACE定义为:复发心绞痛、靶血管血运重建、严重心律失常、非致死性心肌梗死、心力衰竭、心原性死亡。
1.3 统计学分析
使用SPSS17.0统计软件进行统计学分析,正态分布的计量资料以均数±标准差表示,两样本比较采用t检验,方差齐性检验采用F检验;计数资料以构成比表示,比较采用χ2检验及Fisher确切概率法;各研究变量与患者随访期内是否发生MACE之间的关系采用Logistic回归分析;以P<0.05为差异有统计学意义,以P<0.01为差异有显著统计学意义。
2 结果
2.1 患者一般临床资料比较(表1)
与对照组比较,实验组患者的男性构成比、年龄、BMI、吸烟史构成比、合并症构成比及FPG、TC、LDL-C等生化指标明显升高,HDL-C、LVEF明显降低,差异均有统计学意义(P<0.05),家族史及TG、
BUA等生化指标差异均无统计学意义(P>0.05)。
表1 两组患者一般临床资料比较
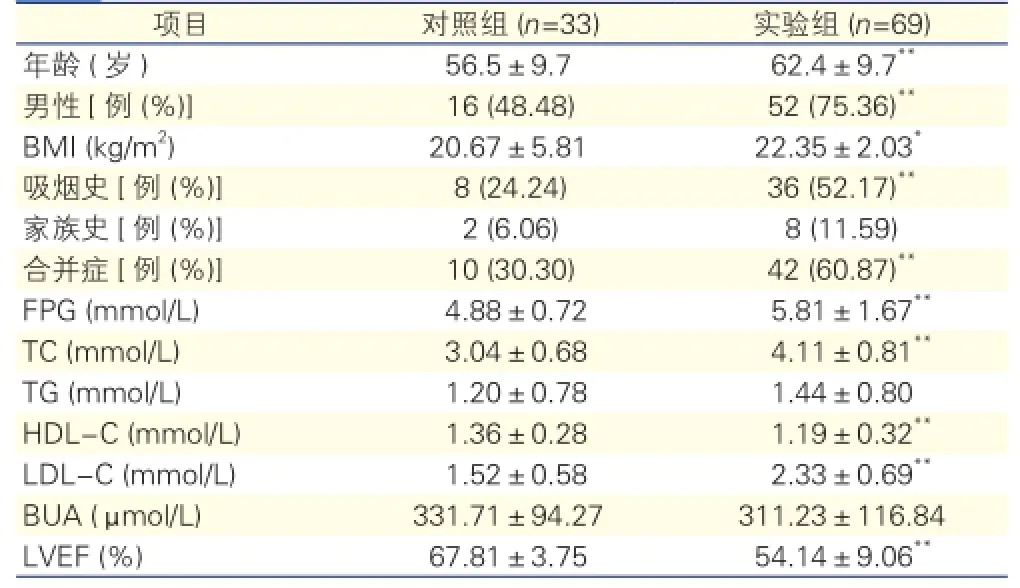
表1 两组患者一般临床资料比较
注:BMI:体重指数;FPG:空腹血糖;TG:甘油三脂;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;BUA:血尿酸;LVEF:左心室射血分数。与对照组比较*P<0.05**P<0.01
?
2.2 实验组患者入院时及发病第15天血浆Tβ4水平与对照组入院时比较
入院时血浆Tβ4水平实验组患者与对照组入院时比 [(3332.46±204.29) ng/ml vs (1706.76±212.86)ng/ml]、实验组发病第15天[(2551.26±153.94) ng/ ml]与对照组入院时比均明显升高,差异均有显著统计学意义(P<0.01)。
2.3 实验组患者在发病15天内血浆Tβ4水平的动态变化(图1)
实验组患者在干预治疗下血浆Tβ4水平在发病后升高,发病1天后开始逐渐下降,在发病第3天达到低值后再次上升,在发病第6天达到高峰,随后逐渐下降,但在发病第11天出现小幅度上升现象。
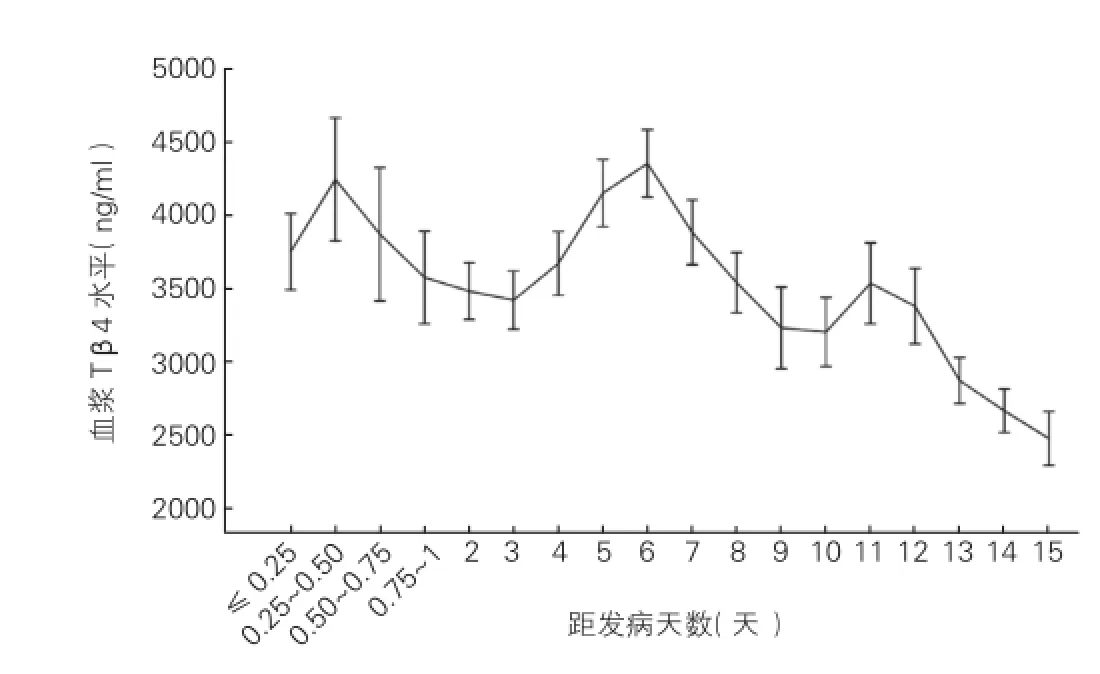
图1 实验组血浆Tβ4水平随发病天数的变化
2.4 实验组患者随访期内MACE发生情况及资料比较(表2)
在18个月的随访期内,实验组69例中失访4例;无MACE发生者31例;发生MACE者34例,其中复发心绞痛15例,靶血管血运重建1例,严重心律失常3例,心力衰竭12例,心原性死亡3例,无非致死性心肌梗死发生。
实验组随访期间有MACE发生者其住院期间血浆Tβ4峰值明显低于无MACE发生者,LVEF明显低于无MACE发生者,差异均有显著统计学意义(P<0.01);其年龄、吸烟史构成比明显高于无MACE发生者,差异有统计学意义(P<0.05);其他指标差异均无统计学意义(P>0.05)。
表2 实验组患者随访期内有无MACE发生者之间资料比较
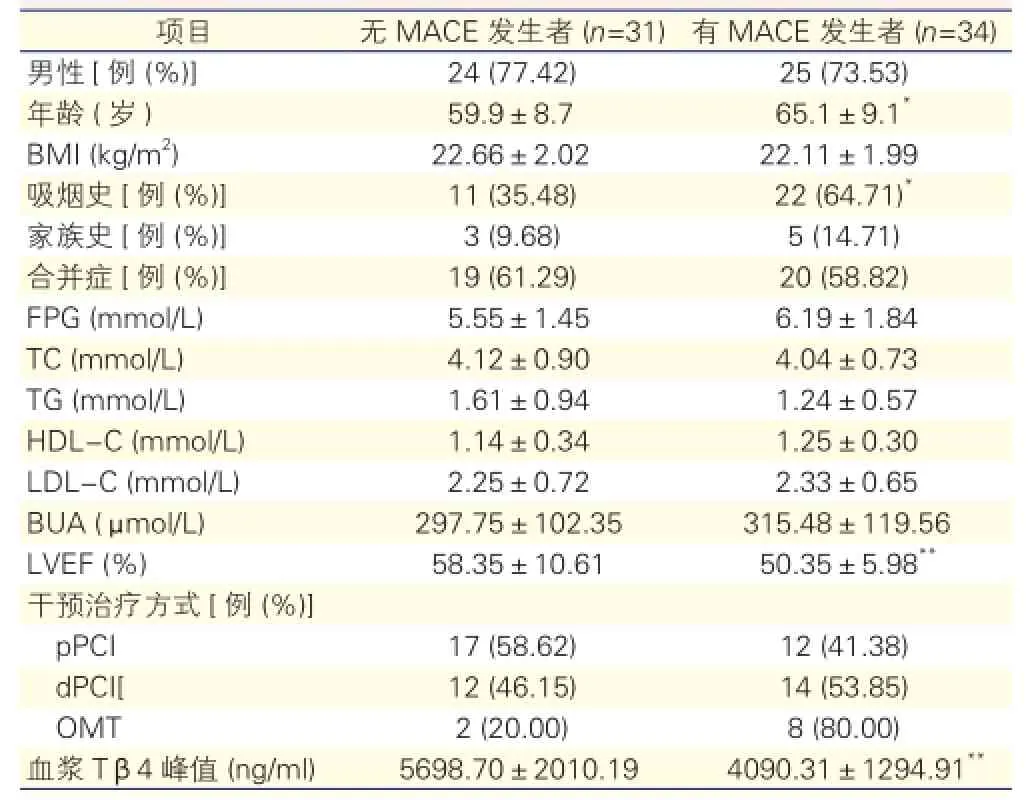
表2 实验组患者随访期内有无MACE发生者之间资料比较
注:MACE:主要不良心脏事件;BMI:体重指数;FPG:空腹血糖;TG:甘油三脂;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;BUA:血尿酸;LVEF:左心室射血分数;pPCI:直接经皮冠状动脉介入治疗;dPCI:延期经皮冠状动脉介入治疗;OMT:优化药物治疗;Tβ4:胸腺素β4。与无MACE发生者比较*P<0.05**P<0.01
?
2.5 Logistic回归分析各项指标与AMI患者在随访期内MACE发生的关系
以AMI患者在随访期内MACE发生作为因变量,以年龄、吸烟史构成比、LVEF及患者住院期间血浆Tβ4峰值等有统计学差异的指标为自变量,行Logistic多因素回归分析,结果显示:患者住院期间血浆Tβ4峰值(比值比=0.999,95%可信区间: 0.999~1.000);LVEF(比值比=0.904,95%可信区间: 0.835~0.980)与患者在随访期内发生MACE显著相关,差异均有显著统计学意义(P<0.01)。
3 讨论
冠心病现有的药物及介入治疗等方法虽然通过尽早解除冠状动脉血流受限及改善心肌供血而极大的改善冠心病患者的临床预后,但上述治疗方法均不能完全修复缺血心肌组织。如能找到一种治疗手段能保护缺血心肌及促进梗死区域心肌再生,将对冠心病的治疗带来革命性的改变。研究发现,Tβ4与心脏发育关系密切,Tβ4能激活心外膜上WT1+心脏祖细胞(CPCs)分化形成平滑肌细胞、心肌细胞、血管内皮细胞等多种成熟的心血管细胞成分[5]。且刚出生的小鼠经腹腔内注射Tβ4处理后在出生7天后仍保持心肌再生功能[6]。当发生心肌缺血时Tβ4也可发挥多重心脏保护作用。Peng等[7]对经Tβ4处理的小鼠心肌梗死模型的研究发现,Tβ4不仅能在梗死急性期减少炎性细胞浸润及细胞凋亡,降低心脏破裂的发生率,还能在后期增加毛细血管密度,减少心肌纤维化,改善左心室扩大,显著提高心肌梗死后心脏功能。而Bicer等[8]报道,严重冠状动脉狭窄患者血清Tβ4水平与冠状动脉侧支循环的形成有显著关系。此外,Tβ4还有助于改善因肺动脉高压造成的右心室肥大[9]。本研究通过检测AMI患者入院时血浆Tβ4水平观察急性心肌缺血、缺氧是否影响机体内源性Tβ4的表达,结果发现,AMI可刺激机体内源性Tβ4表达显著增加,且随访结果显示Tβ4高表达的患者其预后相对良好,进一步证明Tβ4在急性心肌缺血状态下可表现出具有临床意义的心肌保护功能。
目前的研究提示Tβ4在心肌缺血性损伤中发挥其减少梗死面积和增强心脏收缩功能可能包括两个阶段:(1)在缺血发作的急性期通过抗心肌细胞凋亡和抗炎症反应保护缺血心肌细胞。发生心肌缺血时,缺氧可诱导一氧化氮(NO)生成增加[10],NO可通过介导缺氧诱导因子-1α(HIF-1α)作用于Tβ4基因启动子直接或间接的促进Tβ4的表达[11]。因此,本研究显示在发生AMI后血浆Tβ4含量明显增加。而在发病1天后Tβ4水平逐渐下降,可能是由于患者入院后经有效的药物和介入手术治疗,闭塞冠状动脉再通恢复血流,心肌缺血、缺氧程度改善,NO产生减少,故机体上调Tβ4表达的程度有所下降。肿瘤坏死因子-α(TNF-α)可促进白细胞介素-1β(IL-1β)、IL-6、IL-8等多种炎症因子的表达和释放,促进心肌组织的炎症反应,诱导细胞死亡和心肌纤维化,且这些炎症因子可正反馈调节组织对TNF-α的敏感性,进一步加重心肌损伤,促进心力衰竭的发生发展[12]。近年来研究表明,核因子-κB(NF-κB)信号通路参与多种心脏疾病的病理生理过程,包括缺血再灌注损伤、细胞凋亡等,在心室重构过程中起重要作用[13]。而Tβ4可增强PINCH-1-ILK-alpha-parvin (PIP)介导的蛋白激酶B(Akt)活性,抑制NF-κB的激活[14],减少TNF-α、IL-1β等多种炎症因子的转录和表达。Tβ4还可通过抑制促凋亡蛋白的表达,促进抗凋亡蛋白的表达,减少氧自由基生成,下调人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PETN)蛋白表达并促进Akt激活,有选择性的上调抗氧化酶抑制氧化应激等多种机制减轻细胞凋亡,保护心肌细胞免受炎症反应及氧化应激的损伤[15-17];并抑制胶原蛋白Ⅰ、Ⅲ的表达及沉积[14],减轻心肌纤维化及心脏重构,改善心脏功能。(2)在缺血后期通过促进CPCs增殖、分化及血管生成促进心肌修复。Tβ4可激活位于心外膜部位处于休眠状态的CPCs转变成具有多向分化功能的心外膜源细胞(EPDCs),并向心肌层迁移,逐步分化成心肌细胞,部分分化的CPCs参与血管再生[4];Tβ4还可诱导多种促血管生长因子表达上调,促进心肌梗死后血管新生,其中血管内皮生长因子(VEGF)是最重要的促血管生长因子[18]。Ryu等[19]研究表明,在缺氧条件下NO可促进VEGF的表达,且该过程受Tβ4调控。Tβ4可通过增强HIF-1α蛋白稳定性增加VEGF启动子活性,从而诱导VEGF的转录表达[20]。本研究显示AMI患者在发病第3天之后血浆Tβ4水平再次上升,可能是由于随着时间推移,心肌修复反应加快,机体再次加大上调Tβ4表达的力度。发病一周后由于病情逐渐趋于稳定,心肌修复反应趋于平缓,故AMI患者血浆Tβ4水平在发病第6天达到峰值后逐渐下降;而在发病第11天出现小幅度上升现象,目前原因尚不清楚,有待进一步研究。Bao等[21]研究提示长期给予Tβ4可明显改善心肌梗死后心脏功能,且心脏功能的改善可能不仅仅依赖于梗死后的血管再生。而Morris等[22]对经腹腔内注射Tβ4处理大鼠脑梗死模型的研究结果也表明,Tβ4可在长达56天后仍能显著提高神经功能的修复。上述研究均提示长时间的Tβ4作用有助于损伤组织的修复。本研究显示AMI患者在发病第15天其血浆Tβ4水平仍显著高于正常对照组,进一步证明了AMI发生后机体在较长时间内将维持Tβ4高表达以利于AMI后的心肌修复。
本实验研究对象均在接受有效治疗情况下收集血液,测定血浆Tβ4水平,所以本研究不能反映AMI患者在疾病自然发展状态下体内Tβ4血浆水平的动态变化趋势。此外,由于病例数较少,本研究未就不同治疗方式是否会影响AMI患者体内Tβ4血浆水平的动态变化趋势做统计学分析,需后期大样本实验进一步研究。
有关Tβ4的Ⅰ期临床研究已经证明其具有较高的安全性及良好的耐受性[23],目前正在进行Ⅱ期临床研究。本研究结果提示Tβ4有望作为在心肌梗死后改善心脏功能方面一种新型治疗选择,并在给药时间方面提供一定的参考价值。
[1] Low TL, Hu SK, Goldstein AL. Complete amino acid sequence of bovine thymosin beta 4: a thymic hormone that induces terminal deoxynucleotidyl transferase activity in thymocyte populations. Proc Natl Acad Sci USA, 1981, 78: 1162-1166.
[2] Huff T, Muller CS, Otto AM, et al. beta-Thymosins, small acidic peptides with multiple functions. Int J Biochem Cell Biol, 2001, 33: 205-220.
[3] Smart N, Bollini S, Dube KN, et al. De novo cardiomyocytes from within the activated adult heart after injury. Nature, 2011, 474: 640-644.
[4] Smart N, Dube KN, Riley PR. Epicardial progenitor cells in cardiac regeneration and neovascularisation. Vascul Pharmacol, 2013, 58: 164-173.
[5] Chen S, Shimoda M, Chen J, et al. Stimulation of adult resident cardiac progenitor cells by durable myocardial expression of Thymosin beta 4 with ultrasound-targeted microbubble delivery. Gene Ther, 2013, 20: 225-233.
[6] Rui L, Yu N, Hong L, et al. Extending the time window of mammalian heart regeneration by thymosin beta 4. J Cell Mol Med, 2014, 18: 2417-2424.
[7] Peng H, Xu J, Yang XP, et al. Thymosin-β4 prevents cardiac rupture and improves cardiac function in mice with myocardial infarction . Am J Physiol Heart Circ Physiol, 2014, 307: H741-751.
[8] Bicer A, Karakurt O, Akdemir R, et al. Thymosin beta 4 is associated with collateral development in coronary artery disease. Scand J Clin Lab Invest, 2011, 71: 625-630.
[9] Wei C, Kimi IK, Li L, et al. Thymosin Beta 4 protects mice from monocrotaline-induced pulmonary hypertension and right ventricular hypertrophy. PLoS One, 2014, 9: e110598.
[10] Maulik N, Das DK. Redox signaling in vascular angiogenesis. Free RadicBiol Med, 2002, 33: 1047-1060.
[11] Ryu YK, Kang JH, Moon EY. The Actin-sequestering protein thymosin Beta-4 is a novel target of hypoxia-inducible nitric oxide and HIF-1α regulation. PLoS One, 2014, 9: e106532.
[12] 杨贵芳, 彭文, 赵琴, 等. 心力衰竭免疫学机制及治疗的研究进展.中国循环杂志, 2015, 30: 193-195.
[13] 晋金兰, 韦建瑞. Notch信号和核因子-κB信号通路与心肌梗死后心室重构之间的关系的研究进展. 中国循环杂志, 2015, 30: 718-720.
[14] Sopko N, Qin Y, Finan A, et al. Significance of thymosin beta4 and implication of PINCH-1-ILK-alpha-parvin (PIP) complex in human dilated cardiomyopathy. PLoS One, 2011, 6: e20184.
[15] Kumar S, Gupta S. Thymosin Beta 4 prevents oxidative stress by targeting antioxidant and anti-apoptotic genes in cardiac fibroblasts. PLoS One, 2011, 6: e26912.
[16] Yan B, Singla RD, Abdelli LS, et al. Regulation of PTEN/Akt pathway enhances cardiomyogenesis and attenuates adverse left ventricular remodeling following thymosin β4 overexpressing embryonic stem cell transplantation in the infarcted heart. PLoS One, 2013, 8: e75580.
[17] Wei C, Kumar S, Kim IK, et al. Thymosin Beta 4 protects cardiomyocytes from oxidative stress by targeting anti-oxidative enzymes and anti-apoptotic genes. PLoS One, 2012, 7: e42586.
[18] Karina N, Sveva B, Smart N, et a1. Thymosin Tβ4 protein therapy for cardiac repair. Curr Pharm Des, 2012, 18: 799-806.
[19] Ryu YK, Lee JW, Moon EY. Thymosin Beta-4, Actin-sequestering protein regulates vascular endothelial growth factor expression via hypoxia-inducible nitric oxide production in heLa cervical cancer cells. Biomol Ther, 2015, 23: 19-25.
[20] Jo JO, Kim SR, Bae MK, et a1. Thymosin β4 induces the expression of vascular endothelial growth factor(VEGF) in a hypoxia-inducible factor(HIF)-lα-dependent manner. Biochim Biophys Acta, 2010, 1803: 1244-1251.
[21] Bao W, Ballard VL, Needles S, et al. Cardioprotection by systemic dosing of thymosin beta four following ische micmyocardial injury. Front Pharmacol, 2013, 4: 149.
[22] Morris DC, Cui Y, Cheung WL, et al. A dose-response study of thymosin β4 for the treatment of acute stroke . J Neurol Sci, 2014, 345: 61-67.
[23] Ruff D, Crockford D, Girardi G. A randomized, placebo controlled, single and multiple dose study of intravenous thymosin beta4 in healthy volunteers . Ann NY Acad Sci, 2010, 1194: 223-229.
Significance for Dynamic Changes of Plasma Level Thymosin β4 in Patients With Acute Myocardial Infarction
ZHOU Xin-run, ZHANG Ming-chao, KE Yong-sheng, JIA Liang-liang, TIAN Yuan, WANG Chun-tian.
Department of Cardiology, Anqing Hospital Affiliated to Anhui Medical University, Anqing (246003), Anhui, China Corresponding Author: KE Yong-sheng, Email: keyongsheng@163.com
Objective: To observe the dynamic changes of plasma level thymosin β4 (Tβ4) in acute myocardial infarction (AMI) patients with intervening therapy within 15 days of onset and to explore the relationship between Tβ4 and clinical prognosis in AMI patients.Methods: Our research included 2 groups: AMI group, n=69 and Control group, the patients with suspected chest pain while CAG excluded coronary artery stenosis, n=32. Plasma levels of Tβ4 were examined in all AMI patients on admission day and every day until 15 days of onset; AMI patients were followed-up for 18 months and the endpoint was defined as major adverse cardiovascular event (MACE) occurrence.Results: ①Compared with Control group, AMI group had increased plasma level of Tβ4 on admission day and on day-15 of onset, P<0.01.②With intervening therapy, AMI group had elevated Tβ4 level upon immediate onset, it was decreased on day-1, reached low level on day-3 and elevated to peak on day-6, then reduced followed by slightly raising on day-11.③During follow-up period, the AMI patients without MACE had the higher mean in-hospital maximum Tβ4 value than those with MACE occurrence, P<0.01. Logistic regression analysis indicated that the mean in-hospital maximum Tβ4 value was related to MACE occurrence during follow-up period (OR=0.999, 95% CI 0.999-1.000).Conclusion: AMI may induce up-regulated expression of plasma Tβ4; with intervening therapy, Tβ4 showed a trend of “elevation-reduction-elevation-reduction” at the early stage of AMI. High expression of Tβ4 was helpful for improvingclinical prognosis in AMI patients which may provide a theoretical basis for exogenous use of Tβ4 in AMI treatment.
Myocardial infarction; Thymosin; Prognosis
2016-04-23)
(编辑:常文静)
246003 安徽省安庆市,安徽医科大学附属安庆医院 心内科(周新润);皖南医学院弋矶山医院 心内科(张明超、柯永胜、田塬、王纯田);浙江大学医学院附属第二医院 心内科(贾亮亮)
周新润 住院医师 硕士 主要研究方向为冠心病介入治疗 Email:zxr_lucky@126.com 通讯作者:柯永胜 Email:keyongsheng@163.com中图分类号:R54 文献标识码:A 文章编号:1000-3614(2017)01-0031-05 doi:10.3969/j.issn.1000-3614.2017.01.008
方法:入选69例AMI患者作为实验组,另入选33例胸痛但经冠状动脉造影术(CAG)排除冠状动脉狭窄的患者为对照组。收集所有受试者入院时及实验组发病15天内每天的静脉血液,检测血浆Tβ4水平。对69例AMI患者进行为期18个月的临床随访,随访终点为主要不良心脏事件(MACE)。
结果:(1)与对照组比较,实验组患者入院时及发病第15天血浆Tβ4水平明显升高,差异有统计学意义(P<0.01)。(2)实验组患者在干预治疗下血浆Tβ4水平在发病后升高。发病1天后开始下降,在发病第3天达到低值后再次上升,在发病第6天达到高峰,随后逐渐下降,但在发病第11天出现小幅度上升现象。(3)随访期内无MACE发生的AMI患者其住院期间血浆Tβ4峰值较有MACE发生的患者明显升高,差异有统计学意义(P<0.01);Logistic回归分析显示:患者住院期间血浆Tβ4峰值与患者在随访期内是否发生MACE显著相关(比值比=0.999,95%可信区间: 0.999~1.000)。
结论:AMI可诱导机体上调Tβ4的表达;在干预治疗下,AMI患者发病初期血浆Tβ4水平呈现“升-降-升-降”趋势;AMI患者体内Tβ4高表达有助于改善其临床预后,为外源性使用Tβ4治疗AMI提供理论基础。

