水环境中木质素光降解及其对有机物相关指示参数影响研究进展
沈自强+张淑荣+贾彤辉+丁爱中

摘要:木质素是陆源有机物的重要组成部分,同时也是一种良好的陆源有机物的生物标志物。光化学降解是造成木质素在水环境中指示参数变化的重要原因。简要介绍了木质素的分子结构、特征指示参数和作为生物标志物的指示原理,重点介绍水环境中木质素光化学降解的机理及影响因素,总结了由木质素光降解引起的木质素指示参数及其他有机物相关参数(例如13C同位素、CDOM)的变化特征,综述了陆地湖泊、河流、河口及海洋等水环境中木质素光降解的研究情况。最后,指出水环境中木质素光降解的一些研究方向,包括利用CDOM光谱特征研究光降解过程、与其他参数结合表征来源以及加强光降解与生物降解相互作用的研究等。
关键词:木质素;生物标志物;光降解;陆源有机物;指示参数
中图分类号:X13文献标志码:A文章编号:1672-1683(2017)01-0079-09
Abstract:Lignin is one of the major components of terrestrial organic matter,as well as a good biomarker of terrestrial organic matter.The photodegradation of lignin in aquatic environments can significantly affect its indicative parameters.Firstly,this review introduced the structure of lignin and its application as a biomarker.Then,the mechanism and influencing factors of lignin photodegradation in aquatic environments were described and discussed.Meanwhile,the changes of lignin indicative parameters and other organic matter parameters (13C isotope,CDOM,et al.) caused by the photodegradation,as well as researches about lignin photodegradation in rivers,estuaries and offshore were summarized.Finally,some possible research fields of lignin photodegradation in water environment were pointed out,including the use of CDOM optical spectrum measurements to characterize the photodegradation of lignin,combining with other parameters to characterize the sources and strengthening the study of the interaction between photodegradation and biodegradation.
Key words:lignin;biomarker;photodegradation;terrestrial organic matter;indicative parameters
木質素是一种含有酚结构单元的天然高分子芳香族化合物,仅存在于陆生维管植物中,是陆源维管束植物在水环境中的独特标志[1-2],其总量及组成特征能够指示有机物的来源和降解信息[3]。从20世纪70年代开始,国内外研究者对土壤、河流、河口及陆架区的木质素进行了广泛研究,将木质素作为研究陆地植被变化和重建古环境、古气候的重要工具[4],并在河流和海洋生物地球化学研究中将其作为陆源有机碳来源、迁移和转化的良好标志物[5-9]。
木质素在植物降解过程中被释放到土壤中后,一部分被矿化为CO2;还有一部分被转移到水环境中,其中的一部分被沉积、埋藏和降解,剩余的最终迁移到海洋中[10]。一般认为,木质素在土壤、水体和沉积物的迁移和埋藏过程中,相对于其他有机标志物(如氨基酸、多糖和rDNA等),能保持较好的稳定性和抗降解能力。但研究表明木质素到达海洋中的量远小于其在河流中的输入量[2,11],表明木质素在环境中的迁移转化也会发生显著的降解。在土壤及水环境中广泛存在的生物降解[12-13]、光降解[8,14-21]以及相变过程[22-23]都不同程度地影响木质素的数量和组成。微生物降解和光降解是木质素两种主要的降解途径,两种作用的相对重要性取决于其所处环境。在土壤环境中,微生物降解是木质素参数改变的主要因素[12,20]。而在水环境中,木质素酚的光降解速率远高于微生物降解速率[15,18,24],Hernes对密西西比河的研究表明水环境中光降解速率是微生物降解速率的5倍[17],Benner和Kaiser对Broad河的研究表明水环境中经光降解降解的木质素占80%左右[15]。因此光降解作用对木质素随河流迁移到海洋中发生的参数变化起到重要作用[25]。同时很多研究发现,水环境中木质素的光降解速率与有机碳的光降解速率具有不一致性,木质素比TOC更易受到光降解[8,15]。因此理解木质素的光降解过程对了解河流木质素的迁移与转化、木质素作为陆源有机标志物的应用和研究陆源有机物在水环境中的归宿等问题具有十分重要的影响。
本文将系统阐述木质素在水环境中的光降解原理及其影响因素,并分析天然水体中木质素光降解对相关指示参数影响的研究进展。
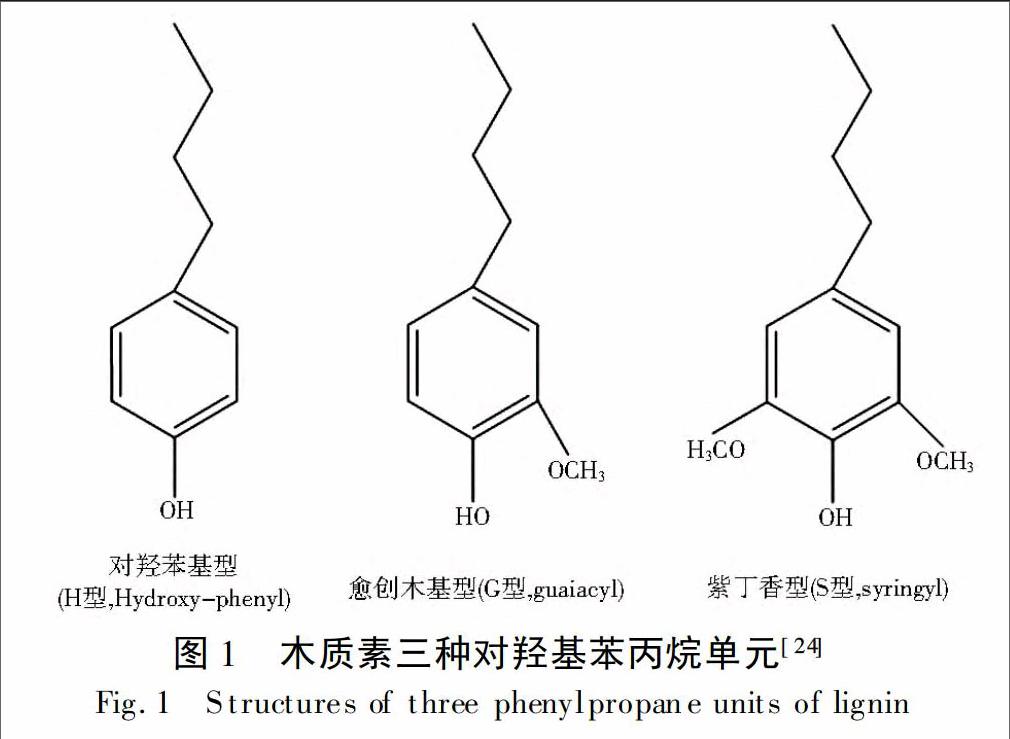
1 木质素的分子结构、特征指示参数及指示原理木质素是一种高聚物,主要单体结构是对羟基苯丙烷单元(图1)。根据苯环上羟基相邻位置甲氧基取代数目的不同,可以分为对羟苯基型(H)、愈创木基型(G)和紫丁香基型(S)。针叶材木质素主要由G单体组成,阔叶材木质素主要由G和S单体组成,而非木质纤维木质素主要由H、G和S三种单体组成。木质素通过单体与单体、单体与低聚体以及低聚体与低聚体之间脱氢聚合、以Cα-Cβ键和β-O-4键等连接方式无序偶联在一起。其中,最主要的连接方式为β-O-4连接(苯丙烷上的β碳与苯氧基环上的氧的连接),约占内部连接的50%,该连接方式很不稳定,是木质素降解过程中的主要降解部位[8]。
木质素的定量分析需要先将大分子化合物氧化成小分子氧化产物,常用碱性氧化铜法氧化分解木质素,再用GC-FID,GC/MS或HPLC等分析检测氧化单体[26-28]。木质素被氧化成4类11种酚单体(LOPS)[1](图2),其中具有指示意义的主要有紫丁香基酚类(S系列,包括香草醛、香草酮和香草酸);香草基酚类(V系列,包括丁香醛、丁香酮和丁香酸)和肉桂基酚类(C系列,包括阿魏酸和对香豆酸) 3类;第4类为对羟基酚类(P系列)。由于某些氨基酸经过碱性氧化铜分解也能产生P系列酚,故其很少被用于陆源有机物示踪研究[29]。不同类型植物所含的木质素单体种类及含量具有差异,因此可以将木质素总量和单体组成作为陆源有机标志物(表1)。通过样品中木质素酚总量(Λ8和∑8)可以估算水环境中陆源组分的量,如Benner等根据Λ8数据,估算出北墨西哥湾水域UDOM中平均有11.6%的陆源物质,北大西洋中有约有24%的陆源物质[16]。由于不同类型的植物所含各种木质素酚单体的种类和量的不同,因此可以通过木质素分解后的各种酚的比值(S/V和C/V)来区分来源植被类型[2],如图3表示了不同的C/V和S/V值对应的植被类型。木质素在环境中迁移转化而发生降解后的单体参数会发生变化,由于S和V系列酚单体中酸和醛的降解速率不同,从而可以根据木质素酚单体中的酸醛比((Ad/Al)S和(Ad/Al)V)表征木质素的降解程度。经过一定程度降解之后的(Ad/Al)V值会高于新鲜植物组织的值,新鲜植物组织的(Ad/Al)V值通常小于0.3,比值大于0.6时可认为木质素经过了较大程度的降解;而新鲜植物的(Ad/Al)S值一般小于0.14[30-31]。
2 木质素光降解机理
2.1 木质素光降解途径
由于木质素分子具有复杂性,对木质素光降解机理的研究主要是基于模型化合物。一般认为,苯环侧链Cα-Cβ键和β-O-4键断裂是木质素降解的主要方式[34],除了侧链氧化外,木质素的芳香环在光降解过程可能会通过脱甲基而开裂[35]。通过对很多木质素模型化合物的研究发现,木质素酚聚合物的苯环外部侧链降解速度快于木质素内核[36]。木质素的光降解是由紫外照射而产生自由基引起的[37],其光化学反应可以分为直接光降解和活性氧光氧化反应[38]。
直接光降解是木质素分子吸收光子中的能量后,直接发生化学键断裂和光分解等化学变化的过程。直接光降解中主要发生的反应有酚的夺氢反应、α-苯氧基苯乙酮的β裂解和羰基自由基的裂解等[38]。直接光降解的途径包括游离酚途径(phenol pathway),苯甲酰甲基途径(phenacyl pathway)和羰游基途径(ketyl pathway)[38-40]。游离酚途径通过苯酚基团上氢原子的转移和直接光降解而产生苯氧基[41]。苯甲酰甲基途径会产生β-醚键均裂,形成苯甲酰甲基-苯氧基成对自由基,苯甲酰甲基芳基醚断裂可能引发木质素的解聚及新的苯酚基形成。羰游基途径中,α-OH和β-O-4等的断裂导致苯氧基、α-羰基的形成和β-芳醚键(最常见的木质素连接键)的断裂[42]。
木质素的光氧化反應机制为木质素与各种光化学反应中形成的中间体反应而降解。这些中间体包括超氧/过氧自由基(O2-/HO2·)[43-44]、羟基自由基的(·OH)[45-46]和单线态氧(1O2)[47-48]等。超氧自由基能在碱性条件下使芳香环破裂,同时生成脂肪酸[49]。羟基自由基能够通过羟基化,脱甲氧基化,去烃基化和侧链置换反应等作用攻击木质素的芳香环,也能氧化木质素的脂肪族侧链[50]。存在于自然水环境中的基态DOM通过系间窜越去活化而转化为三重激发态(3DOM*)[51],三重态的光敏剂不能直接与木质素发生反应[35],但在有分子氧存在的条件下,能将能量传递给氧,使分子氧变成单线态氧(1O2)[52],单线态氧也可以由木质素上的羰基通过光敏化反应产生[52]。单线态氧易与电子密度较大的基团发生反应,由于木素分子中含有芳香基、双键、羰基、羟基等富电子体系,因此极易受到单线态氧的攻击[38]。木质素分子被这些自由基氧化,苯丙烷结构单元减少,从而发生了大量降解[35,51]。
在木质素的光降解过程中,敏化剂扮演着重要角色。一方面光敏剂能吸收光能后形成活跃而不稳定的激发态分子,激发态光敏剂将能量传递给木质素分子,使其发生化学键断裂和氧化。另一方面,光敏剂能够导致水体中各种活性氧中间体的形成。Crestini等在木素模型物光解的研究中发现,部分非酚型木素模型物只有在光敏剂存在的条件下才会发生降解[53]。在自然水域,有色溶解有机物(CDOM )是光化学反应的重要的敏化剂[51,54-55]。木质素作为一种复杂的大分子,具有三种致敏性发色团结构,即芳香α-羰基基团、环共轭双键和联苯结构[56],其中α-碳基基团被认为是这三种光敏剂中最重要的[57]。McNally等的实验也观测到木质素模型化合物之间的自敏化作用,即一种木质素模型表现为敏化剂,促进另外一种木质素模型进行降解[58]。
2.2 木质素光降解产物
木质素经过光降解作用后,木质素分子发生侧链断裂、侧链氧化、解聚和苯环开裂等过程。木质素侧链发生断裂和氧化之后,木质素羟基,羧基和酮基数量增多,甲氧基数量下降[38,59]。在木质素苯丙烷单元之间则发生解聚,使木质素的平均分子量变小[36,41,59]。
通过连续光照后,同时也发现木质素的芳香环大量开裂[35],并检测到大量的醌生成[41],醌的形成过程伴随着芳香族结构的减少和共轭羰基的增加[49]。同时,光降解使木质素的水溶性增强,水溶性小分子产物形成[35,58],对木材木质素的光降解实验表明,木质素的光降解产物主要有各种有机酸、香草醛、丁香醛及一些分子量较大的聚合物片段(包括醇、醛、酮、酸等)[60]。
2.3 光降解影响因素
2.3.1 木质素酚的自身结构
通过对木质素模型化学物的研究发现,木质素低聚物最耐降解的是那些缺少α-羰基和酚官能团的物质。属于酚的低聚物中,非甲氧基苯取代酚比甲氧基取代酚类更耐降解。同时木质素的降解率受到芳环上是否存在甲氧基的影响,紫丁香酚类(S)具有两个甲氧取代基,香草酚类(V)有一个甲氧取代基,和对羟基酚类(P)没有甲氧基,而三者的光化学衰减常数为S>V>P[15]。
2.3.2 水环境的pH值
通过对木质素模型化合物的研究发现,在碱性条件下,降解反应速度加快[58]。这一方面是因为碱性条件能促进分子氧吸收紫外光能量后生成自由基[55],另一方面的原因是木质素降解后生成的羧酸在碱性条件下被消耗,从而打破化学平衡,使得反应不断地向正方向进行[34]。
2.3.3 水环境中氧的含量
Dimitris等的研究发现光降解能显著地使木质素分子中β-O-4断裂,形成新的酚醛单元,该过程在有氧存在的条件下速度更快[40]。任哲等的研究也发现氧气对木质素光催化降解起到了重要的作用,有氧条件下光降解实验表明,木素结构中苯环大量开裂,联接木素单元结构间的醚键打开,木素的降解程度大幅度提高。因为在碱性水溶液中,分子氧通过吸收紫外光的能量,形成羟基自由基(HO·)和过氧离子自由基(·O-2),其中羟基自由基被广泛认为反应活性高和无选择性的,木素分子被自由基氧化而发生大量降解[35]。水环境中溶解氧含量不足会使羟基自由基和过氧离子自由基等活性氧类中间体的形成受到抑制,从而减缓木质素的光化学氧化过程。
2.3.4 水环境中光敏剂的含量
水环境中存在的其他腐殖质以及一些金属离子(如铜和铁)[61]、NO-3、NO-2等无机离子均为天然的光敏剂,它们易吸收光能,形成活跃的不稳定存在的激发态分子,并通过各种不同的方式向外界辐射能量。这些光敏剂中间产物寿命短,易通过电荷转移等方式将能量传递给分子氧等受体,从而导致木质素分子中化学键的断裂或氧化,以及活性氧类中间体(单线态氧、三线态氧、羟基自由基和过氧化氢等)的形成[55]。
2.3.5 水环境的温度和光照强度
光化学反应强度随温度和光照强度的上升而上升。Benner和Kaiser测得Broad河2月的木质素酚浓度几乎是5月的2倍,光氧化呈现出夏季强,冬季弱的趋势[14-15]。Grannas等对南北极和格陵兰岛的雪融水的研究表明,5月的光降解相对于2月更加剧烈,这是因为雪经过在初春(极地日出后)搬运期间和沉积之后,光降解变得更加重要,2月的雪样则是在极夜期间沉积和转运[19]。
3 光降解对木质素指示参数的影响
3.1 木质素总量的变化
Opsahl和Benner在热带河流水样光降解实验中发现,密西西比河溶解木质素最初5 d内减少37%,在28 d的光照实验后减少80%[21],Spencer等对刚果河水样进行57 d的光照实验后,溶解木质素总量减少95%[14]。值得一提的是,在光降解实验的实验周期内,微生物降解相对于光降解而言,对木质素总量影响较小,例如在上述Opsahl和Benner的实验中,28 d光照实验中暗处理样本木质素总量仅减少16%[21]。除木质素氧化铜氧化产物(LOPs)迅速减少外,Opsahl和Benner的研究还表明,溶解木质素分子的尺寸分布也会发生变化,并且可以通过这种变化来评估DOM是否经过较大程度光降解,在其试验前,约90%的河流木质素存在于大分子(>1000 道尔顿)有机物中,光照实验结束后,约有80%的剩余木质素组分为小分子(<1000 道尔顿),且剩下的木质素为耐光降解组分[21]。因此小分子的木质素可能是大分子木质素的光氧化产物,这同时也表明光降解能将大分子溶解物转化为小分子。
3.2 S/V和C/V的变化
木质素在水环境中经过光降解之后,总量会发生较大的变化,同时木质素的组成也会发生一定变化。由于来源于不同植物的木质素酚结构差异和单体之间的连接方式不同,不同系列酚的降解速度具有一定差异,从而引起S/V和C/V值发生变化。同时,一些对木质素模型化合物的光降解研究也发现其光氧化活性随甲氧基增多而上升[18]。Mayer等的研究发现,来源于具有丰富有机物的河流样品木质素酚S/V和C/V经光降解后都呈明显下降趋势,分别从1.06~0.95减少为0.88~0.76(S/V)、0.17~0.36减少为0.10~0.28(C/V),而近海样品的值基本没有变化[8]。鲍红艳等对红树林间隙水的研究中发现,光降解过程中S系列酚的降解速度最快,V系列最慢,S/V值呈下降趋势[18]。
然而,Spencer等对刚果河河水的光降解研究却获得了相反的结果,在这个研究中,C/V变化较小,其S/V值在实验前期有一点程度的下降,但在12 d后迅速从0.66上升到1.16。该作者认为样品木质素中有一小部分(<5%)是耐光降解的,在光降解过程的前期表现不活跃,但随着光降解进程加深,它越来越重要,并且能显著地提高S/V。这个显著地S/V上升过程出现在光培养过程的80%以后,而前述的研究都在初始木质素被降解约80%后终止,故没有检测到这个结果[14]。
相比微生物降解,光降解对木质素组成的变化影响更大。据Opsahl和 Benner报道,在28 d的光照试验后,S/V下降两倍,而在微生物降解实验中S/V没有发生明显变化[21]。Hernes等的研究表明,絮凝和微生物降解都不能明显改变河口水样中木质素的组成,光降解是造成木质素组成变化的主要原因[17]。
3.3 (Ad/Al)V和(Ad/Al)S的变化
木质素各系列酚的单体参数也会在经历光降解之后发生变化。很多研究表明,各种单体的光稳定性具有差异,Opsahl通过计算各单体的指数衰减系数,总结的各种木质素单体抵抗光降解的稳定性为香草酮>阿魏酸>丁香酸>香草醛>丁香酮>丁香醛>香草酸>对香豆酸,所以香草基酚类单体中的香草酸香草醛的比值(Ad/Al)S以及紫丁香基酚类单体中的紫丁香酸和紫丁香醛的比值(Ad/Al)V通常会在光降解后有不同程度上升[21],V系列酚尤為明显[62]。在Spencer对刚果河水样品的研究中,(Ad/Al)V和(Ad/Al)S值在光照实验后分别由1.38和1.11上升到3.30和2.76[14];Hernes的研究结果也显示无论大分子木质素还是小分子木质素的(Ad/Al)V和(Ad/Al)S都会上升[17]。鲍红艳等对红树林间隙水的研究也观测到光培养中的(Ad/Al)V值由0.6上升到1.5[18]。同时有一些研究表明,(Ad/Al)S不能反映溶解性木质素由于光降解而产生的变化[21],而在Mayer实验对河流颗粒木质素的研究中,只有(Ad/Al)V值出现了较大程度的上升,而(Ad/Al)S基本不变,甚至变小[8]。
对比新鲜植物的(Ad/Al)V值后,可以用样品的(Ad/Al)V值来评估木质素光降解程度。Grannas通过对比2月和5月的(Ad/Al)V和(Ad/Al)S值,分析得出样品中木质素在5月经历了更大程度的光降解[19]。
3.4 木质素光降解对有机物其他参数的影响
由于水生环境中DOM的生色团(例如木质素)对紫外光的吸收而发生的光降解,可以改变DOM的化学结构和光学特性。木质素作为河流DOM中光降解中活跃的组分,木质素酚的降解与DOM吸光度的变化具有一定相关性,吸光度在光降解试验中下降很快。Osburn等的沼泽水光降解实验表明,DOM在320 nm处的吸光度(ad,320)大约下降了30%,而暗处理的基本没有变化,这个结果与DOC中芳香性碳的减少(-36%)相似[63]。Opsahl和Benner的试验表明,COM的吸光度在5 d内分别下降了25%~40%,在28 d内下降了40%~60%,并与溶解性木质素的损失相关性较高,而对应的暗控制实验却没有明显变化[21]。Spencer等的研究表明刚果河样品在57 d的光照后,在254 nm和443 nm间的吸收系数下降了85%~95%[14]。在Opsahl与Benner和Spencer的研究中,CDOM的光化学降解的最高水平出现在310~360 nm之间,这个范围CDOM的吸光度与溶解木质素酚的浓度具有很高的相关性,因此能够据此来推断迁移到海洋中的陆源有机物的光降解水平[64]。
穩定碳同位素比值(δ13C)也是一种常用的生物标志物,它可以应用于区分陆源植物(-28‰~-25‰)和海源植物(-22‰~-19‰),以及C3(δ13C值与陆源植物相近)和C4(-12‰~-14‰)[2,65]。木质素是总DOC中相对贫13C的组分(低3‰~7‰)[66],Opsahl和Zepp的研究表明,光降解优先降解贫13C组分,同时δ13C值在各个样点都有一定程度的上升(+0.8‰~+1.6‰)[67]。Osburn等的沼泽水光降解试验表明,δ13C值在光照下相对于暗处理样本出现了1.2‰的上升,同时芳香性减小(芳香族碳减少47%),考虑到木质素是由众多芳香环组成的,作者认为木质素等芳香性物质的光降解对δ13C的改变产生了重要影响[63]。同时,在Spencer等的试验中,13C初始值为-29.2±0.1‰,在57 d的光降解实验中,以0.107 d-1的速率上升,并且该光降解实验过程中13C值与Λ8值具有很强的相关性(r=0.99,p<0.01)。因此,在光降解过程中,δ13C值的改变与木质素的光降解具有一致性[14]。
4 不同水环境中木质素的光降解研究
陆源有机物在从陆地输送到海洋的过程中,受到多种自然过程(光降解、生物降解、吸附解析等)的影响,在不同水环境中的木质素特征也会具有一定差异,这包括光降解程度和光降解潜力。同时,木质素在不同水文、气候等条件下受到光降解影响的程度是不同的。
在对湖泊水体的研究方面,Ouellet等对加拿大六个湖泊水样进行了研究,温暖湿润且光照强度大的7月、8月和9月的S/V值更低,这样的气候条件不仅会使微生物活动加剧,同时光降解也会更加剧烈,作者认为如果光降解是相对显著的话,(Ad/Al)V会上升,而这项研究中这个值没有显著的变化,因而光降解所占的比重不是很大[9]。Vahatalo等将14C标记芳香环的合成木质加入到湖泊水样中,研究在光降解和微生物降解分别作用下合成木质素和DOC的转化和归宿,结果表明两者在微生物的作用下发生的降解较少,而光降解作用更加显著[68]。
河流是陆源有机物转运到海洋的主要途径,鲍红艳等研究了长江流域溶解有机质输送的影响因素,在该研究中,在长江中下游枯水期和丰水期的(Ad/Al)V都没有上升的趋势,因此溶解有机质在输送过程中,除光降解外,还明显受到其他过程的影响[69]。刚果河[14]、亚马逊河[32]、密西西比河[16]和一些北半球高纬度河流[70-71]的 (Ad/Al)S和(Ad/Al)V值是比较接近的,但是这些河流的光降解强度可能并不接近,因为有机物在从土壤、沉积物等吸附和解析过程、微生物降解等自然过程也可能会改变这两个参数[22]。Spencer等的研究指出,相对于世界上其他大型河流,刚果河的泥沙含量低,羽流表面积大,且在光降解实验中其陆源DOM和木质素表现出了显著的光反应活性,因此在刚果河光降解是移除木质素和陆源DOM的重要途径[14]。而亚马逊河的情况恰恰与之相反,D.Ward指出由于亚马逊河具有流速高、河流深和光穿透率低的特点,有机物在这种浑浊的主河道中很少暴露在紫外辐射下,因此光降解并不明显。但是在那些比主河道流速慢、浊度低和深度更浅的水环境中,光降解扮演着十分重要的角色[72]。
在河口区域,水流逐渐平缓,泥沙沉淀下来,溶解有机物的曝光程度达到最大,光降解强度也达到最大。因此河口区域被认为是木质素光降解的重要区域,也是当今研究者的研究热点区域。在河口区域,随着盐度的上升,木质素的光降解强度上升,在Hernes等的实验中,盐度>25 psu时,光降解相对絮凝和微生物降解更加剧烈[17]。Ronald和Stephen的研究表明木质素浓度随盐度上升而下降,Σ8值随河流盐度为0 psu上升到36 psu左右时,从14.3~42.3 μg/L减少到0.1~0.3 μg/L[16]。Mayer等对该区域的沉积物样品研究也发现了木质素酚总量的大量减少。同时,木质素分子的尺寸分布也会随盐度的变化而变化[8],Hernes的试验中,木质素酚在大分子DOM中的比例随盐度从0上升到35.4 psu时从79%减少到17%。因此在河口区域,光降解是木质素降解的控制因素[17],木质素经过这个区域后总量减少,分子量变小。溶解木质素经过陆地河流和河口区域之后,剩余部分基本为光化学稳定性较高的物质。
至于在海水环境,Opsahl和Benner实验发现,与河水样品的木质素浓度随光照时间迅速下降不同,海水样品的木质素浓度在4 d的光照后基本不变,海洋样品大分子木质素为耐光降解组分[21]。
5 研究展望
木质素作为一种良好的陆源有机物的生物标志物,已经被广泛运用到生物地球化学研究中。现阶段对水环境中木质素光降解机理的研究已经取得了一定的进展,同时也开展了对不同水环境中木质素光降解实验的研究。未来研究应关注以下几个方向。
(1)CDOM光谱检测今后可能会成为评价木质素和陆源有机物光降解程度的在线分析手段。荧光分析是一种研究水环境中有机物的常用手段,可以实现对有机物的在线分析。而环境样品中木质素的光降解情况也可以通过荧光强度参数来反映。例如,Fichot和Ronald指出,在某些特定环境中,CDOM的光谱斜率(S275-295)可以作为光降解的独特指示参数[73]。在Yamashita等的研究中,作者识别了可能来源于陆源类腐殖质、耐光降解物质的峰A和来源于陆源类腐殖酸的峰C,峰C和峰A荧光强度的比值可以作为指示陆源类腐殖质组分光降解程度的指标[74]。
(2)与其他的生物地球化学方法相结合。当发现样品木质素发生了较大程度的光降解之后,木质素作为标志物的指示作用便会发生一定偏差。因此在今后的研究中可以考虑将木质素分析与其他的生物地球化学方法相结合,进而反推其母源信息,例如与孢粉分析[75]、木質素单体同位素分析等相结合。此外,Tareq等还提出用木质素植被指数(LPVI)来定义木质素组成,该指数能灵敏地检测到包括环境条件引起的陆地植被的变化[76-77]。
(3)木质素各种降解途径相互竞争和相互促进方面的研究可能是今后研究的一个重点。很多研究表明,光化学降解、微生物降解和吸附、解析作用会在不同的环境介质中对木质素参数产生不同程度的影响,例如有研究表明光降解和微生物降解的相对强度取决于影响光穿透的因素(比如浊度)和影响微生物降解的因素(比如温度)[17,33]。
参考文献(References):
[1] Hedges J I,Ertel J R.Characterization of Lignin by Gas Capillary Chromatography of Cupric Oxide Oxidation Products[J].Analytical Chemistry,1982,(54):174-178.
[2] Hedges J I,Keil R G,Benner R.What happens to terrestrial organic matter in the ocean[J].Organic geochemistry,1997,27(5-6):195-212.
[3] Hedges J I,Mann D C.The characterization of plant tissues by their lignin oxidation products[J].Geochimica et Cosmochimica Acta,1979,43(11):1803-1807.
[4] Schillawski S,Petsch S.Release of biodegradable dissolved organic matter from ancient sedimentary rocks[J].Global Biogeochemical Cycles,2008,22(3):B3002.
[5] Zhang Y,Kaiser K,Li L,et al.Sources,distributions,and early diagenesis of sedimentary organic matter in the Pearl River region of the South China Sea[J].Marine Chemistry,2014,158:39-48.
[6] Seki O,Mikami Y,Nagao S,et al.Lignin phenols and BIT index distributions in the Amur River and the Sea of Okhotsk:Implications for the source and transport of particulate terrestrial organic matter to the ocean[J].Progress in Oceanography,2014,126:146-154.
[7] Amon R M W,Rinehart A J,Duan S,et al.Dissolved organic matter sources in large Arctic rivers[J].Geochimica et Cosmochimica Acta,2012,94:217-237.
[8] Mayer L M,Schick L L,Bianchi T S,et al.Photochemical changes in chemical markers of sedimentary organic matter source and age[J].Marine Chemistry,2009,113(1-2):123-128.
[9] Ouellet J,Lucotte M,Teisserenc R,et al.Lignin biomarkers as tracers of mercury sources in lakes water column[J].Biogeochemistry,2009,94(2):123-140.
[10] Heim A,Schmidt M W I.Lignin turnover in arable soil and grassland analysed with two different labelling approaches[J].European Journal of Soil Science,2007,58(3):599-608.
[11] Benner R,Biddanda B.Photochemical transformations of surface and deep marine dissolved organic matter:Effects on bacterial growth[J].Limnology and Oceanography,1998,43(6):1373-1378.
[12] Otto A,Simpson M J.Evaluation of CuO oxidation parameters for determining the source and stage of lignin degradation in soil[J].Biogeochemistry,2006,80(2):121-142.
[13] Carrington E M,Hernes P J,Dyda R Y,et al.Biochemical changes across a carbon saturation gradient:Lignin,cutin,and suberin decomposition and stabilization in fractionated carbon pools[J].Soil Biology and Biochemistry,2012,47:179-190.
[14] Spencer R G M,Stubbins A,Hernes P J,et al.Photochemical degradation of dissolved organic matter and dissolved lignin phenols from the Congo River[J].Journal of Geophysical Research,2009,114(G3).
[15] Benner R,Kaiser K.Biological and photochemical transformations of amino acids and lignin phenols in riverine dissolved organic matter[J].Biogeochemistry,2011,102(1-3):209-222.
[16] Ronald B,Stephen O.Molecular indicators of the sources and transformations of dissolved organic matter in the Mississippi river plume[J].Organic Geochemistry,2001,32(4):597-611.
[17] Hernes P J.Photochemical and microbial degradation of dissolved lignin phenols:Implications for the fate of terrigenous dissolved organic matter in marine environments[J].Journal of Geophysical Research,2003,108(C9).
[18] 鮑红艳,吴莹,张经.红树林间隙水溶解态陆源有机质的光降解和生物降解行为分析[J].海洋学报(中文版),2013,(03):147-154.(BAO Hong-yan,WU Ying,ZHANG Jing.Photo- and Bio-degradation of dissolved organic matter in mangrove pore-water[J].Acta Oceano-logica Sinica (in Chinese),2013,35(3):147-154.(in Chinese))
[19] Grannas A M,Shepson P B,Filley T R.Photochemistry and nature of organic matter in Arctic and Antarctic snow[J].Global Biogeochemical Cycles,2004,18(1):B1006.
[20] Feng X,Hills K M,Simpson A J,et al.The role of biodegradation and photo-oxidation in the transformation of terrigenous organic matter[J].Organic Geochemistry,2011,42(3):262-274.
[21] Opsahl S,Benner R.Photochemical reactivity of dissolved lignin in river and ocean waters[J].Limnology and Oveanography,1998,43(6):1297-1304.
[22] Hernes P J,Robinson A C,Aufdenkampe A K.Fractionation of lignin during leaching and sorption and implications for organic matter "freshness" [J].Geophysical Research Letters,2007,34(17).
[23] Hernes P J,Kaiser K,Dyda R Y,et al.Molecular Trickery in Soil Organic Matter:Hidden Lignin[J].Environmental Science & Technology,2013,47(16):9077-9085.
[24] Eriksson J P S K.Computational Studies of the Three-Dimensional Structure of Guaiacyl 08-O-4 Lignin Models[J].Holzforschung,1998.
[25] Opsahl S,Benner R.Distribution and cycling of terrigenous dissolved organic matter in the ocean[J].NATURE,1997,386(6624):480-482.
[26] Louchouarn P,Opsahl S,Benner R.Isolation and Quantification of Dissolved Lignin from Natural Waters Using Solid-Phase Extraction and GC/MS[J].Analytical Chemistry,2000,72(13):2780-2787.
[27] Goi M A,Montgomery S.Alkaline CuO Oxidation with a Microwave Digestion System:Lignin Analyses of Geochemical Samples[J].Analytical Chemistry,2000,72(14):3116-3121.
[28] Spencer R G M,Aiken G R,Dyda R Y,et al.Comparison of XAD with other dissolved lignin isolation techniques and a compilation of analytical improvements for the analysis of lignin in aquatic settings[J].Organic Geochemistry,2010,41(5):445-453.
[29] Goi M A,Ruttenberg K C,Eglinton T I.A reassessment of the sources and importance of land-derived organic matter in surface sediments from the Gulf of Mexico[J].Geochimica et Cosmochimica Acta,1998,62(18):3055-3075.
[30] Go I M A,Hedges J I.Lignin dimers:Structures,distribution,and potential geochemical applications[J].Geochimica Et Cosmochimica Acta,1992,56(11):4025-4043.
[31] 楊丽阳.沉积物中的木质素在物源示踪和环境演变研究中的应用初探[D].上海:华东师范大学,2009.131.(YANG Li-yang.Preliminary study on lignin Phenols in sediments for tracing terrigenous organic matter and reconstructing environmental change[D].Shanghai:East China Normal University,2009.131.(in Chinese))
[32] Hedges J I.Compositions and fluxes of particulate organic material in the Amazon River[J].Limnology & Oceanography,1986,31(4):717-738.
[33] Jex C N,Pate G H,Blyth A J,et al.Lignin biogeochemistry:from modern processes to Quaternary archives[J].Quaternary Science Reviews,2014,87:46-59.
[34] 龚岳.木质素降解动力学及其反应机理的研究[D].湖南:湖南农业大学,2012.60.(GONG Yue.The study on kinetic and reaction mechanism of degradation of lignin[D].Hunan:Hunan Agricultural University,2012.60.(in Chinese))
[35] 任哲,吴瑞平,刘蕊杰,等.麦草碱木素光催化降解光谱分析[J].中南林业科技大学学报,2014,(01):112-115.(REN Zhe,WU Rui-ping,LIU Rui-jie et al.Spectral analysis of wheat straw soda lignin with photocatalytic degradation[J].Journal of Central South University of Forestry & Technology,2014,(01):112-115.(in Chinese))
[36] Bonini C,Carbone A,D′Auria M.Singlet oxygen mediated degradation of lignin-a kinetic study[J].Photochemical & Photobiological Sciences,2002,1(6):407-411.
[37] Hon N.Formation of free radicals in photoirradiated cellulose and related compounds[J].Journal of Polymer Science:Polymer Chemistry Edition,1976,14(10):2513-2525.
[38] Lanzalunga,Bietti M.Photo- and radiation chemical induced degradation of lignin model compounds[J].J Photochem Photobiol B,2000,56(2-3):85-108.
[39] J.L G.Recent progress in understanding and inhibiting the light-induced yellowing of mechanical pulps[J].J Pulp Pap Sci,1994,20(6):J154-J160.
[40] Argyropoulos D S,Sun Y.Photochemically Induced Solid-State Degradation,Condensation,and Rearrangement Reactions in Lignin Model Compounds and Milled Wood Lignin[J].Photochemistry and Photobiology,1996,64(3):510-517.
[41] Neumann M G,Machado A E.The role of oxygen in the photodegradation of lignin in solution[J].Journal of Photochemistry and Photobiology B:Biology,1989,3(4):473-481.
[42] Schmidt J A,Heitner C.Light-Induced Yellowing of Mechanical and Ultrahigh Yield Pulps.Part 2.Radical-Induced Cleavage of Etherified Guaiacylglycerol-β-Arylether Groups is the Main Degradative Pathway[J].Journal of Wood Chemistry & Technology,1993,13(3):309-325.
[43] Garg S,Rose A L,Waite T D.Photochemical production of superoxide and hydrogen peroxide from natural organic matter[J].Geochimica et Cosmochimica Acta,2011,75(15):4310-4320.
[44] Zhang Y,Vecchio R D,Blough N V.Investigating the Mechanism of Hydrogen Peroxide Photoproduction by Humic Substances.[J].Environ.Sci.Technol.,2012,46(21):11836-11843.
[45] Santoke H,Song W,Cooper W J,et al.Advanced oxidation treatment and photochemical fate of selected antidepressant pharmaceuticals in solutions of Suwannee River humic acid[J].J Hazard Mater,2012,217-218:382-390.
[46] Vione D,Falletti G,Maurino V,et al.Sources and Sinks of Hydroxyl Radicals upon Irradiation of Natural Water Samples[J].Environ.Sci.Technol.,2006,40(12):3775-3781.
[47] De L,K.M.Microheterogeneity of singlet oxygen distributions in irradiated humic acid solutions[J].Science,2006,311(5768):1743-1747.
[48] Peterson B M,Mcnally A M,Cory R M,et al.Spatial and Temporal Distribution of Singlet Oxygen in Lake Superior[J].Environ.Sci.Technol.,2012,46(13):7222-7229.
[49] Gierer J,Yang E,Reitberger T.On the Significance of the Superoxide Radical in Oxidative Delignification,Studied with 4-t-Butylsyringol and 4-t-Butylguaiacol.Part I.The Mechanism of Aromatic Ring Opening[J].Holzforschung-International Journal of the Biology,Chemistry,Physics and Technology of Wood,1994,48(5):405-414.
[50] Reitberger J G T R,Reitberger T R.The Reactions of Hydroxyl Radicals with Aromatic Rings in Lignins,Studied with Creosol and 4-Methylveratrol[J].Holzforschung,1992,46(6):495-504.
[51] Cottrell B A,Timko S A,Devera L,et al.Photochemistry of excited-state species in natural waters:A role for particulate organic matter[J].Water Research,2013,47(14):5189-5199.
[52] 宋海農,王双飞,陈中豪.单线态氧与环境友好的纸浆漂白[J].中国造纸学报,2004,19(01) :198-193.(SONG Hai-nong,WANG Shuang-fei,CHENG Zhong-hao,et al.Singlet Oxygen and Environmentally Friendly Pulp Bleaching[J].Transaction of China Pulp and Paper,2004,19(01):198-193.(in Chinese))
[53] Crestini C,D′Auria M.Singlet oxygen in the photodegradation of lignin models[J].Tetrahedron,1997,53(23):7877-7888.
[54] 郭卫东,程远月,余翔翔,等.海洋有色溶解有机物的光化学研究进展[J].海洋通报,2008,(03):107-114.(GUO Wei-dong,CHENG Yuan-yue,YU Xiang-xiang,et al.An overview of the photochemistry of marine chromophoric dissolved organic matter[J].Marine science bulletin,2008,(03):107-114.(in Chinese))
[55] 程远月.沉积物间隙水中CDOM光学特性与河口CDOM光化学反应研究[J].福建:厦门大学,2007.124.(CHENG Yuan-yue.The study on optical characteristics of cdom in sediment pore waters and photochemistry of CDOM in estuarine waters.Fujian:Xiamen University,2007.124.(in Chinese))
[56] Kringsta.K P,Lin S Y.Mechanism in yellowing of high-yield pulps by light-structure and reactivity of free radical intermediates in photodegradation of lignin[J].Tappi,1970,53(12):2296.
[57] Forsskahl I.Aspects of photosensitized lignin oxygenation[J].Journal of photochemistry,1984,25(2-4):197-209.
[58] Mcnally A M,Moody E C,Mcneill K.Kinetics and mechanism of the sensitized photodegradation of lignin model compounds[J].Photochemical & Photobiological Sciences,2005,4(3):268.
[59] Cho D W,Parthasarathi R,Pimentel A S,et al.Nature and Kinetic Analysis of Carbon Carbon Bond Fragmentation Reactions of Cation Radicals Derived from SET-Oxidation of Lignin Model Compounds[J].The Journal of Organic Chemistry,2010,75(19):6549-6562.
[60] W杰·罗维尔.刘正添等译.实木化学[M].中国林业出版社,1988.(Rowell R.translated by LIU Zheng-tian et al.The chemistry of Solid Wood[M].China Forestry Publishing House,1988.(in Chinese))
[61] Andrews S S,Zafiriou O C.Photochemical oxygen consumption in marine waters:A major sink for colored dissolved organic matter[J].Limnology and Oceanography,2000,45(2):267-277.
[62] Opsahl S,Benner R.Early diagenesis of vascular plant tissues:Lignin and cutin decomposition and biogeochemical implications[J].Geochimica et Cosmochimica Acta,1995,59(23):4889-4904.
[63] Osburn C L,Morris D P,Thorn K A,et al.Chemical and optical changes in freshwater dissolved organic matter exposed to solar radiation[J].BIOGEOCHEMISTRY,2001,54(3):251-278.
[64] Hernes P J,Benner R.Transport and diagenesis of dissolved and particulate terrigenous organic matter in the North Pacific Ocean[J].Deep Sea Research Part I:Oceanographic Research Papers,2002,49(12):2119-2132.
[65] A.M P.Organic geochemical proxies of paleoceanographic,paleolimnologic,and paleoclimatic processes[J].Organic Geochemistry,1997,27(97):213-250.
[66] Benner R,Fogel M L,Sprague E K,et al.Depletion of c-13 in lignin and its implications for stable carbon isotope studies[J].Nature,1987,329(6141):708-710.
[67] Opsahl S P,Zepp R G.Photochemically-induced alteration of stable carbon isotope ratios (δ 13 C) in terrigenous dissolved organic carbon[J].Geophysical Research Letters,2001,28(12):2417-2420.
[68] Vahatalo A V,Salonen K,Salkinoja-Salonen M,et al.Photochemical mineralization of synthetic lignin in lake water indicates enhanced turnover of aromatic organic matter under solar radiation[J].Biodegradation,1999,10(6):415-420.
[69] 鮑红艳.溶解态和颗粒态陆源有机质在典型河流和河口的来源、迁移和转化[D].上海:华东师范大学,2013.(BAO Hong-yan.The sources,transportations and transformations of dissolved and particulate terrestrial organic matter in typical river and estuary systems[D].Shanghai:East China Normal University,2013.(in Chinese))
[70] Spencer R G M,Aiken G R,Wickland K P,et al.Seasonal and spatial variability in dissolved organic matter quantity and composition from the Yukon River basin,Alaska[J].Global Biogeochemical Cycles,2008,22(4):116-122.
[71] Lobbes J R M,Fitznar H P,Kattner G.Biogeochemical characteristics of dissolved and particulate organic matter in Russian rivers entering the Arctic Ocean[J].Geochimica et Cosmochimica Acta,2000,64(17):2973-2983.
[72] Ward N D,Keil R G,Medeiros P M,et al.Degradation of terrestrially derived macromolecules in the Amazon River[J].Nature Geoscience,2013,6(7):530-533.
[73] Fichot C G,Benner R.The spectral slope coefficient of chromophoric dissolved organic matter (S275-295) as a tracer of terrigenous dissolved organic carbon in river-influenced ocean margins[J].Limnology and Oceanography,2012,57(5).
[74] Yamashita Y,Fichot C G,Shen Y,et al.Linkages among fluorescent dissolved organic matter,dissolved amino acids and lignin-derived phenols in a river-influenced ocean margin[J].Frontiers in Marine Science,2015,2.
[75] 边叶萍,翁成郁.孢粉稳定碳同位素研究进展[J].海洋地质与第四纪地质,2009,(03):141-148.(BIAN Ye-ping,WENG Cheng-yu.An overview of carbon stable isotope analysis of pollen[J].Marine Geology & Quaternary Geology,2009,(03):141-148.(in Chinese))
[76] Tareq S,Tanaka N,Ohta K.Biomarker signature in tropical wetland:lignin phenol vegetation index (LPVI) and its implications for reconstructing the paleoenvironment[J].Science of The Total Environment,2004,324(1-3):91-103.
[77] Tareq S M,Kitagawa H,Ohta K.Lignin biomarker and isotopic records of paleovegetation and climate changes from Lake Erhai,southwest China,since 18.5kaBP[J].Quaternary International,2011,229(1-2):47-56.

