小麦雄性不育系AL18A育性恢复基因的QTL定位
桂安胜,聂迎彬,马 丽,徐红军,李瑞博,刘小芳,孔德真,张晓科,穆培源
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.新疆农垦科学院作物研究所,新疆石河子 832000)
小麦雄性不育系AL18A育性恢复基因的QTL定位
桂安胜1,聂迎彬2,马 丽1,徐红军2,李瑞博1,刘小芳2,孔德真2,张晓科1,穆培源2
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.新疆农垦科学院作物研究所,新疆石河子 832000)
为加快AL型杂交小麦的发展,以不育系AL18A、恢复系99AR144-1及二者杂交F2代群体为材料,选用SSR标记和分离群体分组分析法进行育性恢复基因的QTL定位。结果表明,育性恢复由主效和微效基因共同控制,采用复合区间作图法分析,在1B染色体上检测到了1个主效恢复基因QTL qRf-1B-1,在5AL染色体上检测到了1个微效QTL qRf-5A-1。 qRf-1B-1位于SSR标记Xbarc8与Xgwm413之间,与两标记的遗传距离分别为0.85 cM和2.00 cM,LOD值为14.06,加性效应为18.87,可解释22.43%的表型变异; qRf-5A-1位于SSR标记Xgwm595与Xgwm410之间,与两标记的遗传距离分别为10.00 cM和0.10 cM,LOD值为3.18,加性效应为12.32,可解释5.44%的表型变异。
小麦;AL型不育系;恢复基因;QTL
采用细胞质雄性不育系配制杂交种,是小麦杂种优势利用的重要途径之一。利用三系法配置的小麦AL型杂交种“新冬43号”已被审定并在生产上推广[1]。三系杂交小麦成功应用的关键之一是要求杂种F1具有高的结实率,这一特性受控于恢复性高的优良恢复系。然而,选育恢复系相对常规育种选育要求更高,既要具备优良农艺性状,还应包含有相应的恢复基因。通过常规育种方法选育恢复系,工作量大,周期长,选育后代是否含有恢复基因还需要与不育系测交以及测交后代育性观察才可判定。利用与恢复基因紧密连锁的分子标记,就可在当代完成多份待选材料恢复基因鉴定,也可进行恢复基因累加,选育高恢复度的恢复系。细胞质雄性不育系育性恢复基因定位,可获得紧密连锁分子标记,能为杂交小麦的育种和大面积推广提供基础。
随着分子生物学水平的发展,利用DNA分子标记逐步开展了小麦育性相关基因的定位,其中,RFLP是最早被运用于该类基因定位的分子标记。Ma等[2-3]采用RFLP技术对T型不育恢复系R113( Rf3、Rf4)、Primepi和2114( Rf6)的恢复基因分别进行了定位, Rf3基因定位在1BS上,且与标记Xcdo442和Xbcd249紧密连锁, Rf4基因定位在6BS上,且与标记Xksug48紧密连锁,Primepi的恢复基因定位在5D上,且与Xcdo786紧密连锁, Rf6基因位在6AS上。随后,SSR分子标记又被广泛运用于育性相关基因定位分析。Zhou等[4]和Sinha等[5]利用SSR标记技术对T型雄性不育系的恢复基因进行了定位研究,检测到 Rf3和 Rf8分别位于1B和2D染色体上。Song等[6]通过712对SSR引物筛选,将K型不育系的恢复基因定位在1B和2A染色体上。Guo等[7]采用分离群体分组分析法(BSA)与SSR相结合的技术手段,将337S的不育基因定位于2B和5B染色体上。Xing等[8]利用SSR和AFLP方法分析温敏不育系BNY-S/兰考52-24的F2群体,将1个温敏基因定位在2B染色体上,命名为 wtms1。Ru等[9]利用SSR分子标记对温敏不育系BS20-T/ZN7的162株极端不育和30株可育F2单株进行分析,检测到不育基因位于2B染色体上,且与标记Xgwm403和Xgwm374连锁。田再民等[10]采用SSR和EST-SSR分析小麦光温敏核雄性不育系的DH群体,将不育基因定位在1B、2B和3A染色体上。
王世杰等[11]研究表明,小麦AL型雄性不育系能被90%以上的普通小麦品种保持,连续回交转育成的不育系不育度达100%,且不育性在不同年份气候条件下保持稳定。Liu等[12]采用SSR分子技术对不育系AL18A与恢复系99AR144-1杂交的F2代分离群体进行育性恢复基因分析,检测到2A染色体上的标记Xgwm95和1B染色体上的标记Xbarc61分别与AL型小麦的2对恢复基因连锁,遗传距离分别是15 cM和18 cM。因遗传连锁距离较远,需要进一步标记加密验证定位结果。为此,本研究拟用SSR标记和BSA方法对AL18A×99AR144-1的F2代分离群体进行分析,旨在定位不育系AL18A的育性恢复基因,获得紧密连锁标记,为加快AL型杂交小麦的发展奠定基础。
1 材料与方法
1.1 材 料
本研究以不育系AL18A、恢复系99AR144-1及二者杂交F2代群体(263株)为试验材料。AL18A 是AL 型不育系781A与普通小麦多代回交转育20代而成的稳定不育系,在新疆石河子和陕西杨凌两地均表现完全不育;恢复系99AR144-1的农艺性状好,且高度散粉,恢复能力强。种子由新疆农垦科学院作物研究所穆培源研究员提供。
1.2 方 法
1.2.1 试验材料的种植和结实率调查
亲本及其F2代群体于2014年种植于陕西杨凌西北农林科技大学试验田中。试验小区行长1 m,行距0.25 m,株距0.06 m,栽培管理同当地大田。每隔7行种植父母本各1行作为对照,控制田间试验误差。
幼苗期对亲本及F2代单株挂牌编号及取相应单株叶片用于基因组DNA提取。对所挂牌单株主茎穗开花前进行套袋自交,成熟后单株单穗收获,进行室内考种,以国内法进行单株主茎自交结实率计算。自交结实率(%)=有效小穗基部两侧小花结实数/(有效小穗数×2)×100%。
1.2.2 基因组DNA的提取及DNA池的构建
采用CTAB法[13]提取小麦叶片基因组DNA,用1×TE稀释成50 ng·μL-1。参照Michelmore等[14]提出的BSA分析法,根据F2代单株主茎自交结实率的统计结果,随机选取8株结实率大于80%的可育单株DNA等量混合组成可育池(F),8株结实率为0的完全不育单株DNA等量混合组成不育池(S) 。
1.2.3 SSR标记分析
参照Somers等[15]和GrainGenes网站(http://wheat.pw.usda.gov/GG3/ )提供的引物序列信息,交由上海生工生物工程技术服务有限公司合成了分布于小麦21条染色体的1 480对SSR引物。筛选出在亲本间有多态性的引物,然后将多态性引物在可育池和不育池中进行PCR扩增。PCR反应总体系为10 μL,包括10×PCR Buffer (含 Mg2+) 1 μL、dNTPs(10 mmol·L-1) 0.8 μL、正反向引物(10 μmoL·L-1)各0.5 μL、模板DNA(50 ng·μL-1) 1 μL、TaqDNA聚合酶 (5 U·μL-1) 0.2 μL、ddH2O 6 μL。PCR反应在MyCycler Thermal Cycle上进行,程序为:94 ℃预变性5 min;94 ℃变性1 min,50~60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min,4 ℃保存。在扩增产物中加入4 μL上样缓冲液(98%甲酰胺、10 mmol·L-1EDTA、0.025%溴酚兰、0.025%二甲苯青,pH 8.0),95 ℃变性后立即置于冰水混合物上待用,随后在1×TBE缓冲液中用6%变性聚丙烯酰胺凝胶分离。电泳结束后,10%醋酸固定20 min,双蒸水漂洗3次,0.1% AgNO3(含0.15%甲醛)染色10 min,双蒸水漂洗5~10 s,1.5% NaOH(含0.4%甲醛)显影至出现清晰条带,双蒸水漂洗,记录和分析检测结果。
1.2.4 连锁图谱构建与QTL定位
F2群体表型数据结合PCR扩增带型用于遗传连锁分析。F2群体单株的扩增带型与母本AL18A相同的记为0,与父本99AR144-1相同的记为2,缺失的记为-1。采用IciMapping V4.0(http://www.isbreeding.net/)软件计算标记与恢复基因间的遗传距离。采用MapDraw V2.1软件构建遗传连锁图谱。采用复合区间作图法检测恢复基因的QTL,取LOD值2.5为阈值。
2 结果与分析
2.1 亲本及其后代的自交结实率
由图1可知,30株不育系AL18A的自交结实率均为0,表现为完全不育;23株恢复系99AR144-1的平均自交结实率为86.4%,不育系与恢复系之间的结实率存在明显差异。由大田F2代263个单株套袋自交结实率的样本分布图来看,F2群体结实率表现出数量性状遗传特点,适合进行QTL分析。群体结实率分布特点呈现偏态分布,存在可育峰,说明育性恢复由主效基因控制,同时也受到微效基因影响,为多基因控制的数量性状。
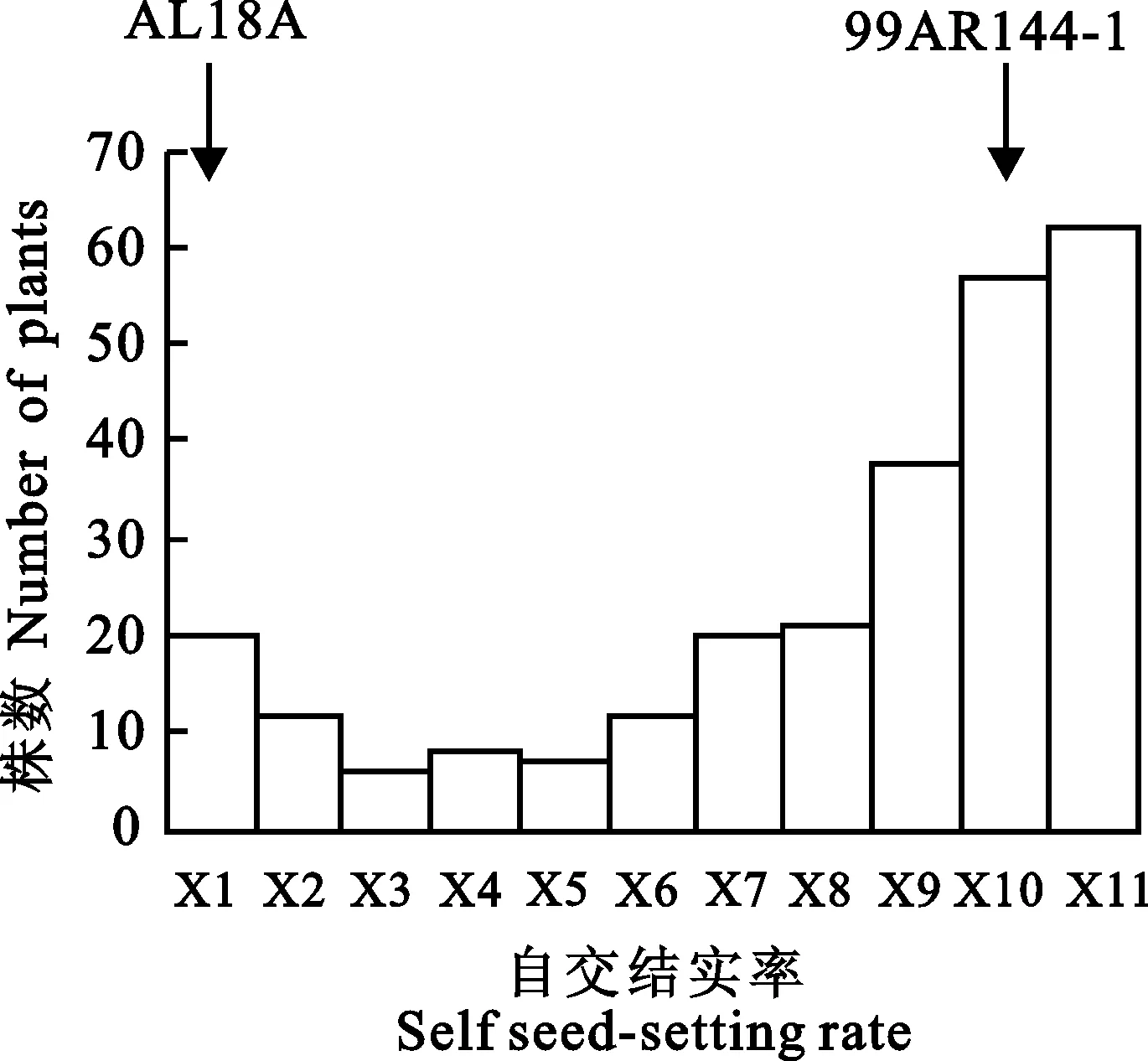
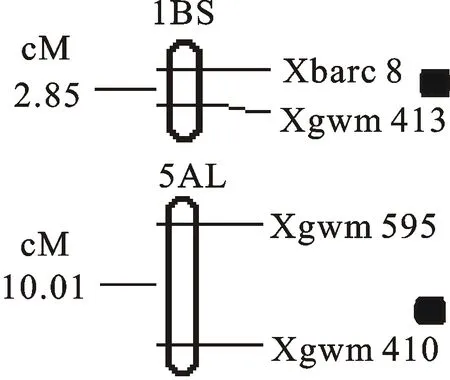
X1=0;0 图1 AL18A与99AR144-1杂交F2群体自交结实率的样本分布图 Fig.1 Self seed-setting sample distribution of F2population from a cross between AL18A and 99AR144-1 2.2 BSA法筛选恢复基因连锁的分子标记 首先用分布于小麦21条染色体的1 480对SSR引物在亲本间进行初筛,其中560对出现多态性,多态性为37.8%,对出现多态性的引物在BSA池中作进一步筛选,只有位于1BS染色体上的两个标记Xbarc8、Xgwm413在F池与S池中有多态性(图2),表明1BS染色体上SSR标记Xbarc8与Xgwm413周围存在育性恢复基因。 Liu等[12]在1B和2A染色体上定位到不育系AL18A的恢复基因,而本研究只在1B染色体上筛选到双亲和池间有多态性的SSR引物。为此,又选用T型、K型等雄性不育系育性恢复基因所在1A、2A、4B、5A、6B、7B的染色体区段且在亲本AL18A和99AR144-1间有稳定差异的SSR引物,进行F2群体局部连锁图谱的构建和QTL分析,寻找其他恢复基因的位置。 P1:99AR144-1;P2:AL18A;F:可育池;S:不育池;1~8:部分F2单株。 P1:99AR144-1; P2: AL18A; F:Fertile pool; S:Sterile pool;1-8:Part of individuals from F2population. 图2 SSR标记Xbarc8、Xgwm413在双亲、可育与不育池及部分F2单株中的扩增结果 Fig.2 PCR amplification of SSR markers Xbarc8 and Xgwm413 in parents,bulks,and partial F2individuals 2.3 F2群体局部遗传连锁图谱构建及QTL定位 构建的染色体1A、1B、2A、4B、5A、6B、7B局部遗传连锁图谱覆盖了小麦基因组136.49 cM,标记间平均遗传距离为6.20 cM(小于15~20 cM),符合小麦QTL定位的必要条件[16]。 采用IciMapping V4.0软件的复合区间作图法,对不育系AL18A育性恢复基因进行定位分析。在1BS和5AL染色体区段上,分别发现1个与恢复基因相关的QTL位点(图3)。1B染色体上的位点暂命名为 qRf-1B-1,位于SSR标记Xbarc8与Xgwm413之间,与Xgwm413和Xbarc8的遗传距离分别为2.00 cM和0.85 cM,LOD值为14.06,加性效应为18.87,对表型变异的贡献率为22.43%,为1个主效QTL位点。5A染色体上的QTL暂命名为 qRf-5A-1,位于SSR 标记Xgwm595与Xgwm410之间,与Xgwm595和Xgwm410的遗传距离分别为10.00 cM和0.10 cM,LOD值为3.18,加性效应为12.32,对表型变异的贡献率为5.44%,为1个微效的QTL位点。由于以上得到的主效和微效QTL位点均表现为正加性效应,说明这2个QTL位点的增效等位基因来源于恢复系99AR144-1。 黑色实心方框表示恢复基因的QTL位置。 Black solid box indicated the location of QTL for restorer genes. 图3 F2群体局部遗传连锁图谱及恢复基因的QTL位置 Fig.3 Genetic linkage map of F2population and the QTL positions of the restorer genes 3.1 BSA与QTL分析方法的结合应用 作物育性具有典型的数量性状特点,后代呈连续性分布,很多定位研究者人为划分和确定分离群体中各单株基因型,具有一定的主观性和随意性,影响基因定位的准确性。随着科学技术的进步,采用QTL分析相关软件可直接将育性表型数据与遗传图谱上各个分子标记区间的可能位置分别进行检测,从中筛选出一个最恰当的QTL位置,结果更加客观公正。郑建敏等[17]以组合SCT-1×B2183的F2群体为材料,结合QTL分析和BSA方法,找到2个主效育性基因,分别位于2B和5D上。池慧芳[18]利用BSA和SSR标记技术对光温敏不育系BS210/O201构建的DH系进行分析,将育性主效QTL分别定位在2A、2B和3A染色体上。张立平等[19]以光温敏不育系BS20×Fu3的DH群体为材料,综合BSA和QTL分析结果,将育性QTL定位在7D和2B染色体上。本研究同样利用BSA与QTL相结合的方法在1BS染色体上定位到1个主效恢复基因。由此看出,采用QTL与BSA法相结合的技术可以更加快速准确定位到数量性状的主效基因位点,可以省时省力。 3.2 小麦育性恢复基因的染色体分布 恢复基因的遗传研究对恢复系选育具有重要的意义。已在小麦1A、1B、4A、4B、5A、5D、6A、6B、6D、7B和7D染色体上发现了11个分别来自提莫菲维小麦、普通小麦以及其野生近缘种T型不育系的恢复基因不同主效 Rf基因座 ( Rf1~Rf11),表明恢复基因分布范围广且复杂。张 萃等[20]利用SSR标记在T型不育系75-3369A×恢复系7269-10的F2群体中进行筛选,将 Rf1和 Rf3分别定位于染色体1AS和1BS上,其中恢复基因 Rf1与SSR标记Xgwm136的遗传距离为6.7 cM,恢复基因 Rf3与SSR标记Xgwm550的遗传距离为5.1 cM。刘保申等[21]采用79对SSR标记引物对(K冀5418A//911289/LK783)的三交F1分离群体进行多态性分析,找到1BS上与K型育性恢复基因连锁的标记Xgwm11、Xgwm18 和 Xgwm273。周菊红等[16]以YM型温敏雄性不育系ATM3314与恢复系中国春组配的F2代群体为作图群体,构建了1个包含5对标记的1BS局部遗传连锁图谱,并结合F2代个体的育性调查,采用复合区间作图法在1BS染色体上检测到不育基因的1个主效QTL位点,位于标记Xgwm18与Xwmc406之间,距两标记的遗传距离分别为6.0 cM和4.6 cM,可解释表型变异的23.91%。董普辉等[22]找到了1B染色体上与育性恢复基因 Rf3遗传距离连锁的标记Xbarc8和Xgwm18。郭艳萍等[23]对粘性雄性不育系育性恢复基因进行定位,经过分离群体验证表明,恢复基因位于1BS染色体上,4对SSR标记及恢复基因之间的顺序依次为Xwmc406、 Rfv1、Xbarc8、Xwmc611、Xgwm273。本研究同样表明,不育系AL18A的育性恢复基因位于1BS染色体上,并且与Xbarc8、Xgwm413紧密连锁,推断位于1BS2-1.06区段,与T型不育系、粘型不育系有1个相同的连锁标记Xbarc8[20-21],推测染色体1BS这一区段上有成簇存在的恢复基因。本实验在2A染色体上没有检测到与育性恢复基因相关的QTL位点,可能跟该染色体上进行群体扩增的SSR标记密度不够大有关,或者Liu等[12]在2A染色体上定位到的恢复基因是个微效基因,在不同环境和不同年份具有不稳定性。另外,本研究在5A染色体长臂上定位到1个微效QTL,Zhou等[4]研究也表明T型不育系的5A染色体上有1个影响育性的微效QTL,是否为同1个QTL有待进一步验证。本研究只进行了局部连锁图的绘制和QTL分析,且未在绘制的2A染色体上找到主效基因,还需要筛选更多引物或者全基因组扫描检测多年种植群体分析,确定主效恢复基因的个数及位置。本研究获得位于1B染色体上2个紧密连锁的共显性SSR标记,可以应用于AL型三系杂交小麦分子标记辅助选择育种。 [1] 聂迎彬,田笑明,韩新年.高产优质杂交小麦新品种-新冬43号[J].麦类作物学报,2014,34(11):封2. NIE Y B,TIAN X M,HAN X N.High yield and good quality of hybrid wheat variety-Xindong 43 [J].JournalofTriticeaeCrops,2014,34(11):cover page 2. [2]MA Z Q,SORRELLS M E.Genetic analysis of fertility restoration in wheat using restriction fragment length polymorphisms[J].CropScience,1995,35(5):1137. [3]MA Z Q,SORRELLS M E,ZHAO Y H.Inheritance and chromosomal locations of male fertility restoring gene transferred fromAegilopsumbellulataZhuk.toTriticumaestivumL.[J].MolecularandGeneralGenetics,1995,247(3):351. [4]ZHOU W,KOLB F L,Domier L L,etal.SSR markers associated with fertility restoration genes againstTriticumtimopheeviicytoplasm inTriticumaestivum[J].Euphytica,2005,141(2):33. [5]SINHA P,TOMAR S,SINGH V K,etal.Genetic analysis and molecular mapping of a new fertility restorer gene Rf8 forTriticumtimopheevicytoplasm in wheat (TriticumaestivumL.) using SSR markers [J].Genetica,2013,141(10):431. [6]SONG X Y,QIAN H H,ZHANG L L,etal.Cytogenetic analysis of cytoplasmic male sterility in wheat line KTP116A and molecular mapping of two thermo-sensitive restoration genes [J].Euphytica,2014,196(1):129. [7]GUO R X,DONG D F,TAN Z B,etal.Two recessive genes controlling thermopoto-period sensitive male sterility in wheat [J].TheoreticalandAppliedGenetics,2006,112(7):1271. [8]XING Q H,RU Z G,ZHOU C J,etal.Genetics analysis,molecular tagging and mapping of the thermosensitive genic male sterile gene( wtms1)in wheat [J].TheoreticalandAppliedGenetics,2003,107(8):1500. [9]RU Z G,ZHANG L P,HU T Z,etal.Genetic analysis and chromosome mapping of a thermo-sensitive genic male sterile gene in wheat [J].Euphytica,2015,201:321. [10] 田再民,张立平,王丽辉,等.小麦“BS20×Fu3”DH群体SSR遗传图谱的构建及不育基因的QTL定位[J].植物遗传资源学报,2015,16(4):857. TIAN Z M,ZHANG L P,WANG L H,etal.Construction of a SSR genetic linkage map of wheat using DH population derived from BS20×Fu3 and mapping QTLs for sterile gene [J].JournalofPlantGeneticResources,2015,16(4):857. [11] 王世杰,茹振刚.AL型普通小麦胞质雄性不育系及其核恢复基因的发现与研究简报[J].河南职技师院学报,1990,18(1):15. WANG S J,RU Z G.The discovery of nuclear restoring genes with AL-type male sterile lines in common wheat and research notes [J].JournalofHenanProfessionalTechnicianInstitute,1990,18(1):15. [12]LIU X F,TIAN X M,NIE Y B,etal.Genetic analysis of fertility restoring genes for AL-type male sterility in wheat [J].EngineeringSciences,2013,11(5):30. [13]SHARP P J,KREIS M,SHEWRY P R,etal.Location of β-amylase sequence in wheat and its relatives [J].TheoreticalandAppliedGenetics,1988,75(5):286. [14]MICHELMORE R W,PARAN I,KESSELI R V.Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapid method to detect markers in specific genomic regions by using segregating populations [J].ProceedingsoftheNationalAcademyofSciences,1991,88(3):9828. [15]DARLY J,SOMERS,ISAAC P,etal.A high-density microsatellite consensus map for bread wheat (TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2004,109(6):1105. [16] 周菊红,李 轲,何蓓如,等.YM型小麦温敏雄性不育系不育基因的QTL定位[J].作物学报,2010,36(12):2045. ZHOU J H,LI K,HE B R,etal.Mapping QTLs for male sterile gene in YM-type thermo-sensitive male sterile line of wheat [J].ActaAgronomicaSinica,2010,36(12):2045. [17] 郑建敏,蒲宗君,李式昭,等.小麦温敏不育系SCT-1育性基因初步定位分析[J].分子植物育种,2015,13(4):775. ZHENG J M,PU Z J,LI S Z,etal.Preliminary molecular mapping of male sterility genes in thermo-sensitive male sterility wheat line SCT-1 [J].MolecularPlantBreeding,2015,13(4):775. [18] 池慧芳.小麦光温敏雄性不育性及红叶耳的QTL分析[D].呼和浩特:内蒙古农业大学,2008:43. CHI H F.QTL mapping for photoperiod-thermo sensitive genic male sterility and red-auricle gene in wheat [D].Huhhot:Inner Mongolia Agricultural University,2008:43. [19] 张立平,田再民,赵昌平,等.小麦光温敏核雄性不育系BS20育性的QTL分析[J].农业生物技术学报,2010,18(3):437. ZHANG L P,TIAN Z M,ZHAO C P,etal.QTL mapping for photoperiod-temperature sensitive genic male sterility of BS20 in common wheat [J].JournalofAgriculturalBiotechnology,2010,18(3):437. [20] 张 萃,王宏英,沈银柱,等.用微卫星标记定位小麦T型CMS的恢复基因[J].遗传学报,2003,30(5):459. ZHANG C,WANG H Y,SHEN Y Z,etal.Location of the fertility restorer gene for T-type CMS wheat by microsatellite marker [J].ActaGeneticaSinica,2003,30(5):459. [21] 刘保申,孙其信,高庆荣,等.K型小麦细胞质雄性不育系育性恢复基因的SSR分子标记分析[J].中国农业科学,2002,35(4):354. LIU B S,SUN Q X,GAO Q R,etal.Mapping of fertility restoring gene forAegilopskotschycytoplasmic male sterility in wheat using SSR markers [J].ScientiaAgriculturaSinica,2002,35(4):354. [22] 董普辉,胡银岗,林凡云,等.来自莫迦小麦(T.macha)的T型恢复基因 Rf3和K型不育基因 rfv1的SSR分析[J].麦类作物学报,2009,29(5):766. DONG P H,HU Y G,LIN F Y,etal.SSR markers analysis of T-type restorer gene Rf3 and K-type male sterile gene rfv1 derived fromTriticummachaL.[J].JournalofTriticeaeCrops,2009,29(5):766. [23] 郭艳萍,张改生,程海刚,等.小麦粘类CMS育性恢复基因的SSR分子标记与定位[J].核农学报,2009,23(5):729. GUO Y P,ZHANG G S,CHENG H G,etal.Mapping of fertility restoring gene for male sterility withAe.kotschyi,Ae.variabilis,Ae.ventricosacytoplasms by using SSR markers in wheat [J].JournalofNuclearAgriculturalSciences,2009,23(5):729. Mapping QTLs of Fertility Restoring Genes for AL-type Male Sterility Line AL18A in Wheat GUI Ansheng1,NIE Yingbin2,MA Li1,XU Hongjun2,LI Ruibo1, LIU Xiaofang2,KONG Dezhen2,ZHANG Xiaoke1,MU Peiyuan2 (1.College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China; 2.Institute of Crop Research,Xinjiang Academy of Agri-Reclamation Sciences,Shihezi,Xinjiang 832000,China) In order to promote the development of AL-type hybrid wheat,the fertility QTLs in the F2population derived from a cross between AL18A and 99AR144-1 were mapped by using SSR markers and bulked segregation analysis. The results showed that the fertility was controlled by the major and minor genes. QTLs were detected using composite interval mapping method. One major QTL and one minor QTL were detected,which were designated as qRf-1B-1 and qRf-5A-1,respectively. The QTL qRf-1B-1 was located between the SSR markers Xbarc8 and Xgwm413 on short arm of chromosome 1B with genetic distances of 0.85 cM and 2.00 cM,respectively. The LOD value for this locus was 14.06,and the gene effect was 18.87 for additive effect. This QTL explained 22.43% of the phenotypic variation. The QTL qRf-5A-1 was mapped on long arm of chromosome 5A between markers Xgwm595 and Xgwm410 with genetic distances of 10.00 cM and 0.10 cM,respectively.The LOD value of this QTL was 3.18. This locus had additive effect of 12.32,and explained 5.44% of the phenotypic variation. Wheat; AL-type male sterile lines; Restorer genes; QTL 时间:2017-01-03 2016-08-16 2016-12-09 新疆兵团十二五种质资源专项(2012BB048);兵团科技攻关与成果转化计划项目(2015AC001);兵团十三五小麦育种攻关项目(2016AC027); 西北农林科技大学唐仲英育种基金项目 E-mail:xinong2109@163.com 张晓科(E-mail:zhangxiaoke66@126.com);穆培源(E-mail:mupy@sohu.com) S512.1;S334 A 1009-1041(2017)01-0001-06 网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170103.1625.002.html
3 讨 论

