玉米C4光合酶基因导入对拟南芥光合特性及抗旱性的影响
雷明月,许为钢,李小博,张庆琛1,,王会伟,张 磊,方宇辉,李 艳,李春鑫
(1.河南农业大学农学院,河南郑州 450002; 2.河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室,河南郑州 450002 )
玉米C4光合酶基因导入对拟南芥光合特性及抗旱性的影响
雷明月1,2,许为钢2,李小博2,张庆琛1,2,王会伟2,
张 磊2,方宇辉2,李 艳2,李春鑫2
(1.河南农业大学农学院,河南郑州 450002; 2.河南省农业科学院小麦研究所/小麦国家工程实验室/农业部黄淮中部小麦生物学与遗传育种重点实验室,河南郑州 450002 )
为了解玉米C4型光合酶基因对C3植物拟南芥光合特性的影响及其对干旱胁迫的响应,分别以过表达ZmPEPC(磷酸烯醇式丙酮酸羧化酶)、ZmPPDK(丙酮酸磷酸二激酶)和ZmNADP-ME(依赖于NADP的苹果酸酶)单个酶基因的拟南芥株系(分别简写为PC、PK、ME),以及过表达PEPC+PPDK和PPDK+NADP-ME两个酶基因的拟南芥株系(分别简写为PCK、PKM)为供试材料,在开花期停止浇水,并分别于干旱胁迫处理前1天、第5天、第10天和结束干旱胁迫复水处理5 d时测定转基因拟南芥中目标基因的表达量、光合速率、水分利用效率和酶活性。结果表明,在正常生长条件下,PCK类型株系的PEPC酶活性、PPDK酶活性、净光合速率(Pn)以及水分利用效率(WUE)较野生型拟南芥分别高52%、20%、24%和55%,除PPDK酶活性外,PCK类型株系各指标测定值的增幅均高于其他转基因类型株系,综合表现最优。不同类型株系的上述测定指标总体表现为PCK>PC>PK、PKM>ME。干旱胁迫处理5 d时,各类型株系中目标基因的表达量、光合酶活性、Pn和WUE均有所上升。干旱胁迫处理10 d时,拟南芥受到严重损伤,上述指标的测定值均下降。复水5 d时上述指标得到不同程度的恢复,不同类型转基因株系的各项测定指标在不同干旱胁迫处理中总体仍表现为PCK最优,PC次之。各转基因株系均优于受体非转基因拟南芥。
拟南芥;干旱胁迫;转基因;C4光合途径关键酶基因;玉米
大量研究证实,与C3植物相比,C4植物具有更好的光合性能,对高温、强光及干旱环境也具有更好的适应能力[1],因此通过基因工程将C4植物的C4光合途径关键酶基因转入C3植物,以增强C3植物光合性能和耐胁迫能力已成为国内外作物遗传改良研究的热点之一。目前人们已成功将C4植物的若干C4型光合酶基因导入C3植物,在水稻[2]、小麦[3-5]、拟南芥[6]等植物中获得了高效表达C4型光合酶基因PEPC、PPDK和NADP-ME的转基因植株。关于C4光合酶基因导入C3植物能否提高C3植物的光合效率,目前的试验结果仍存在一些分歧[7-10]。已有许多研究表明,过表达C4-PEPC、C4-PPDK基因可显著提高水稻、小麦等C3植物的光合性能,并增强其抗逆性[11-14]。还有报道表明,过表达PEPC+PPDK双基因的拟南芥[9]和水稻[15]的光合速率高于单转PEPC基因,而过表达单个NADP-ME基因的转基因C3植株光合速率无明显变化或降低[16-17]。因此,研究C4光合酶基因在C3植物中的表达与功能,比较不同C4光合酶基因及基因组合导入C3植物中的功能差异,对改良C3植物的光合性能和抗逆性具有重要意义。
拟南芥是模式植物,生长周期短、基因组小、易于转化和人工杂交,利于遗传研究。本研究利用本课题组已获得的5类过表达玉米C4光合酶基因的拟南芥株系为材料[6],比较不同转基因株系在不同水分处理条件下的光合特性,旨在深入了解C4型光合酶基因及其基因组合对C3植物光合特性及抗旱性的影响,为小麦高光效基因工程研究提供依据。
1 材料与方法
1.1 试验材料
供试的转基因拟南芥材料分别为转玉米C4光合酶基因ZmPEPC的3个株系(简写为PC73、PC65、PC90),转ZmPPDK基因的3个株系(简写为PK16、PK26、PK36),转ZmNADP-ME基因的3个株系(简写为ME4、ME5、ME9),转ZmPEPC+ZmPPDK基因的3个株系(简写为PCK5、PCK7、PCK110)和转ZmPPDK+ZmNADP-ME基因的3个株系(简写为PKM2、PKM4、PKM5)。以转基因受体拟南芥GLI(哥伦比亚型拟南芥)为对照。以上试验材料均由河南省农业科学院小麦研究所分子育种研究室提供。
1.2 试验方法
1.2.1 试验材料的种植与水分胁迫处理
所有供试材料种植于人工气候室,气候室环境为温度22~24 ℃,湿度60%;每天光照10 h/黑暗14 h,光照强度为200 μmol·m-2·s-1。所有供试的转基因拟南芥在开花期前正常供水,开花期停止浇水,干旱胁迫处理10 d,分别于水分胁迫处理前1天、第5天和第10天测定光合有关参数,水分胁迫处理10 d后恢复浇水一次,复水5 d后再测定光合有关参数。每个株系测定4个单株,每个单株重复测定3次。
1.2.2 转基因拟南芥的PCR验证
待幼苗长出6~8片真叶后,取叶片提取DNA进行PCR验证。引物分别为PC1:5′-GCAGATCTGCTCCAACCATCTCGCTTCCGT G-3′和PC2:5′-GGCACGTGGCCGCCTAGCC AGTGTTCTGCAT-3′;ME1:5-GTCCATGGT CCGAAGAGGGAGGAGGACGAC-3′和ME2:5′-AACACGTGTCCAGCAGCACCAGCAACA AGG-3′;PK1:5′-GCAGATCTTCGGCTCCCT CTCCCCTTGCTCCAT-3′和PK2:5′-GGTTAT AACACATCCACCAGCAGCAGGCAATCC-3′。
1.2.3 转基因拟南芥的qRT-PCR分析
取开花期水分胁迫处理不同时间的参试材料叶片100 mg,利用超纯RNA提取试剂盒提取叶片总RNA,利用反转录试剂盒将其反转为cDNA,采用SYBR Green染料法进行PCR扩增。用 Bio-Rad 的IQ5荧光定量PCR仪分析目标基因表达量[17]。PEPC、PPDK引物参照Wang等[9],NADP-ME引物为ME9:5′-CGTGGAGT ACGAAGGAAAGACT-3′和ME10:5′-GAGAT CTTTCTGATGC TGGTGA-3′。
1.2.4 转基因拟南芥的光合酶活性测定
取开花期不同时间水分胁迫处理的参试材料叶片提取总蛋白,蛋白提取参照Ku等[8]的方法。用BCA蛋白定量试剂盒进行蛋白定量,样品稀释到2 mg·mL-1。PEPC、PPDK和NADP-ME酶活性测定参照Sayre等的方法[18]稍作修改,将测定单位改为每毫克蛋白中PEPC、PPDK和NADP-ME的酶活性。
1.2.5 转基因拟南芥的光合速率和水分利用效率测定
在拟南芥开花期,于日间9:00-14:00之间,利用便携式光合仪(CIRAS-3,UK)测定转基因株系和野生型拟南芥不同水分胁迫处理时间下莲座叶的净光合速率(Pn)和水分利用效率(WUE),测定时系统光强设置为800 μmol·m-2·s-1,叶室温度设置为30 ℃,每个株系测定4个单株,按植株序号往返重复测定3次,测定对象为无病、受光均匀且长势相当的植株莲座叶。
1.2.6 数据分析
用Excel 2003对数据进行平均值和标准差分析,用SPSS 20.0软件对试验数据进行方差分析。
2 结果与分析
2.1 供试材料的PCR验证结果
对供试的各转基因株系进行PCR扩增。由图1可知,含ZmPEPC、ZmNADP-ME、ZmPPDK基因的转基因株系均扩增出预期的目标片段(3 kb、2.2 kb、3 kb),非转基因植株中未扩增出目标片段,表明拟南芥转基因株系中存在目标基因。
2.2 非水分胁迫条件下不同转基因拟南芥的比较
2.2.1 目标基因表达量的比较
由图2可知,野生型均无扩增产物。ZmPEPC、ZmNADP-ME、ZmPPDK在转基因拟南芥叶片中均可正常转录,但不同株系间目标基因的相对表达量存在显著差异。例如:PC65、PC73、PCK7株系中PEPC基因的表达量分别为PCK110株系的5.35、14.22和7.07倍;ME4、ME9、PKM2、PKM4、PKM5株系中NADP-ME基因的表达量分别为ME5株系的25.88、3.53、16.36、5.67、2.60倍;PK16、PK26、PK36、PCK5、PCK110、PKM2、PKM4、PKM5株系中PPDK基因的表达量分别为PCK7株系的27.87、20.90、13.55、7.76、4.21、17.64、8.57、4.59倍。

A:ZmPEPC;M:1 kb DNA ladder;1:p3301-PEPC;2.Negative control;3-5:PC65,PC73,PC90; 6-8:PCK5,PCK7,PCK110.
B:ZmNADP-ME;M:1 kb DNA ladder;1:p3301-NADP-ME;2.Negative control;3-5:ME4,ME5,ME9; 6-8:PKM2,PKM4,PKM5.
C:ZmPPDK;M:1 kb DNA ladder;1:p3301-PPDK;2:Negative control;3-5:PK16,PK26,PK36; 6-8:PCK5,PCK7,PCK110; 9-11:PKM2,PKM4,PKM5.
图1 转基因植株的PCR检测结果
Fig.1 PCR assay of transgenic plants
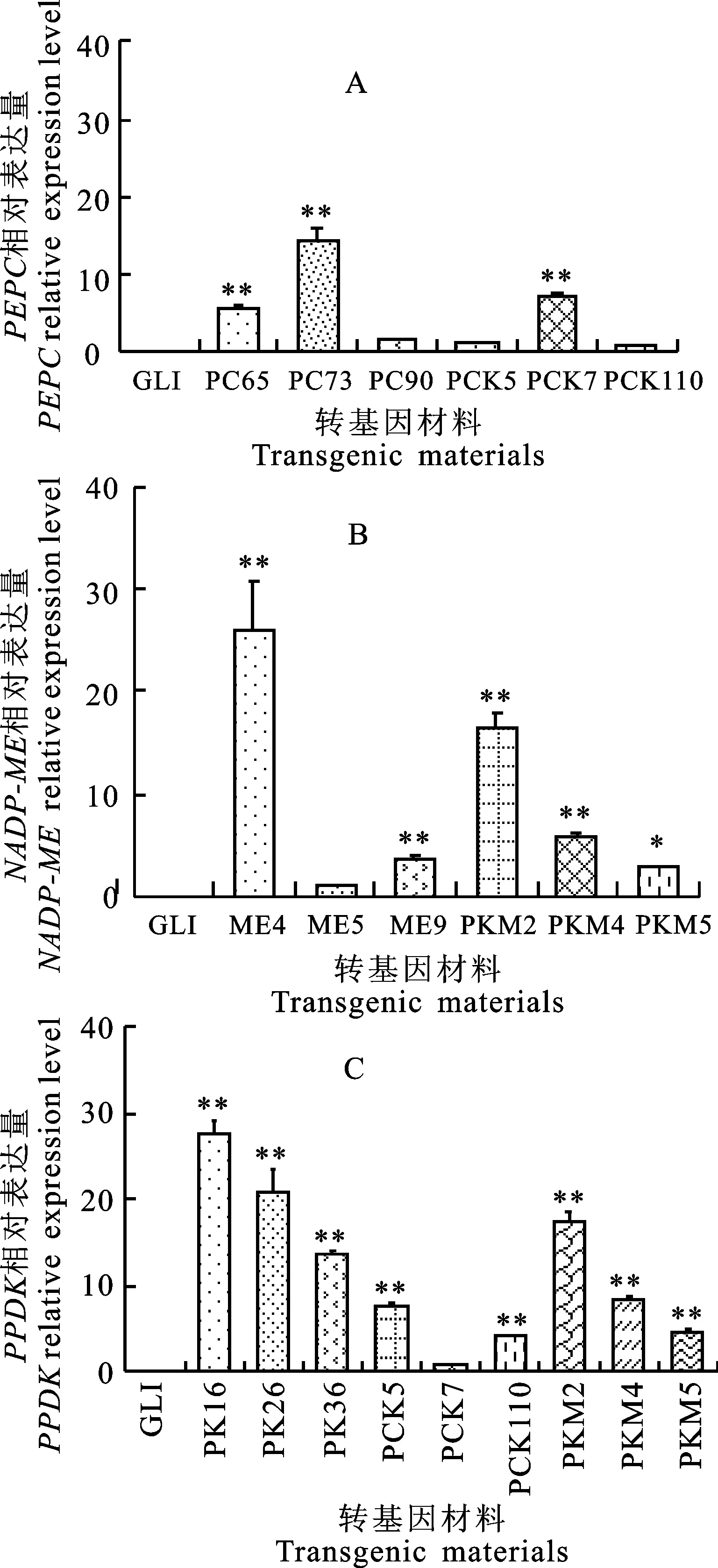
*:P<0.05;**:P<0.01.
2.2.2 C4光合酶活性的比较
开花期转基因拟南芥PC、ME、PK类型株系叶片中相应的PEPC、NADP-ME、PPDK酶的活性较野生型分别提高36%、67%和40%;PCK类型株系叶片中相应的PEPC和PPDK酶的活性较野生型分别提高52%和20%;PKM类型株系叶片中相应的PPDK和NADP-ME酶的活性较野生型分别提高19%和97%,增幅均达到显著水平(表1)。表明ZmPEPC、ZmNADP-ME、ZmPPDK基因的导入可显著提高拟南芥植株相应的PEPC、NADP-ME和PPDK酶的活性。
2.2.3 净光合速率的比较
开花期转基因拟南芥PC、PK、PCK和PKM类型株系叶片的Pn较野生型分别提高19%、21%、24%和17%,增幅达到显著水平(表1)。表明ZmPEPC、ZmPPDK基因的导入能显著提高拟南芥的净光合速率。其中PCK类型株系的Pn高于PC类型株系,而PC类型株系的Pn高于本试验其他基因的转基因材料。
2.2.4 水分利用效率的比较
花期转基因拟南芥PC、ME、PK、PCK和PKM类型株系的WUE较野生型分别提高39%、31%、39%、55%和33%,增幅达到显著水平(表1)。表明ZmPEPC、ZmPPDK基因的导入能显著提高拟南芥的水分利用效率,其中PCK类型株系的WUE高于PC类型株系,而PC类型株系的WUE高于其他基因的转基因株系。

表1 非水分胁迫处理条件下转基因拟南芥几种生理指标的测定结果Table 1 Physiological traits of transgenic plants under non-water stress conditions
表中数值为转同一基因的三个株系的平均值±标准差。*:P<0.05;**:P<0.01。
The date presented here are the means of three replicates(±SD).*:P<0.05;**:P<0.01.
2.3 不同转基因拟南芥对干旱胁迫的响应
2.3.1 干旱胁迫处理第5天时转基因拟南芥对干旱胁迫的响应
与胁迫前相比,干旱胁迫处理第5天时,转基因株系上述指标测定值均有所上升(图3、表2和表3),不同基因型转基因拟南芥株系的上述指标测定值的总体趋势与胁迫前基本一致,且均高于胁迫后的野生型。其中PCK类型株系的PEPC和PPDK基因的表达量较胁迫前分别增加1.50、2.81倍,PEPC酶活性、PPDK酶活性、净光合速率以及水分利用效率较野生型分别提高75%、45%、41%和74%,综合表现最优。PC类型株系的上述测定指标的表现次于PCK类型株系,但优于其他转基因类型株系。
2.3.2 干旱胁迫处理第10天时转基因拟南芥对干旱胁迫的响应
与胁迫前相比,干旱胁迫处理第10天时,转基因株系的上述指标测定值均下降(图3、表2和表3),不同类型转基因拟南芥株系各指标测定值大小的总体趋势与胁迫前基本一致,且均高于胁迫后的野生型,表明转基因材料较野生型更耐干旱胁迫。其中PCK类型株系的PEPC和PPDK基因表达量下降幅度较小,PEPC酶活性、PPDK酶活性、净光合速率以及水分利用效率较野生型分别高48%、46%、149%和70%,综合表现最优,其次是PC类型株系。胁迫处理10 d时,拟南芥已受到严重伤害,体内正常代谢活动受到影响,因此植株光合速率下降。
2.3.3 干旱胁迫复水后第5天转基因拟南芥对干旱胁迫的响应
干旱胁迫处理10 d后再复水第5天时,转基因材料上述测定指标逐渐接近胁迫前的表现(图3、表2和表3),不同类型转基因拟南芥上述指标测定值大小的总体趋势与胁迫前基本一致,均高于复水后的野生型,表明转基因材料遭受胁迫后恢复较快,其中PCK和PC类型株系综合表现较优。

NC:Normal condition;DAD:days after drough;DAR:days after re-watering.*:P<0.05;**:P<0.01.
图3 干旱胁迫处理条件下转基因拟南芥的基因表达量
Fig.3 Relative expression level of transgene qPT-PCR in transgenic plants under drought stress conditions
3 讨 论
迟 伟等[19]研究发现,转PEPC基因水稻的净光合速率提高55%,转PEPC+PPDK基因水稻的净光合速率高于转PEPC基因水稻,而转PPDK和NADP-ME基因水稻的净光合速率无明显变化。李 霞等[20]研究认为在C3水稻中要加强C4循环,PEPC是限速酶。本研究结果表明,在同一水分处理条件下,所有转玉米C4光合酶基因拟南芥株系的净光合速率均高于野生型,并以PC和PCK类型株系最好,表明将玉米C4光合酶基因导入C3植物拟南芥中可以提高其光合性能和耐旱性,尤其是ZmPEPC基因的作用十分显著。
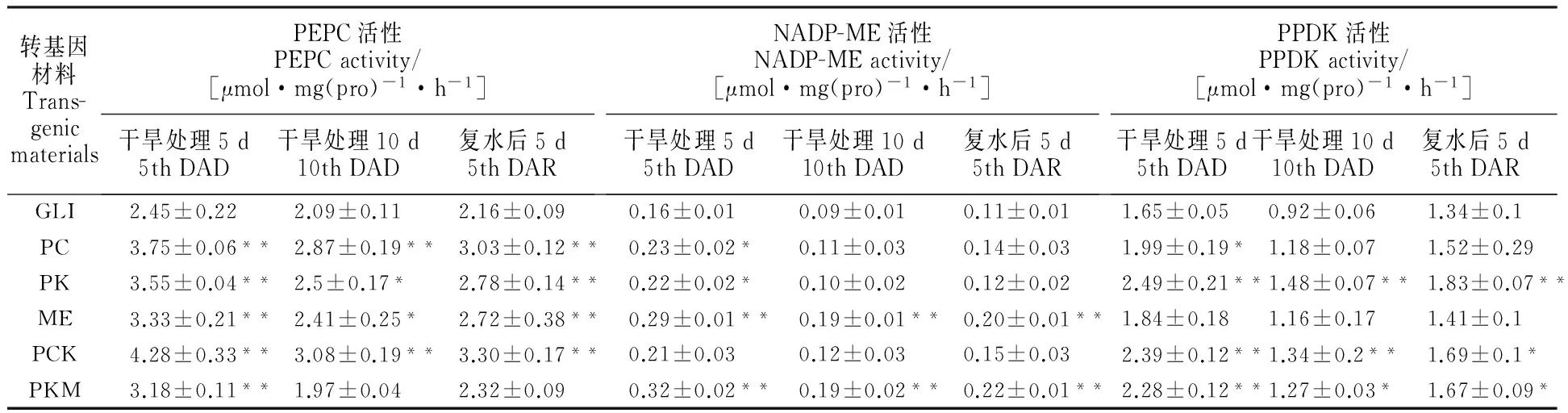
表2 干旱胁迫处理条件下转基因拟南芥的光合酶活性Table 2 Enzyme activity of transgenic plants under drought stress conditions
表中数值为转同一基因型三个株系的平均值±标准差。*:P<0.05;**:P<0.01。表3同。
The date presented here are the means of three replicates(±SD).*:P<0.05;**:P<0.01.DAD:days after drought;DAR:days after re-watering.The same in table 3.
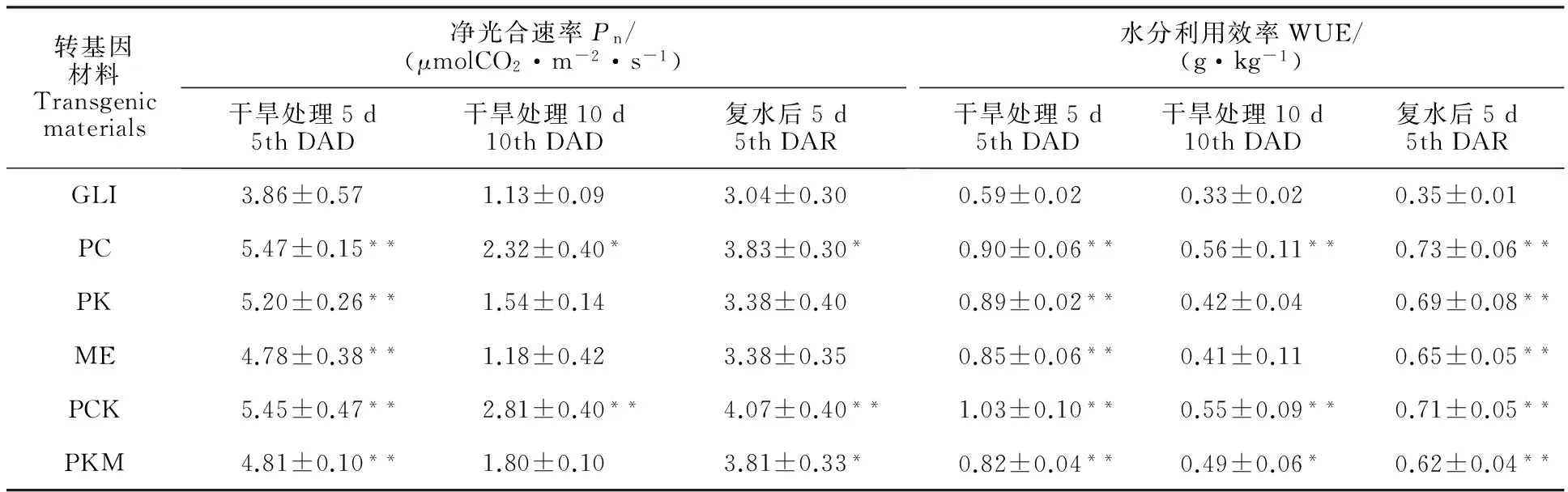
表3 干旱胁迫处理下转基因拟南芥的净光合速率和水分利用效率Table 3 Pn and WUE of transgenic plants under drought stress conditions
PC和PCK类型株系光合速率提高可能有以下主要原因:(1)ZmPEPC基因过表达可增加叶片中苹果酸的浓度,促进叶片气孔开放[21],而植物光合速率与气孔导度呈正相关[15,22],因此转基因拟南芥能保持较高的光合效率。(2)在本研究中,PC和PCK类型株系的PEPC酶活性显著提高,而植株的光合速率与PEPC酶活性呈正相关[23]。此外转基因拟南芥的其他C4光合酶也可被诱导表达[24],这是生化反应链中前馈激活和后馈激活作用的表现,促进了拟南芥的C4循环[25],从而光合速率增加。(3)魏爱丽等[26]认为,在干旱条件下C4途径酶活性可被诱导表达是C3植物对干旱环境的一种生态适应机制。在本试验中,PC和PCK类型株系在严重干旱胁迫下的光合优势可能与PEPC基因参与拟南芥对干旱胁迫反应的调节有关[27]。目前多数研究结果表明,C4-PEPC基因对C3植物光合作用的改善较C4-PPDK和C4-NADP-ME明显[16,24]。PEPC酶在整个C4循环中起着至关重要的作用。
本研究还发现PCK类型株系的净光合速率高于PC类型株系的,这可能是由于ZmPEPC和ZmPPDK基因过表达后植株体内PEPC和PPDK的酶活性均显著增加,对拟南芥体内的C4循环促进效果更明显,因此光合速率提高幅度较大。此外,PK类型株系的光合速率高于PKM类型株系的,可能是由于ZmNADP-ME基因过表达后NADP-ME酶活性升高导致叶片中苹果酸含量下降,保卫细胞渗透压下降,最终导致气孔关闭[28-29],进而影响PKM类型株系的光合速率。
目前大量研究表明,干旱胁迫较轻时,植物光合速率降低是由于气孔关闭所致;而在重度干旱胁迫时,则是非气孔限制因素在起作用[30],如干旱胁迫影响到叶肉细胞内的有关代谢[31,32]。在本研究中,干旱胁迫处理5 d时,由于ZmPEPC基因的导入促进了植株气孔开放,而且短期干旱胁迫处理后,植物会启动胁迫应激机制来抵御外来影响[33],转基因拟南芥的光合速率上升。继续干旱胁迫处理,则拟南芥株系的正常生长和代谢受到影响,因此转基因拟南芥的光合速率下降。
综合本研究结果,不同类型转基因材料的上述测定指标总体表现为PCK>PC>PK、PKM>ME。PC和PCK类型株系在非水分胁迫和水分胁迫条件下均表现较优,在进行小麦等C3作物转基因高光效育种时可着重考虑这两种基因型的利用。
[1] HATCH M D.C4photosynthesis:a unique elend of modified biochemistry,anatomy and ultrastructure[J].BiochimicaetBiophysicaActa(BBA) -ReviewsonBioenergetics,1987,895(2):81.
[2] SUZUKI S,MURAI N,BURNELL J N,etal.Changes in photosynthetic carbon flow in transgenic rice plants that express C4-type phosphoenolpyruvate carboxykinase from Urochloapanicoides [J].PlantPhysiology,2000,124(1):163.
[3] 张庆琛,许为钢,胡琳,等.玉米C4型全长PEPC基因导入普通小麦的研究[J].麦类作物学报,2010,30(2):194.
ZHANG Q C,XU W G,HU L,etal.Development of transgenic wheat plants with maize C4-specificPEPCgene by particle bombardment[J].JournalofTriticeaeCrops,2010,30(2):194.
[4] OLGA I.KERSHANSKAYA·J A T D S J.Photosynthetic basis for wheat crop improvement:genetic modification of photosynthesis [J].TheAsianandAustralasianJournalofPlantScienceandBiotechnology,2010,4:27.
[5] HU L,LI Y,XU W G,etal.Improvement of the photosynthetic characteristics of transgenic wheat plants by transformation with the maize C4phosphoenolpyruvate carboxylase gene [J].PlantBreeding,2012,131(3):385.
[6] 杜西河,许为钢,胡 琳,等.转ZmPEPC与ZmPPDK基因拟南芥对干旱胁迫的反应[J].分子植物育种,2013,11(4):477.
DU X H,XU W G,HU L,etal.Response of maize C4-type PEPC and PPDK transgenicArabidopsisplants to drought stress [J].MolecularPlantBreeding,2013,11(4):477.
[7] ISHIMARU K,ICHIKAWA H,MATSUOKA M,etal.Analysis of a C4maize pyruvate,orthophosphate dikinase expressed in C3transgenicArabidopsisplants [J].PlantScience,1997,129(1):57.
[8] KU M S,AGARIE S,NOMURA M,etal.High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plant [J].NatureBiotechnology,1999,17(1):76.
[9] WANG Y M,XU W G,HU L,etal.Expression of maize gene encoding C4-pyruvate orthophosphate dikinase(PPDK) and C4-phosphoenolpyruvate carboxylase(PEPC) in transgenicArabidopsis[J].PlantMolecularBiologyReporter,2012,30(6):1367.
[10] FUKAYAMA H,MIYAO M.Significant accumulation of C4-specific pyruvate,orthophosphate dikinase in a C3plant,rice [J].PlantPhysiology,1977,127(3):1136.
[11] NA Q,XU W,LIN H,etal.Drought tolerance and proteomics studies of transgenic wheat containing the maize C4phosphoenolpyruvate carboxylase (PEPC) gene [J].Protoplasma,2015:1.
[12] 方立锋,丁在松,赵明.转ppc基因水稻苗期抗旱特性研究[J].作物学报,2008,34(7):1220.
FANG L F,DING Z S,ZHAO M.Characteristics of drought tolerance inppcoverexpressed rice seedings [J].ActcAgronomicaSinica,2008,34(7):1220.
[13] GU J F,QIU M,YANG J C.Enhanced tolerance to drought in transgenic rice plants overexpressing C4photosynthesis enzymes [J].ActcAgronomicaSinica,2013,1(2):105.
[14] WANG J,LI R.Integration of C4-specificppdkgene of chinochloa to C3upland rice and its photosynthesis characteristics analysis [J].AfricanJournalofBiotechnology,2008,7(6):783.
[15] KU M S B,RANADE U,HSU T P,etal.Photosynthetic performance of transgenic rice plants overexpressing maize C4photosynthesis enzymes [J].StudiesinPlantScience,2000,7(00):193.
[16] 黄雪清,焦德茂,迟伟,等.转C4光合酶基因水稻的CO2交换和荧光特性[J].植物学报,2002,44(4):405.
HUANG X Q,JIAO D M,CHI W,etal.Characteristics of CO2exchange and chlorophyll fluorescence of transgenic rice with C4genes[J].ActaBotanicaSinica,2002,44(4):405.
[17] 王永霞,杜新华,许为钢,等.导入外源玉米C4型NADP-ME基因对小麦光合效能的影响[J].作物学报,2016,42(4):600.
WANG Y X,DU X H,XU W G,etal.Photosynthetic charateristics of transgenic wheat expressing maize C4-typeNADP-MEgene [J].ActcAgronomicaSinica,2016,42(4):600.
[18] SAYRE R T,KENNEDY R A.Photosynthetic enzyme activities and Localization in Mollugo verticillata populations differing in the levels of C3and C4cycle operation [J].PlantPhysiology,1979,64(2):293.
[19] 迟 伟,焦德茂,黄雪清,等.转PEPC基因水稻的光合生理特性[J].植物学报,2001,43(6):657.
CHI W,JIAO D M,HUANG X Q,etal.Photosynthetic characteristics of transgenic rice plants overexpressing maize phosphoenopyruvatecarboxylase[J].ChineseBulletinofBotany,2001,43(6):657.
[20] 李 霞,焦德茂.转C4光合基因水稻及其在育种中的应用[J].分子植物育种,2005,3(4):550.
LI X,JIAO D M.Transgenic rice overexpressing C4photosynthetic genes and their application in breeding [J].MolecularPlantBreeding,2005,3(4):550.
[21] DING Z S,HUANG S H,ZHOU B Y,etal.Overexpression of phosphoenolpyruvate carboxylase cDNA from C4millet(Seteriaitalica) increase rice photosynthesis and yield under upland condition but not in wetland fields [J].PlantBiotechnologyReports,2013,7(7):155.
[22] 焦德茂,匡廷云,李 霞,等.转PEPC基因水稻具有初级CO2浓缩机制的生理特点[J].中国科学,2003,33(1):33.
JIAO D M,KUANG T Y,LI X,etal.Physiological characteristics of the primitive CO2concentrating mechanism inPEPCtransgenic rice[J].ScienceinChina,2003,46(4):438.
[23] 李 霞,焦德茂,戴传超,等.转育PEPC基因的杂交水稻的光合生理特性[J].作物学报,2001,27(2):137.
LI X,JIAO D M,DAI C C,etal.Photosynthetic characteristics for rice hybrids with transgenicPEPCparent HPTER-01 [J].ActcAgronomicaSinica,2001,27(2):137.
[24] 焦德茂,李 霞,黄雪清,等.转PEPC基因水稻的光合CO2同化和叶绿素荧光特性[J].科学通报,2001,46(5):414.
JIAO D M,LI X,HUANG X Q,etal.The characteristics of CO2assimilation of photosynthesis and chlorophyll fluorescence in transgenicPEPCrice [J].ChineseScienceBulletin,2001,46(13):1080.
[25] 季本华,朱素琴,焦德茂.转玉米C4光合酶基因水稻株系中的光合C4微循环[J].作物学报,2004(6):536.
JI B H,ZHU S Q,JIAO D M.Photosynthetic C4-microcycle in transgenic rice plant lines expressing the maize C4-photosynthetic enzymes[J].ActcAgronomicaSinica,2004(6):536.
[26] 魏爱丽,王志敏,翟志席,等.土壤干旱对小麦旗叶和穗器官C4光合酶活性的影响[J].中国农业科学,2003,36(5):508.
WEI A L,WANG Z M,ZHAI Z X.etal.Effect of soil drought on C4photosynthesis enzyme activities of flag leaf and ear in wheat[J].ScientiaAgriculturaSinica,2003,36(5):508.
[27] 周宝元,丁在松,赵 明.PEPC过表达可以减轻干旱胁迫对水稻光合的抑制作用[J].作物学报,2011,37(1):112.
ZHOU B Y,DING Z S,ZHAO M.Alleviation of drought stress inhibition on photosynthesis by overexpression ofPEPCgene in rice[J].ActcAgronomicaSinica,2011,37(1):112.
[28] LAPORTE M M,SHEN B,TARCZYNSKI M C.Engineering for drought avoidance:expression of maize NADP-malic enzyme in tobacco results in altered stomatal function[J].JournalofExperimentalBotany,2002,53(369):699.
[29] OUTLAW W H,MANCHESTER J,BROWN P H.High levels of malic enzyme activities inViciafabaL. epidermal tissue [J].PlantPhysiology,1981,68(5):1047.
[30] 张红萍,牛俊义,轩春香,等.干旱胁迫及复水对豌豆叶片脯氨酸和丙二醛含量的影响[J].甘肃农业大学学报,2008,43(5):50.
ZHANG H P,NIU J Y,XUAN C X,etal.Effect of drought stress and re-watering on content of proline and malondiadehyde in pea leaves [J].JournalofGansuAgriculturalUniversity,2008,43(5):50.
[31] LAWLOR D W.Limitation to photosynthesis in water-stressed leaves:stomata vs metabolism and the role of ATP [J].AnnalsofBotany,2002,89(7):871.
[32] CORNIC G,FRESNEAU C.Photosynthetic carbon reduction and carbon oxidation cycles are the main electron sinks for photosystem II activity during a mild drought [J].AnnalsofBotany,2002,89(6):887.
[33] 季艳林,赖惠玲,郑茹萍,等.植物涝渍胁迫应激机制研究进展[J].生物技术进展,2016,6(1):1.
JI Y L,LAI H L,ZHENG R P,etal.Progress on plant resistance mechanism to waterlogging stress [J].CurrentBiotechnology,2016,6(1):1.
Effect of Maize C4-specific Photosynthesis Genes on Photosynthesis and Drought Resistance ofArabidopsisthaliana
LEI Mingyue1,2,XU Weigang2,LI Xiaobo2,Zhang Qingchen1,2,WANG Huiwei2,ZHANG Lei2,FANG Yuhui1,2,LI Yan2,LI Chunxin2
(1.College of Agronomy, Hennan Agricultural University,Zhengzhou,Henan 450002,China; 2.Wheat Research Insitute,Henan Academy of Agricultural Sciences/National Laboratory of Wheat Engineering/Key Laboratory of Wheat Biology and Genetic Breeding in central Huang Huai Hai Region,Ministry of Agriculture,Zhengzhou,Henan 450002,China)
The three key C4-specific photosynthesis genes of maize,ZmPEPC,ZmPPDKandZmNADP-ME,hold great promise for increasing photosynthetic rate of C3type plants. To investigate the effects of overexpression of those C4-specific photosynthesis genes on photosynthetic rate and drought tolerance of C3plants,we obtainedArabidopsisthalianaplants overexpressingZmPEPC(phosphoenopyruvate carboxylase),ZmPPDK(pyruratedikinase),ZmNADP-ME(NADP-malic enzyme),ZmPEPC+ZmPPDK,andZmPPDK+ZmNADP-ME,respectively,using agrobacterium mediated transformation. Wild type and transgenicArabidopsisplants were firstly grown under well-water conditions and then under drought stress at flowering stage by stopping watering. Samples were collected at 1 d before water stress,5 d and 10 d after water stress,and 5 d after rewatering to analyze the relative expressions of transgenes,the enzymic activities of PEPC,NADP-ME and PPDK,net Photosynthetic rate(Pn) and water use efficiency(WUE). The results showed that the activities of PEPC and PPDK,Pnand WUE of theZmPEPC+ZmPPDKtransgenic plants were 52%,20%,24% and 55% higher than those of wild-type under normal water condition,respectively. TheZmPEPC+ZmPPDKtransgenic plants had the largest increase in these parameters,except PPDK activity,compared to the plants with other transgenes. Based on the above measured parameters,the performances of the different transgenes can be ranked asZmPEPC+ZmPPDK>ZmPEPC>ZmPPDK,ZmPPDK+ZmNADP-ME>ZmNADP-ME. All the measured parameters in the transgenicArabidopsisleaves increased compared with their non-stressed controls at 5 d of drought stress,and decreased at 10 d of drought stress due to severe damage by drought,but were recovered in various degrees at 5 d after watering restored. Overall,ZmPEPC+ZmPPDKtransgenic plants had the highest increase in these measured parameters under different drought stress conditions,andZmPEPCtransgenic plants were as the second. All transgenicArabidopsisplants with different transgenes showed better drought tolerance than the wild type control.
Arabidopsisthaliana; Drought stress; Transgene; C4-specific photosynthesis gene; Maize
时间:2017-01-03
2016-05-29
2016-07-12
国家自然科学基金项目(31371707); 国家转基因生物新品种培育科技重大专项(2016ZX08002003);河南省基础与前沿技术研究计划项目(132300410005);河南省重大科技专项(151100111400);河南省基础研究项目(132300410005,132300410283)
E-mail:leimingyue18@163.com
许为钢(E-mail:xuwg1958@163.com)
S58;S311
A
1009-1041(2017)01-0108-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170103.1629.030.html

