播散性暗色丝孢霉病患者CARD9突变及相关免疫学研究
张瑞珺,王晓雯,万喆,李若瑜
北京大学第一医院皮肤性病科, 北京大学真菌与真菌病研究中心, 皮肤病分子诊断北京市重点实验室,北京 100034
·论著·
播散性暗色丝孢霉病患者CARD9突变及相关免疫学研究
张瑞珺,王晓雯,万喆,李若瑜
北京大学第一医院皮肤性病科, 北京大学真菌与真菌病研究中心, 皮肤病分子诊断北京市重点实验室,北京 100034
暗色丝孢霉病是指由暗色真菌引起的皮肤、皮下组织乃至深部组织脏器的感染。本研究探讨1例由皮肤及皮下组织暗色丝孢霉病逐渐进展为播散性暗色丝孢霉病患者的遗传背景及其抗真菌免疫功能。收集患者10余年病情进展的临床资料及真菌检查结果,进行临床资料及真菌学研究;对外周血DNA采用Sanger测序,进行遗传学研究;提取患者及正常人外周血单个核细胞(peripheral blood mononuclear cell,PBMC),采用蛋白免疫印迹法、流式细胞术、化学发光法、酶联免疫吸附试验等进行免疫学研究。结果显示,患者胱天蛋白酶募集域蛋白9(caspase recruitment domain-containing protein 9,CARD9)基因存在新的复合杂合错义突变(p.R35Q和p.E81K),CARD9蛋白表达正常,外周血淋巴细胞(peripheral blood lymphocyte,PBL)Th1和Th17细胞比例均降低;PBMC抗疣状瓶霉感染存在天然及适应性免疫缺陷。本研究首次报道1例播散性暗色丝孢霉病患者存在CARD9基因新发错义突变,同时发现患者PBMC抗真菌的天然及适应性免疫存在缺陷,提示CARD9蛋白在暗色丝孢霉病发病中可能发挥重要作用。
播散性暗色丝孢霉病;CARD9;疣状瓶霉;外周血单个核细胞;免疫缺陷
暗色真菌是条件性致病真菌,广泛存在于浴室、腐木、土壤等潮湿和营养匮乏的环境中。其细胞壁含有黑色素,可侵犯免疫正常及免疫缺陷宿主,引起着色芽生菌病、暗色丝孢霉病、足菌肿等多种皮下或播散性感染[1-2]。在我国,有代表性的高致病性暗色真菌主要包括疣状瓶霉(Phialophoraverrucosa,P.verrucosa)、棘状外瓶霉、裴氏着色霉等。
暗色丝孢霉病是指由一组暗色真菌所致的皮肤、皮下等浅表组织乃至深部脏器的感染。临床表现多种多样,可由原发感染灶播及鼻腔、咽部、鼻旁窦(副鼻窦)、肺部、骨骼、中枢神经系统等好发部位,其中危害最重的中枢神经系统暗色丝孢霉病常可危及患者生命。对于顽固性感染,手术切除及多种抗真菌药物治疗往往收效甚微,且无法治愈,因此急需寻求快速、有效的治疗方法。
随着对真菌感染易感性遗传与免疫机制的认识逐渐深入,关于皮肤黏膜真菌病和侵袭性真菌感染的免疫缺陷病的研究取得了突破性进展。例如,以慢性皮肤黏膜念珠菌病为代表的难治性慢性真菌感染已确定与胱天蛋白酶募集域蛋白 9(caspase recruitment domain-containing protein 9,CARD9)、信号转导及转录激活因子 1(signal transducer and activator of transcription 1,STAT1)、STAT3等重要分子的基因突变相关[3]。本课题组还发现CARD9 缺陷亦可导致以疣状瓶霉为代表的暗色真菌易感性增加[4]。CARD9 是细胞C型凝集素受体 (C-type lectin receptor,CLR)下游的关键连接蛋白,被形象地称为是“连接天然免疫与适应性免疫的重要分子”[5], CARD9依赖的信号途径在抗真菌感染免疫中起重要作用。
本研究报道1例由疣状瓶霉引起的皮肤及皮下组织暗色丝孢霉病逐渐进展为播散性暗色丝孢霉病的患者及其近10余年病程迁延进展。遗传学研究发现该患者存在CARD9基因新发错义突变;免疫学研究证实CARD9突变的外周血单个核细胞 (peripheral blood mononuclear cell,PBMC)抗真菌的天然及适应性免疫存在缺陷,导致病原性真菌无法清除,病程迁延进展。
1 材料与方法
1.1 材料
1.1.1 细胞 抽取存在CARD9错义突变的暗色丝孢霉病患者及健康对照者外周血,通过密度梯度离心法提取PBMC。1.1.2 菌株 将疣状瓶霉临床分离株(BMU07163)接种于燕麦琼脂(oatmeal agar,OA)培养基,28 ℃孵箱培养14 d。用生理盐水冲洗真菌斜面,孢子过滤器过滤菌悬液,除去菌丝和培养基成分,制成孢子密度为1×109CFU/mL的菌悬液备用。热灭活疣状瓶霉肿胀孢子(heat-killedPhialophoraverrucosaswollen conidia,HK-P.verrucosaswollen conidia)制备:将孢子按1×107CFU/mL接种于RPMI 1640液体培养基中,在30 ℃摇床上200 r/min持续摇16 h,此时>95%的孢子发生肿胀,收集肿胀孢子;将肿胀孢子悬液煮沸30 min灭活,调整孢子悬液密度为5×108CFU/mL。
1.1.3 主要试剂 燕麦琼脂购自美国BD Biosciences公司,胎牛血清购自澳洲Hyclone公司,RelaxGene血液基因组DNA提取系统购自Tiangen公司。CARD9引物合成、测序由天一辉远生物科技有限公司完成。兔抗人 CARD9 单克隆抗体(简称单抗)购自英国Abcam公司,兔抗人 GAPDH单抗购自美国Cell Signaling Technology公司,酵母聚糖(zymosan)、鲁米诺(luminol)购自美国Sigma公司,抗人CD3抗体、抗人CD28抗体、异硫氰酸荧光素(fluorescein isothiocyanate,FITC) 抗人CD4、PE抗人γ干扰素(interferon γ,IFN-γ)、PerCP-Cy5.5抗人白细胞介素4(interleukin 4,IL-4)、APC抗人IL-17A及同型对照抗体购自美国BD Biosciences公司,人肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-1β、IL-6、 IFN-γ、IL-17A、IL-22、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国R&D Systems公司。
1.2 方法
1.2.1 病原学研究 参考该患者以前的病理、真菌镜检、培养和测序结果[6],对患者皮损部位多次重复取材进行真菌直接镜检和培养,并进行药敏试验。
1.2.2 分子遗传学研究 本课题组曾发现4例疣状瓶霉感染的暗色丝孢霉病患者皆为CARD9缺陷[4]。因此,当发现本研究中患者无人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、肿瘤、免疫抑制剂使用等诱因时,考虑对其CARD9基因进行检测。抽取患者及其父母的外周血3 mL并提取DNA(按试剂盒说明书操作),进行CARD9基因外显子扩增,即Sanger测序。
1.2.3 蛋白提取和蛋白免疫印迹检测 抽取患者及3名健康对照者的外周血,通过密度梯度离心法提取PBMC,采用 RIPA液(添加1% protease inhibitor cocktail)提取蛋白质,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),其中分离胶10%,浓缩胶5%,恒压120 V,电泳至分离胶底部。恒流200 mA,2 h,转移至硝酸纤维素(nitrocellulose,NC)膜上, 用5%脱脂奶粉室温封闭1 h,加兔抗人CARD9单抗,4 ℃摇床过夜,用含吐温20的磷酸盐缓冲液(phosphate buffered saline with Tween 20,PBST)洗3次,每次5 min。再加入山羊抗兔辣根过氧化物酶(horseradish peroxidase,HRP)标记 IgG,室温摇床1 h,PBST洗3次,每次5 min。增强化学发光法(enhanced chemiluminescence,ECL)试剂显色、曝光,并进行扫描、拍照。
1.2.4 ECL检测PBMC中活性氧(reactive oxygen species,ROS)生成 分别提取患者及6名健康对照者的PBMC,重悬于含10%自体血清的Hank平衡盐溶液 (Hank’s balanced salt solution,HBSS)中,细胞悬液密度为2×106/mL,转至96孔板,每孔100 μL。加入50 μL Zymosan(100 μg/mL)或活的疣状瓶霉孢子悬液(细胞∶孢子=1∶4),立即加入40 μL Luminol(88.5 μg/mL),振荡后利用Automated LB96V MicroLumat Plus Luminometer(EG&G Berthold,Germany)于37 ℃连续监测60 min。
1.2.5 流式细胞术检测外周血淋巴细胞(peripheral blood lymphocyte,PBL)中T细胞分化 分别提取患者及8名健康对照者的PBMC,培养于含10%胎牛血清的RPMI 1640 培养基中,密度为 1×106/mL。在细胞培养基中加入抗人CD3(1 μg/mL)和抗人CD28 (2 μg/mL)抗体,3 d后更换新鲜培养基,同时补充抗人CD3抗体继续培养。第4天收取活化的细胞,加入提前配制的刺激培养基重悬PBMC,即每毫升完全培养基中加入PMA(100 ng/mL)、离子霉素(500 ng/mL)及Golgistop(含莫能霉素0.7 μL/mL)。调节细胞悬液密度至2×106/mL,加至24孔板,每孔500 μL,继续于细胞培养箱中孵育5 h。
T细胞的胞内染色:培养结束后取出细胞,1 200 r/min离心5 min,弃上清液;Stain buffer 洗1次,离心,弃上清液,加入一定浓度的 FITC抗人CD4或其同型对照抗体,4 ℃避光孵育30 min;Stain buffer 洗1次,离心,弃上清液;每管加入250 μL Fixation/Permeabilization solution,混匀,4 ℃避光孵育20 min;加入2 mL Perm/WashTMbuffer,室温避光孵育10 min,1 200 r/min离心5 min,弃上清液;分别加入PE抗人IFN-γ、PerCP-Cy5.5抗人IL-4、APC抗人IL-17A及所有同型对照抗体,4 ℃避光孵育30 min;加入2 mL Perm/WashTMbuffer洗涤,1 200 r/min离心5 min,弃上清液,400 μL Stain buffer重悬,用BD FACSCalibur流式细胞仪CellQuest Pro软件获取数据,FlowJo 7.6软件分析数据。
1.2.6 ELISA 抽取患者及6名健康对照者的外周血并提取PBMC,转至96孔板。将疣状瓶霉刺激物与PBMC于37 ℃孵育(细胞∶孢子=1∶4),分别于24 h和6 d时收集细胞培养上清液,按ELISA说明书操作,检测天然免疫相关细胞因子TNF-α、IL-1β、IL-6,适应性免疫相关细胞因子IL-17A、IL-22、IFN-γ及GM-CSF的分泌水平。
1.3 统计分析
采用GraphPad Prism 6作图,SPSS 22.0统计软件处理数据,数据以mean±SD表示。采用单因素方差分析及t检验比较两组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
该34岁汉族青年女性患者感染疣状瓶霉18年,由皮肤及皮下组织暗色丝孢霉病逐渐加重发展为播散性暗色丝孢霉病。患者于1998年6月发现左耳后出现一个直径约1.5 cm的无痛红色结节,1998年11月经北京大学第一医院皮肤性病科会诊,真菌培养出疣状瓶霉,考虑为皮肤及皮下组织暗色丝孢霉病[6],曾予伊曲康唑 400 mg/d联合特比萘芬250 mg/d治疗,结合局部热疗。患者皮疹时有加重,逐渐进展。2006年患者皮损局限于双侧耳周(图1A),2009年皮损逐渐发展至面部、右耳及背部(图1B),予两性霉素B(总量达500 mg),症状稍改善。2011年皮损范围进一步扩大,面部、背部及上肢明显(图1C),口服药物加量为伊曲康唑 800 mg/d联合特比萘芬 500 mg/d,并辅以胸腺五肽肌内注射,效果不佳。2013年患者症状进一步加重,皮损表面出现破溃、黑色结痂,接受皮下注射IFN治疗,效果欠佳,出院后继续予口服伊曲康唑、特比萘芬治疗。

A: In 2006, the lesions were located in the left ear. B: In 2009, the lesions extended to the face, ear and back. C: In 2011, the infection lesions could be found in the face, back, left upper limb and chest. D: In 2015, septate hyphae were visible in the oral cavity and maxillary secretions of the patient (direct microscopic examination, ×400).
图1 患者皮肤及皮下组织暗色丝孢霉病的临床进展照片及真菌直接镜检结果
Fig.1 Clinical manifestations of the skin and subcutaneous phaeohyphomycosis over the past ten years and direct microscopic examination results of fungi
2016年患者感染播散至全身,进展为播散性暗色丝孢霉病。头面部、背部、四肢等可见大小不等的暗红色至黑色浸润性斑块,以面部为重,表面有破溃、脓液、黑色结痂;口腔内上颚广泛糜烂面;左耳郭缺如,左外耳道皮疹覆盖(图2A)。辅助检查结果如下。头颅磁共振成像(magnetic resonance imaging,MRI):左侧内囊膝、苍白球及尾状核头软化灶;双侧额叶皮层下白质脱髓鞘病灶(图2B、2C)。头颅MRI增强:左侧内囊膝、邻近尾状核头及丘脑异常信号灶、软化灶?真菌感染?双侧额叶皮层下白质脱髓鞘病灶;左耳周围、左颞部、双侧额顶部、鼻部、颌面部皮肤及皮下改变,左侧咬肌受累,左侧颧骨及颞骨受累可能;双侧上颌窦及筛窦、右侧蝶窦炎症(图2D)。脑脊液常规、生化、病原学检查及脑脊液病原学培养阴性,脑脊液G试验83.24 pg/mL,GM试验阴性。耳鼻喉科会诊示:患者面部多发大量黑色坏死性结痂,鼻尖部可见2.5 cm×2.5 cm 黑色干痂,鼻中隔穿孔,硬腭部分骨质坏死,与鼻腔相通,周边多量黑色结痂,黏膜肉芽及溃疡性改变;舌体及会厌舌面、下咽后壁可见多发溃疡面;双声带窥视不清。神经内科会诊考虑颅内病变性质待定,不除外中枢神经系统感染。综上,考虑诊断为“播散性暗色丝孢霉病”。予输注两性霉素B(累积量407.5 mg)和GM-CSF (300×104u/d)皮下注射3周,疗效仍不佳。患者对两性霉素B不良反应不耐受,院外改为伊曲康唑注射液 400 mg/d静脉输注,配合特比萘芬 500 mg/d口服治疗,皮损略有好转,目前仍在随访中。
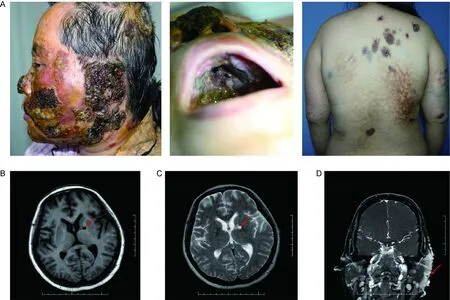
A:Patient’s infection lesions spread to the head, face, nose pharynx ministry, back and limbs. B-D:Brain magnetic resonance imaging of the patient. T1 (B) and T2 (C) axial MR imaging showed encephalomalacia. Coronal T1WI enhancement (D) imaging showed the left masseter muscle involvement, left zygomatic bone and temporal bone involvement; bilateral maxillary sinus and ethmoid sinus, right sphenoid sinus inflammation.
图2 患者播散性暗色丝孢霉病的临床表现及头颅MRI平扫和增强
Fig.2 The clinical manifestations and brain magnetic resonance imaging of the patient with disseminated phaeohyphomycosis
2.2 真菌学研究
患者真菌培养和测序结果鉴定为疣状瓶霉,病理符合暗色丝孢霉病表现[6]。此外,对患者耳后皮肤、耳后淋巴结、背部、口腔上颚、面部等感染部位进行多次真菌镜检,皆为阳性(图1D),真菌培养多次阳性,鉴定为疣状瓶霉。最初分离的菌株药敏试验结果为:氟康唑、伊曲康唑、伏立康唑、两性霉素B、特比萘芬的最小抑菌浓度(minimum inhibitory concentration,MIC)或最低有效浓度(minimum effective concentration,MEC)分别为 64、0.5、0.5、4、0.25 μg/mL,后续分离培养菌株药物敏感性无明显变化[6-7]。
2.3CARD9基因遗传学检测
Sanger测序结果显示,患者CARD9存在两个复合杂合突变(exon2: c.104G>A, p.R35Q和exon3: c.241G>A, p.E81K),分别来自患者的父亲和母亲(图3A)。同时在220种族匹配的对照组中未发现这些突变检测。
2.4 CARD9蛋白表达检测
不同于以前报道过的无义突变或移码突变引起CARD9缺陷,该错义突变患者PBMC中CARD9蛋白表达未见缺乏(图3B)。
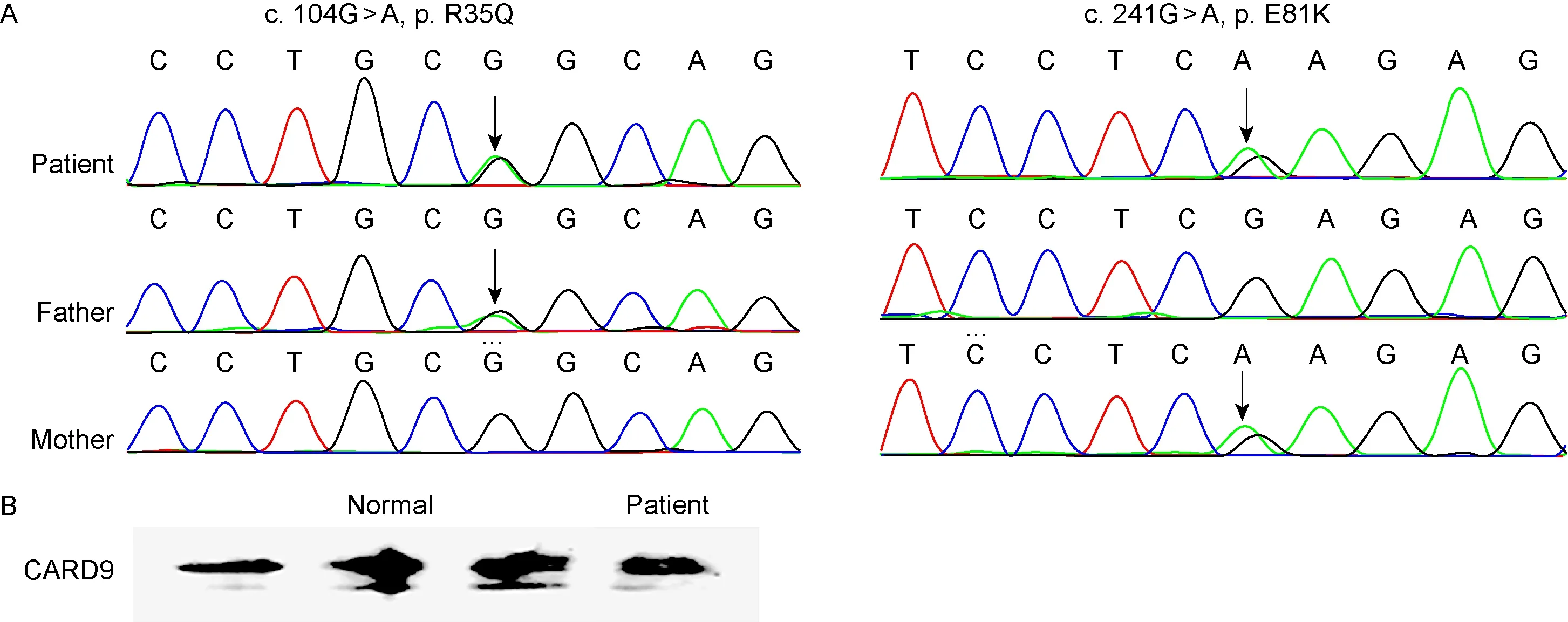
A:CARD9 gene sequencing scheme of the patient and her parents. The arrows point to the mutation sites. B: Immunoblot analysis of CARD9 protein in three healthy donors and the patient.
图3CARD9基因测序图谱及蛋白表达情况
Fig.3 Sequencing and protein expression profiles of CARD9
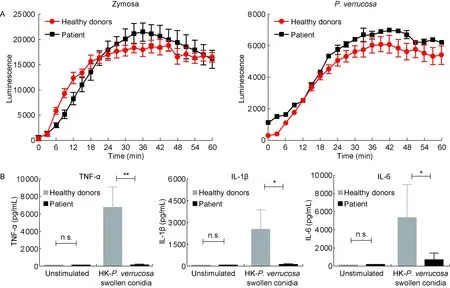
A: ROS production tested by luminol-enhanced chemiluminescence. The patient’s and control PBMCs were stimulated with zymosan (100 μg/mL) or aliveP.verrucosaresting conidia, then luminol was immediately added and chemiluminescence was measured at 37 ℃ for 3 min during 1 h. B: Pro-inflammatory cytokine productions tested by ELISA. The patient’s and control PBMCs were incubated with HK-P.verrucosaswollen conidia for 24 h, then the concentrations of TNF-α, IL-1β and IL-6 in culture supernatants were assessed. The bars represent the mean±SD and are representative of two independent experiments, 6 healthy control subjects tested in parallel.*P<0.05,**P<0.01. n.s., not significant.
图4CARD9突变对患者天然免疫功能的影响
Fig.4 Effect ofCARD9 mutations on innate immune function
2.5 免疫学功能检测
2.5.1 PBMC中抗真菌感染免疫的ROS生成 在酵母来源的Zymosan颗粒或疣状瓶霉活孢子刺激后,患者与健康对照组PBMC中ROS生成均增加,但两组之间差异无统计学意义(P>0.05)(图4A)。
2.5.2 PBL中Th细胞分化比例 鉴于CARD9在抗真菌免疫中的关键作用,本研究评估了患者和8名健康对照者的Th1和Th17细胞比例。结果显示,与健康对照者相比,患者的Th1和Th17细胞比例明显减少,分别为0.88%和0.94%;而有抑制抗真菌作用的Th2细胞比例为9.18%,明显高于健康者(图5A)。
2.5.3 PBMC中抗真菌感染免疫相关细胞因子的分泌水平 宿主抗真菌感染免疫依赖天然免疫和适应性免疫。利用热灭活疣状瓶霉肿胀孢子刺激PBMC 24 h后,发现与健康对照者相比,患者PBMC中对下游适应性免疫有重要影响的天然免疫相关细胞因子TNF-α(P<0.01)、IL-1β(P<0.05)、IL-6(P<0.05)的分泌均表现出明显缺失,几乎与未刺激状态持平(图4B)。而刺激6 d后,细胞因子GM-CSF(图6),Th1细胞效应因子IFN-γ 及Th17细胞效应因子IL-17A、IL-22的表达与健康对照者相比也出现缺失,差异均有统计学意义(P<0.05)(图5B~5D)。

A: PBMCs of 8 healthy donors and the patient were activated by anti-CD3 antibody and anti-CD28 antibody, and the proportions of Th1 cells (CD4+/ IFN-γ+), Th17 cells (CD4+/IL-17A+) and Th2 cells (CD4+/IL-4+) in PBLs were analyzed by using fluorescence-activated cell sorting. B: Adaptive immune-related cytokine productions tested by ELISA. The patient’s and control PBMCs were incubated with HK-P.verrucosaswollen conidia for 6 d, then the concentrations of IL-17A, IL-22 and IFN-γ in culture supernatants were assessed. Results are mean±SD of two independent experiments, 6 healthy control subjects tested in parallel.*P<0.05. n.s., not significant.
图5CARD9突变对患者适应性免疫功能的影响
Fig.5 Effect ofCARD9 mutations on adaptive immune function

After stimulation by HK-P.verrucosaswollen conidia for 6 d, the production of GM-CSF was decreased detected by ELISA. Results are mean±SD of two independent experiments.*P<0.05. n.s., not significant.
图6CARD9突变患者PBMC中GM-CSF分泌缺乏
Fig.6 Impaired response of GM-CSF in PBMCs of the patient withCARD9 mutations
3 讨论
暗色丝孢霉病包括从浅表到深部器官的多种感染,其中皮肤和皮下组织暗色丝孢霉病最为常见。致病菌包括外瓶霉、瓶霉等,临床主要表现为孤立性的皮下脓肿或化脓性肉芽肿。系统性暗色丝孢霉病在国内外均鲜见报道,文献报道包括暗色真菌性鼻窦炎、咽部暗色丝孢霉病、肺部暗色丝孢霉病、中枢神经系统暗色丝孢霉病等,常表现为化脓性、肉芽肿性炎性损伤,可有组织坏死。其中引起中枢神经系统感染的致病菌有斑替枝孢霉、皮炎外瓶霉等。Keyser等[8]报道1例心脏移植后出现播散性斑替枝孢霉感染致死病例,患者皮肤、脑及肺均受累,采取手术切除联合大剂量伊曲康唑治疗无效。我国也有皮炎外瓶霉、甄氏外瓶霉[9]等引起系统性暗色丝孢霉病的报道,其中3例皮炎外瓶霉感染患者合并中枢神经系统感染[10],但无全身皮肤感染播散,病程较短,病情进展迅速,患者很快出现神经系统症状并死亡。本例患者由疣状瓶霉感染引起皮肤及皮下组织暗色丝孢霉病,病程达18年,迁延难治,造成耳郭缺如、毁容等损毁性改变,感染不断加重,呈全身播散征象,并侵犯鼻咽部,出现颅内病灶,进展为播散性暗色丝孢霉病。中枢神经系统暗色丝孢霉病可由鼻旁窦感染直接蔓延或由肺部或皮肤感染灶经过血行播散导致,而本研究中患者头面部及鼻咽部均出现真菌感染,因此其颅内病灶不排除为感染直接蔓延所致,治疗棘手,危及生命,给临床工作带来极大挑战。
既往报道疣状瓶霉感染引起播散性暗色丝孢霉病与宿主免疫缺陷有关,包括HIV感染、长期使用糖皮质激素及T细胞免疫功能受损等[11]。近年来,CARD9在抗真菌感染中的重要作用受到广泛关注。除无义突变、移码突变导致CARD9蛋白表达缺失而发生真菌感染外,CARD9错义突变导致蛋白功能缺失引起患者真菌感染的报道也逐渐增多。Drewniak等[5]发现1例都柏林念珠菌性脑膜炎患者CARD9发生了复合杂合错义突变(p.Gly72Ser和p.Arg373Pro)。Lanternier等[12-14]、Grumach等[15]和Alves de Medeiros等[16]相继报道了与CARD9纯合错义突变R101C、R18W、R70W、R35Q相关的难治性皮肤癣菌病、播散性皮炎外瓶霉病、白念珠菌性脑膜脑炎、光滑念珠菌性脑膜脑炎,以及肠炎、慢性皮肤黏膜念珠菌病等疾病。结合患者临床表现和既往CARD9相关研究,考虑该患者存在遗传免疫缺陷问题,检测CARD9基因发现两个复合杂合错义突变(p.R35Q和p.E81K),其父母CARD9基因均为杂合突变,符合孟德尔遗传定律,CARD9蛋白表达不缺失。
CARD9存在于人体多种组织中,如肝、脾、外周血、骨髓,并高度表达于骨髓来源巨噬细胞、树突细胞等髓系细胞中[17]。 CARD9作为CLR、Nod样受体等模式识别受体的下游重要连接蛋白,可与胞内B细胞淋巴瘤因子10( B cell lymphoma 10,BCL10)及胃肠黏膜相关淋巴组织1(mucosa-associated lymphoid tissue 1,MALT1)结合形成CBM复合物,激活天然免疫和适应性免疫反应,发挥抗真菌免疫作用[18]。本课题组Wang等[4]曾报道4例顽固性难治皮下型暗色丝孢霉病,患者存在CARD9基因无义和(或)移码突变,造成CARD9蛋白缺失。体外实验提示,CARD9基因缺陷树突细胞诱导Th17细胞分化的能力降低,导致患者皮下疣状瓶霉感染迁延不愈。Liang等[19]研究CARD9基因缺陷患者,体外细胞实验显示CARD9参与中性粒细胞抗疣状瓶霉过程中细胞因子TNF-α、IL-8、IL-6的表达。Wu等[20]利用CARD9基因敲除小鼠建立疣状瓶霉感染的暗色丝孢霉病模型,模拟CARD9缺陷患者的疣状瓶霉感染,发现CARD9基因敲除小鼠疣状瓶霉易感性明显增加,感染后期还可发生脑、肺、肝、脾、肾、淋巴结等全身多系统播散,死亡率为100%。本例患者疣状瓶霉感染逐渐播散至全身,发生播散性暗色丝孢霉病,CARD9基因为新发错义突变,CARD9蛋白表达不缺失,免疫学检测发现外周血中Th1和Th17细胞比例减少,CARD9突变的PBMC中疣状瓶霉孢子刺激后的ROS生成虽不缺乏,但天然免疫细胞因子TNF-α、IL-1β、IL-6,以及适应性免疫细胞因子IFN-γ、IL-17、IL-22分泌缺陷,GM-CSF分泌减少,清除真菌能力减弱,导致患者真菌感染症状进行性加重。
随着人们对CARD9基因缺陷等免疫缺陷病的真菌易感性的认识不断提高,尝试通过免疫治疗来纠正免疫缺陷患者难治性真菌感染的报道相继出现。Gavino等[21]采用皮下注射GM-CSF成功缓解了1例CARD9缺陷的白念珠菌性脑膜脑炎患者症状。Celmeli等[22]采用皮下注射粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF),也使CARD9缺陷的难治性白念珠菌性脑膜脑炎患者痊愈;与使用GM-CSF相比,治疗时间缩短且效果持续。本例患者曾接受皮下注射IFN、GM-CSF等免疫治疗措施,但未见明显效果。治疗效果的差异可能与感染的菌种特异性、器官特异性及患者免疫状况相关。尽管免疫治疗应用于此类顽固性难治暗色真菌感染还有很长的路要走,但相信随着对不同真菌成分及毒力的进一步研究,对宿主抗真菌免疫的深入认识及遗传学的不断发展,未来会研发出新的疫苗、细胞因子制剂等免疫治疗及基因治疗方法,为患者健康带来福音。
[1] Chowdhary A, Perfect J, de Hoog GS. Black molds and melanized yeasts pathogenic to humans [J]. Cold Spring Harb Perspect Med, 2014, 5 (8): a019570.
[2] Revankar SG, Sutton DA. Melanized fungi in human disease [J]. Clin Microbiol Rev, 2010, 23 (4): 884-928.
[3] Engelhardt KR, Grimbacher B. Mendelian traits causing susceptibility to mucocutaneous fungal infections in human subjects [J]. J Allergy Clin Immunol, 2012, 129(2): 294-305.
[4] Wang X, Wang W, Lin Z, Wang X, Li T, Yu J, Liu W, Tong Z, Xu Y, Zhang J, Guan L, Dai L, Yang Y, Han W, Li R. CARD9 mutations linked to subcutaneous phaeohyphomycosis and TH17 cell deficiencies [J]. J Allergy Clin Immunol, 2014, 133(3): 905-908.
[5] Drewniak A, Gazendam RP, Tool AT, van Houdt M, Jansen MH, van Hamme JL, van Leeuwen EM, Roos D, Scalais E, de Beaufort C, Janssen H, van den Berg TK, Kuijpers TW. Invasive fungal infection and impaired neutrophil killing in human CARD9 deficiency [J]. Blood, 2013, 121(13): 2385-2392.
[6] Gao LJ, Yu J, Wang DL, Li RY. Recalcitrant primary subcutaneous phaeohyphomycosis due to Phialophora verrucosa [J]. Mycopathologia, 2013, 175(1-2): 165-170.
[7] Li Y, Wan Z, Li R. In vitro activities of nine antifungal drugs and their combinations against Phialophora verrucosa [J]. Antimicrob Agents Chemother, 2014, 58(9): 5609-5612.
[8] Keyser A, Schmid FX, Linde HJ, Merk J, Birnbaum DE. Disseminated Cladophialophora bantiana infection in a heart transplant recipient [J]. J Heart Lung Transplant, 2002, 21 (4): 503-505.
[9] 叶枫, 吴璐璐, 苏丹虹, 曾庆思, 陈荣昌. 肺部暗色丝孢霉病1例并文献复习 [J].中国感染与化疗杂志, 2014, 14(3): 229-234.
[10] 常杏芝, 李建国, 李若瑜, 包新华, 万哲, 秦炯. 中枢神经系统暗色丝孢霉病1例及文献复习 [J]. 实用儿科临床杂志, 2006, 21(10): 619-621.
[11] Tong Z, Chen SC, Chen L, Dong B, Li R, Hu Z, Jiang P, Li D, Duan Y. Generalized subcutaneous phaeohyphomycosis caused by Phialophora verrucosa: report of a case and review of literature [J]. Mycopathologia, 2013, 175 (3-4): 301-306.
[12] Lanternier F, Pathan S, Vincent QB, Liu L, Cypowyj S, Prando C, Migaud M, Taibi L, Ammar-Khodja A, Boudghene Stambouli O, Guellil B, Jacobs F, Goffard JC, Schepers K, del Marmol V, Boussofara L, Denguezli M, Larif M, Bachelez H, Michel L, Lefranc G, Hay R, Jouvion G, Chretien F, Fraitag S, Bougnoux ME,Boudia M, Abel L, Lortholary O, Casanova JL, Picard C, Grimbacher B, Puel A. Deep dermatophytosis and inherited CARD9 deficiency [J]. N Engl J Med, 2013, 369(18): 1704-1714.
[13] Lanternier F, Barbati E, Meinzer U, Liu L, Pedergnana V, Migaud M, Héritier S, Chomton M, Frémond ML, Gonzales E, Galeotti C, Romana S, Jacquemin E, Angoulvant A, Bidault V, Canioni D, Lachenaud J, Mansouri D, Mahdaviani SA, Adimi P, Mansouri N, Jamshidi M, Bougnoux ME, Abel L, Lortholary O, Blanche S, Casanova JL, Picard C, Puel A. Inherited CARD9 deficiency in 2 unrelated patients with invasive Exophiala infection [J]. J Infect Dis, 2015, 211(8): 1241-1250.
[14] Lanternier F, Mahdaviani SA, Barbati E, Chaussade H, Koumar Y, Levy R, Denis B, Brunel AS, Martin S, Loop M, Peeters J, de Selys A, Vanclaire J, Vermylen C, Nassogne MC, Chatzis O, Liu L, Migaud M, Pedergnana V, Desoubeaux G, Jouvion G, Chretien F, Darazam IA, Schäffer AA, Netea MG, De Bruycker JJ, Bernard L, Reynes J, Amazrine N, Abel L, Van der Linden D, Harrison T, Picard C, Lortholary O, Mansouri D, Casanova JL, Puel A. Inherited CARD9 deficiency in otherwise healthy children and adults with Candida species-induced meningoencephalitis, colitis, or both [J]. J Allergy Clin Immunol, 2015, 135(6): 1558-1568.
[15] Grumach AS, de Queiroz-Telles F, Migaud M, Lanternier F, Filho NR, Palma SM, Constantino-Silva RN, Casanova JL, Puel A. A homozygous CARD9 mutation in a Brazilian patient with deep dermatophytosis [J]. J Clin Immunol, 2015, 35(5): 486-490.
[16] Alves de Medeiros AK, Lodewick E, Bogaert DJ, Haerynck F, Van Daele S, Lambrecht B, Bosma S, Vanderdonckt L, Lortholary O, Migaud M, Casanova JL, Puel A, Lanternier F, Lambert J, Brochez L, Dullaers M. Chronic and invasive fungal infections in a family with CARD9 deficiency [J]. J Clin Immunol, 2016, 36(3): 204-209.
[17] Hsu YM, Zhang Y, You Y, Wang D, Li H, Duramad O, Qin XF, Dong C, Lin X. The adaptor protein CARD9 is required for innate immune responses to intracellular pathogens [J]. Nat Immunol, 2007, 8(2): 198-205.
[18] Gross O, Gewies A, Finger K, Schäfer M, Sparwasser T, Peschel C, Förster I, Ruland J. Card9 controls a non-TLR signalling pathway for innate anti-fungal immunity [J]. Nature, 2006, 442 (7103): 651-656.
[19] Liang P, Wang X, Wang R, Wan Z, Han W, Li R. CARD9 deficiencies linked to impaired neutrophil functions against Phialophora verrucosa [J]. Mycopathologia, 2015, 179(5-6):347-357.
[20] Wu W, Zhang R, Wang X, Song Y, Liu Z, Han W, Li R. Impairment of immune response against dematiaceous fungi in Card9 knockout mice [J]. Mycopathologia, 2016, 181 (9-10):631-642.
[21] Gavino C, Cotter A, Lichtenstein D, Lejtenyi D, Fortin C, Legault C, Alirezaie N, Majewski J, Sheppard DC, Behr MA, Foulkes WD, Vinh DC. CARD9 deficiency and spontaneous central nervous system candidiasis: complete clinical remission with GM-CSF therapy [J]. Clin Infect Dis, 2014, 59(1): 81-84.
[22] Celmeli F, Oztoprak N, Turkkahraman D, Seyman D, Mutlu E, Frede N, Köksoy S, Grimbacher B. Successful granulocyte colony-stimulating factor treatment of relapsing Candida albicans meningoencephalitis caused by CARD9 deficiency [J]. Pediatr Infect Dis J, 2016, 35(4): 428-431.
. LI Ruoyu, E-mail: mycolab@126.com
CARD9 mutations and related immunological research of one case with disseminated phaeohyphomycosis
ZHANG Ruijun, WANG Xiaowen, WAN Zhe, LI Ruoyu
DepartmentofDermatologyandVenereology,PekingUniversityFirstHospital,ResearchCenterforMedicalMycology,PekingUniversity,BeijingKeyLaboratoryofMolecularDiagnosisofDermatoses,Beijing100034,China
Phaeohyphomycosis is a collection of superficial cutaneous, subcutaneous and(or) systemic infections caused by diverse dematiaceous fungi. The clinical records and clinical samples collected from a patient with a diagnosis of skin and subcutaneous phaeohyphomycosis progressed to disseminated phaeohyphomycosis were subjected to assays for potential genetic and immune defects that might associate with the infection. Two new compound heterozygous missense mutations on caspase recruitment domain-containing protein 9 gene (CARD9) (p.R35Q and p.E81K) were detected. Compared with the healthy donors, the proportions of Th1 and Th17 cells in the patient’s peripheral blood lymphocytes (PBLs) were low and the patient’s peripheral blood mononuclear cells (PBMCs) had impaired innate and adaptive immune responses againstPhialophoraverrucosa(P.verrucosa). The results indicated that CARD9 protein may play an important role in the pathogenesis of phaeohyphomycosis.
Disseminated phaeohyphomycosis;CARD9;Phialophoraverrucosa; Peripheral blood mononuclear cell; Immunodeficiency
国家自然科学基金(81472890),北京大学“985工程”临床医院合作专项(2014-1-3)
李若瑜
2016-11-11)

